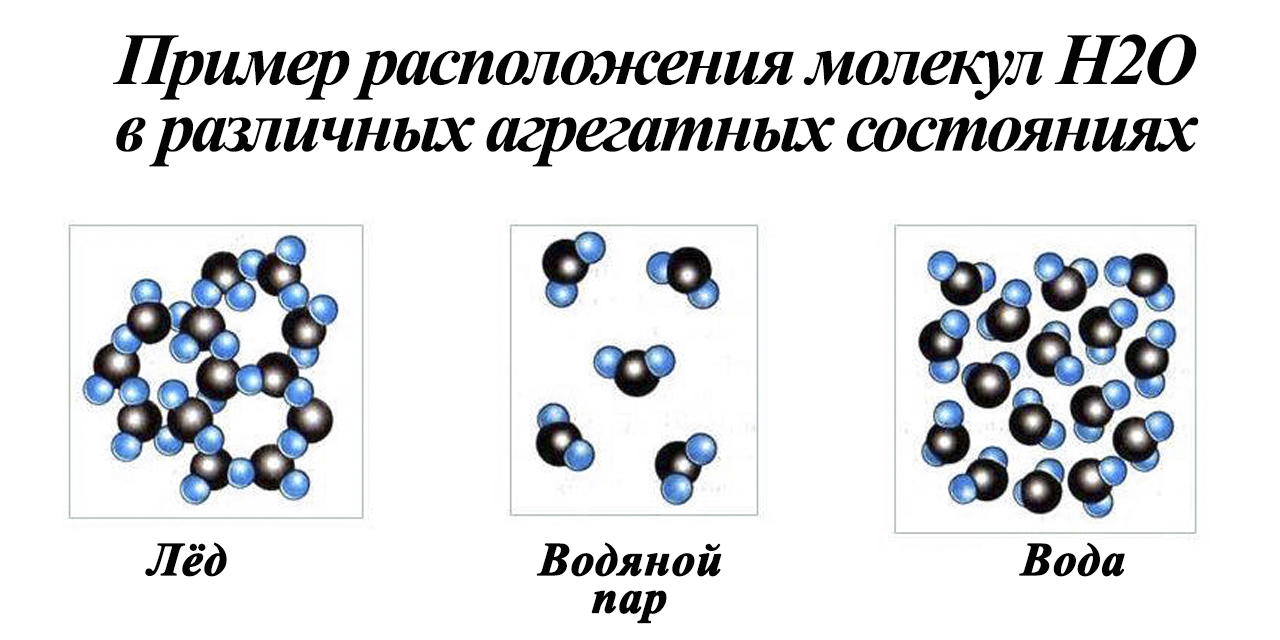
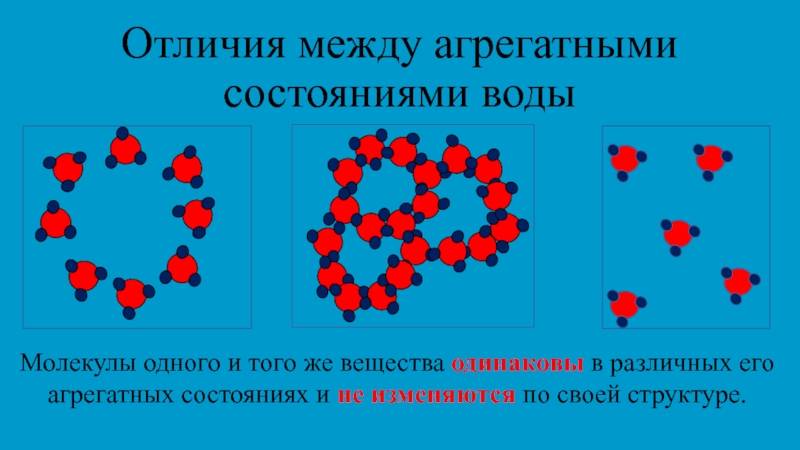
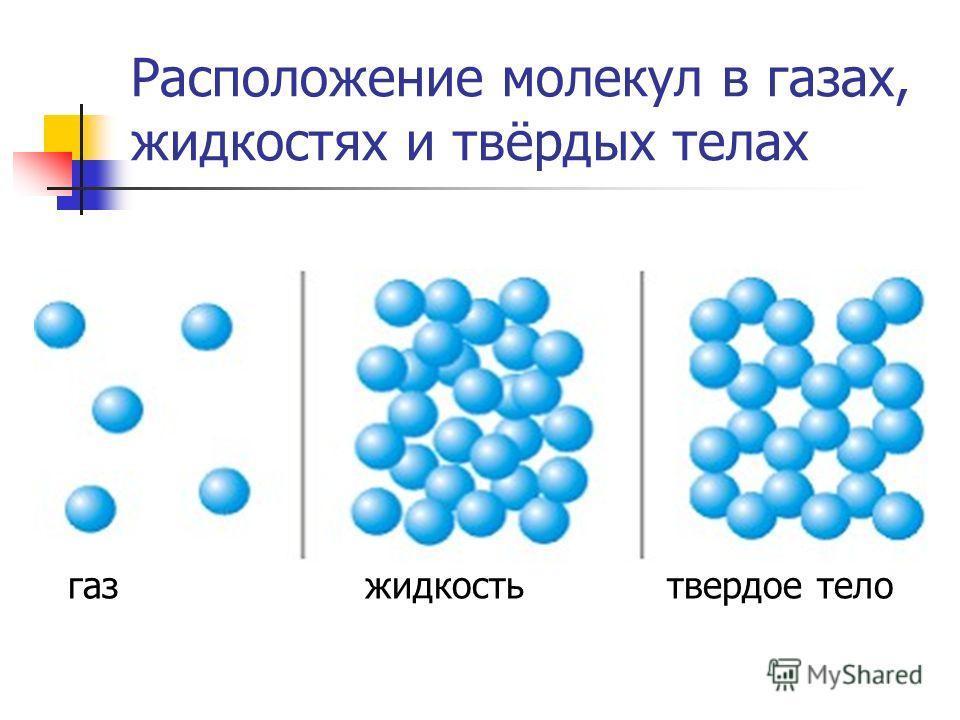
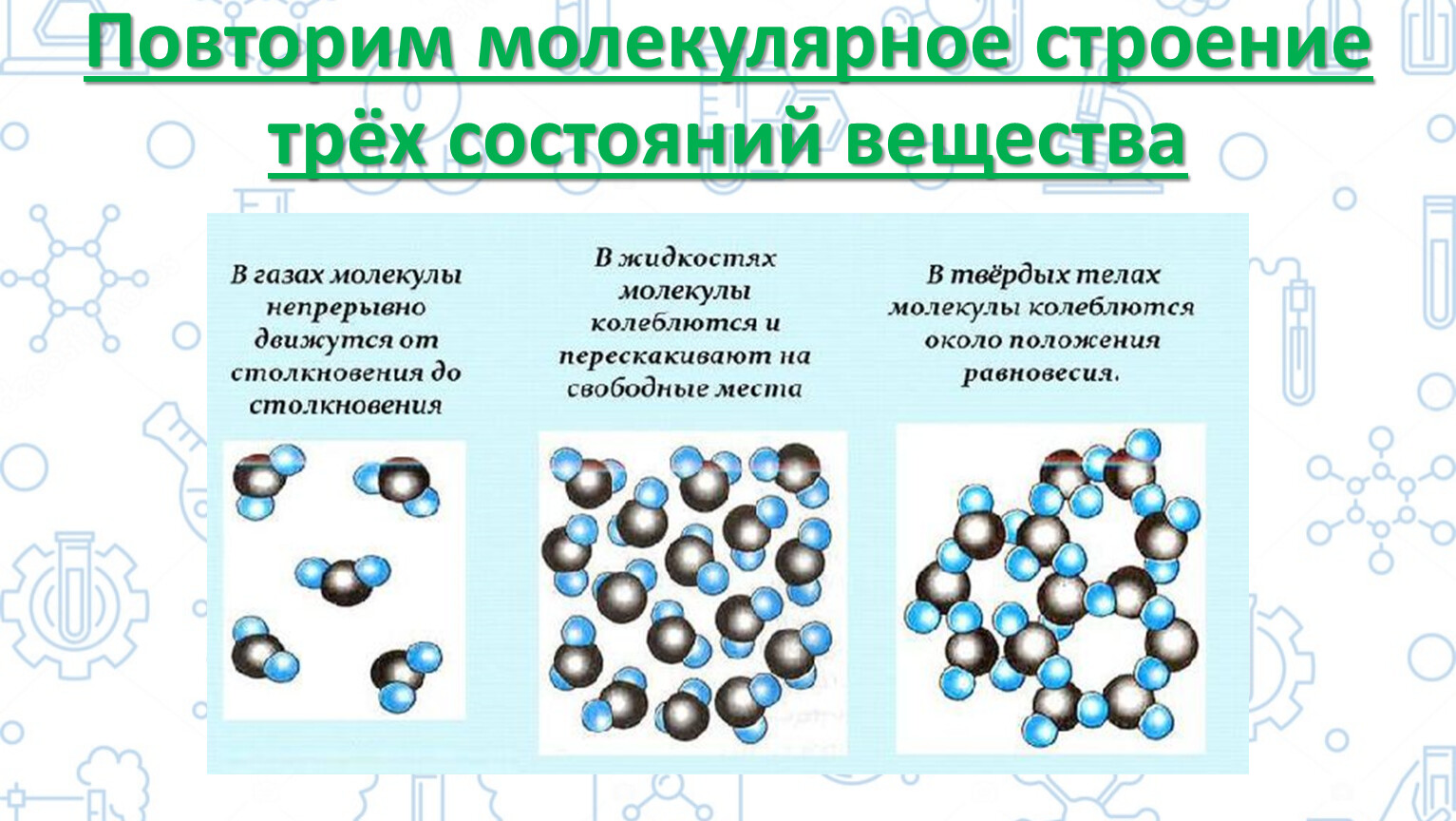
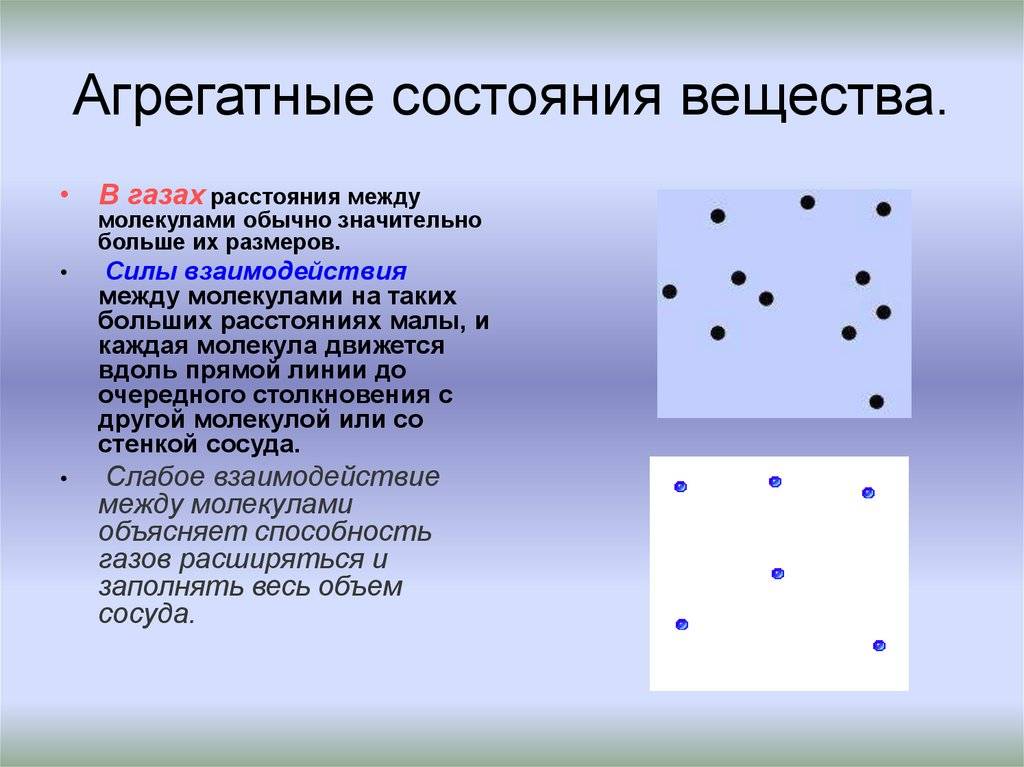
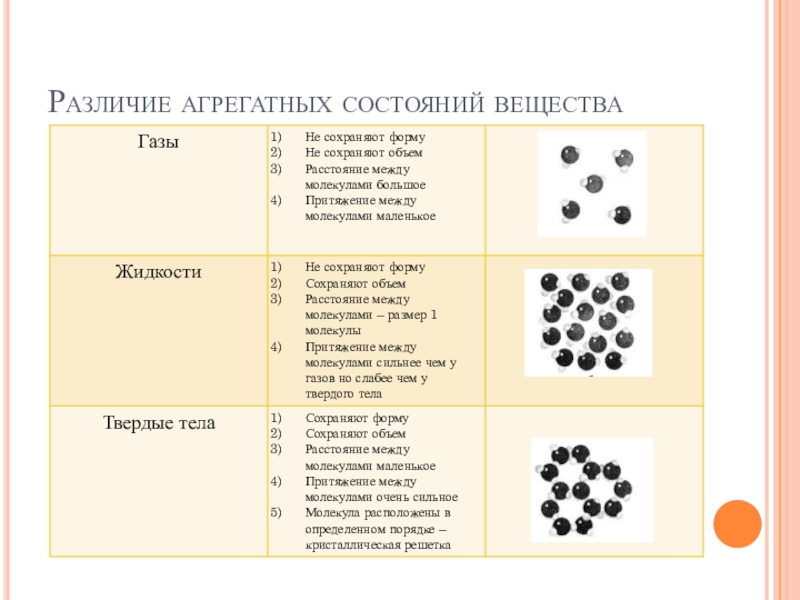
Одно и то же вещество в разных состояниях
Тело образуют молекулы вещества, которое в разных условиях находятся в каком-либо агрегатном состоянии. Стоит напомнить понятие «агрегатное» (изучается в 7 классе). Латинское слово «aggrego» означает «присоединяю». Под воздействием температуры и давления вещество представляется в одном из состояний:
Есть еще одно, достаточно сложное состояние – плазма, но здесь более характерными являются не физические, а химические свойства.

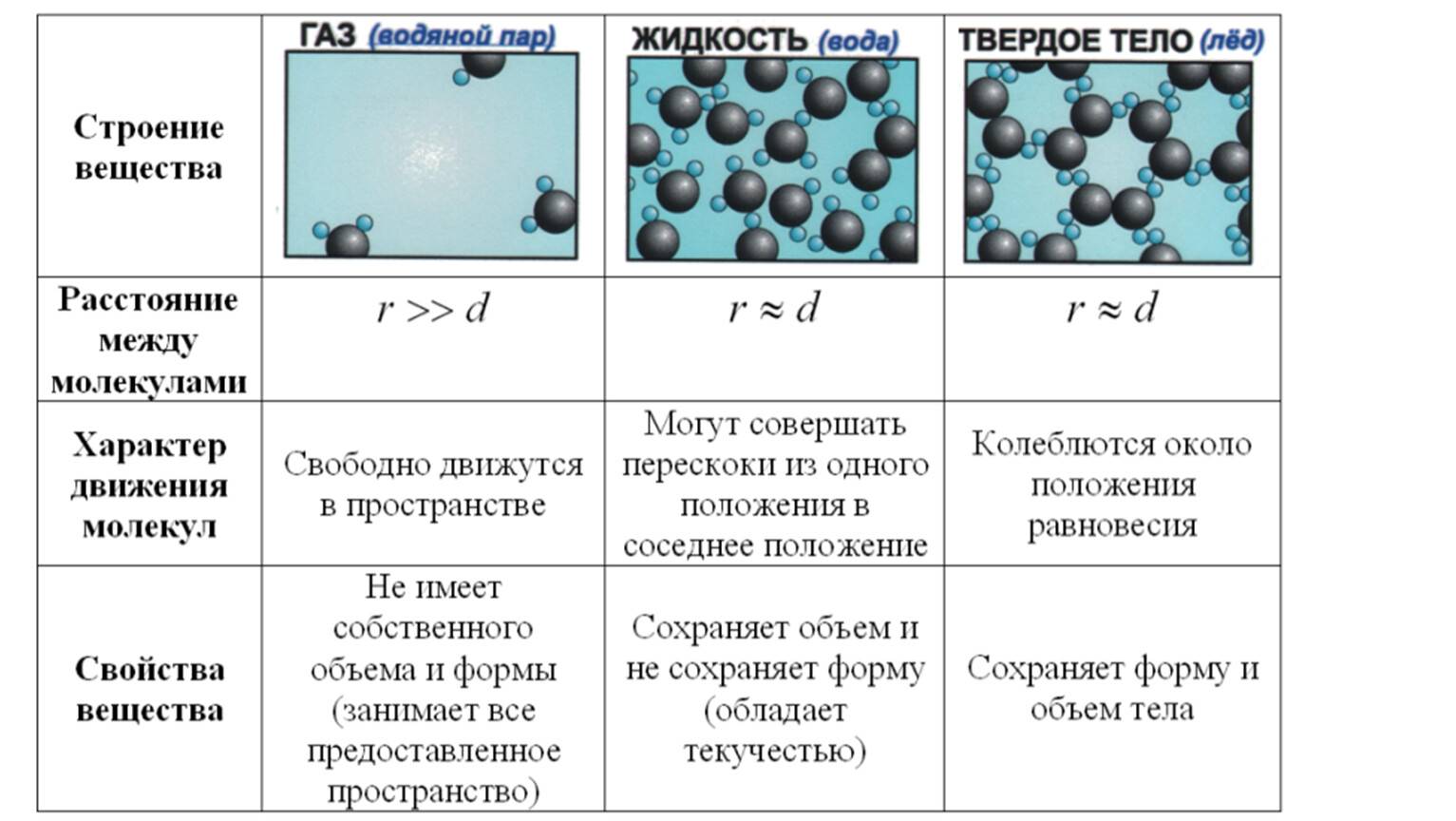
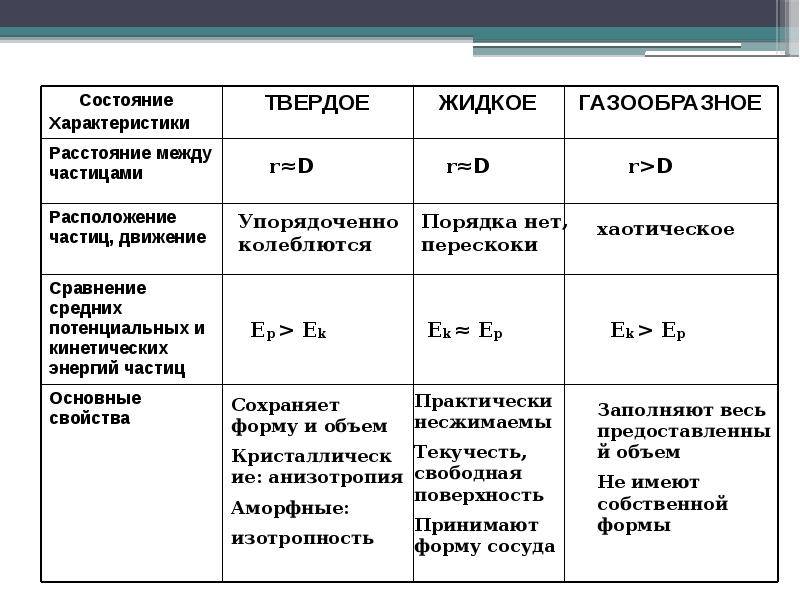
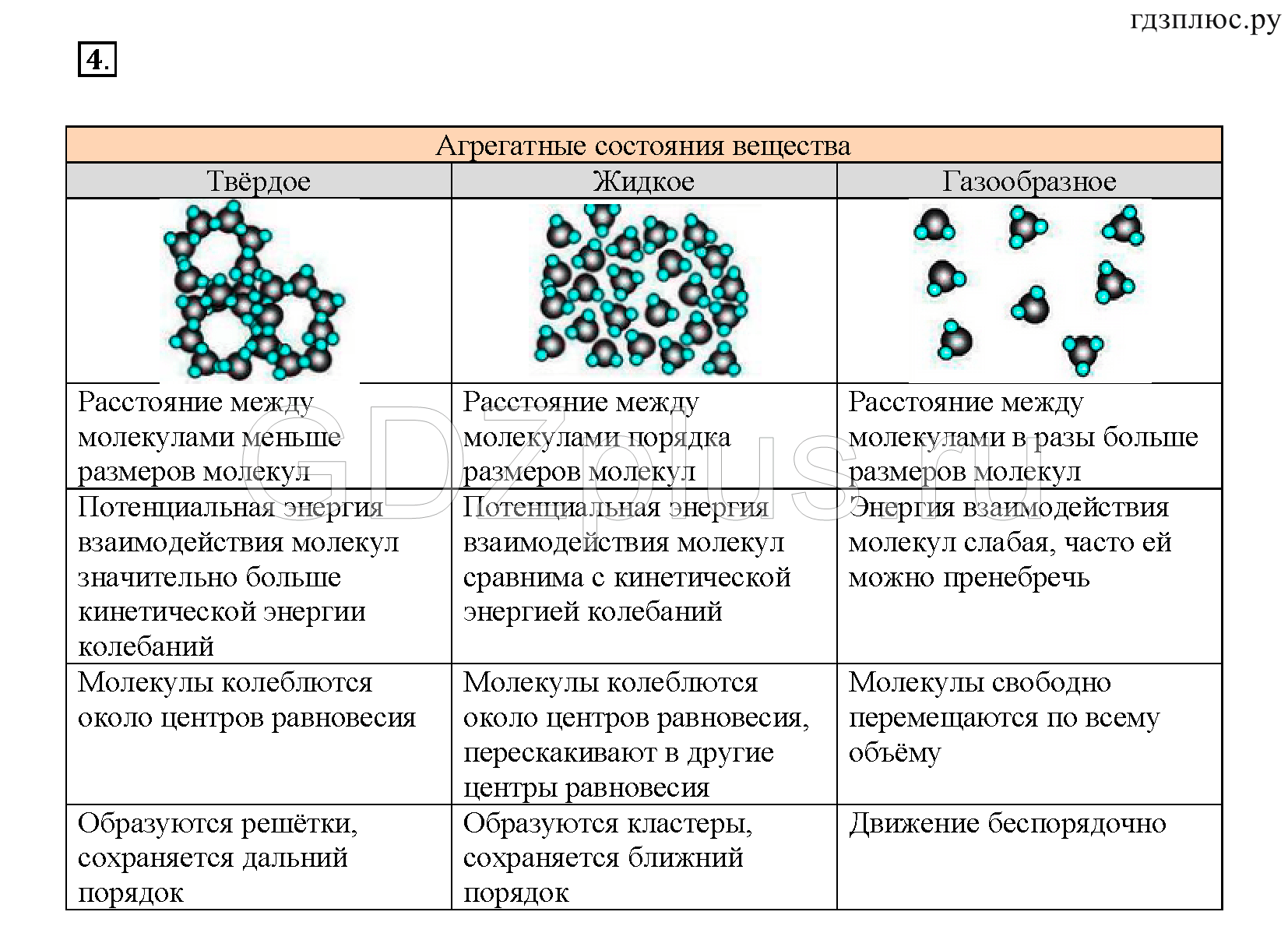
Схема показывает соотношение потенциальной и кинетической энергий молекул внутри тела. В твердом состоянии характерно значительное превышение потенциальной энергии (Еп ˃˃ Ек) над кинетической. Поэтому молекулы движутся по-другому, не как в жидкости, где потенциальная энергия больше (Еп ˃ Ек), но не значительно. В случае с газом расстояния между молекулами велики, и энергия взаимодействия (потенциальная) на много меньше (Еп ˂˂ Ек) энергии движения (кинетической).
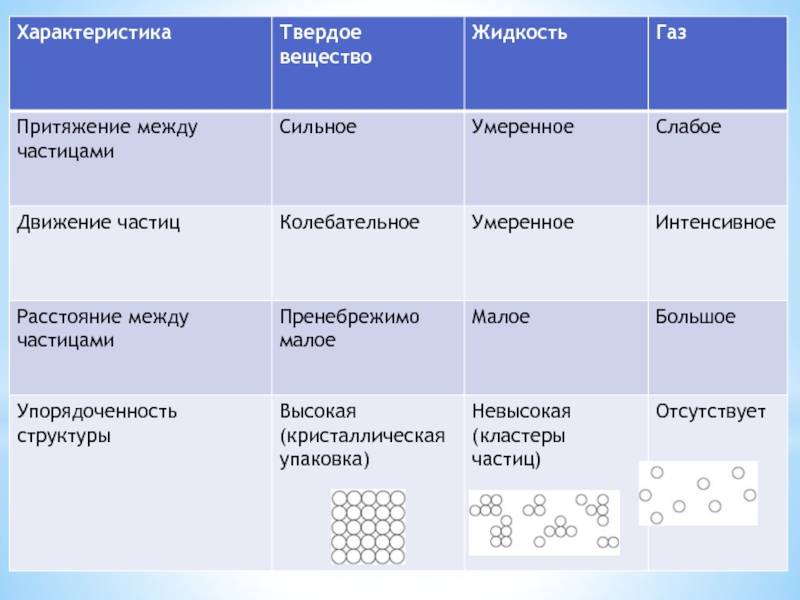
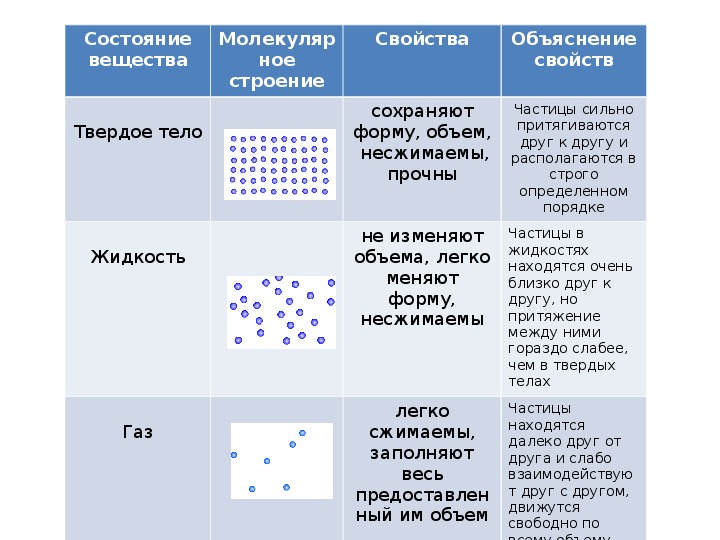
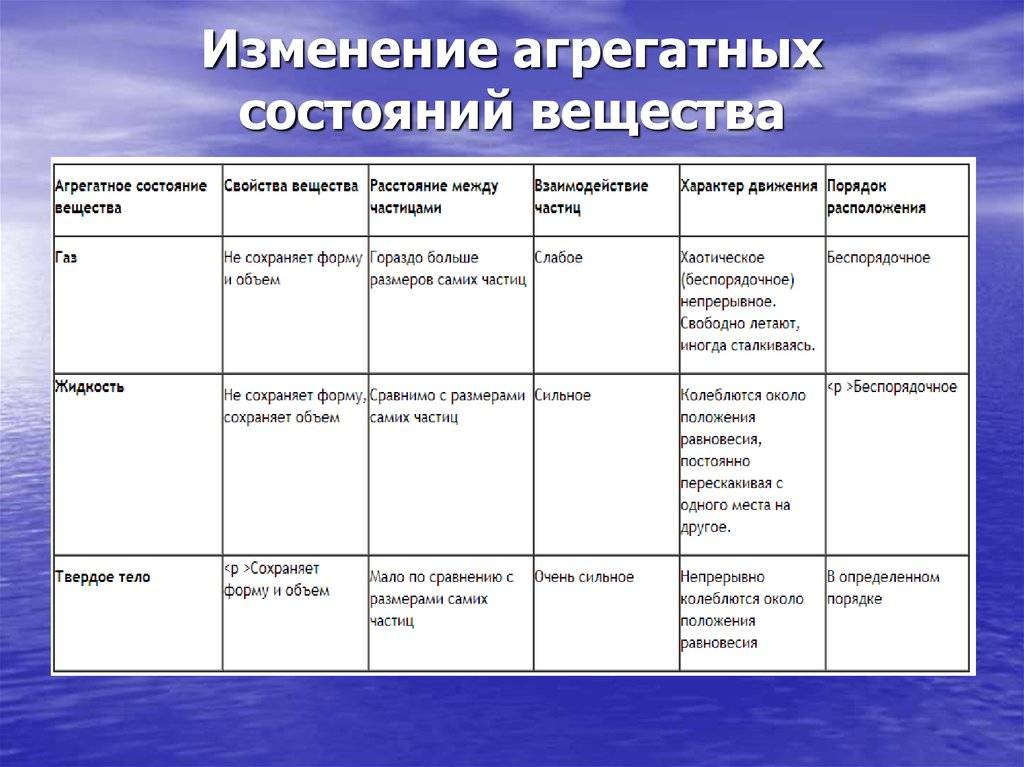
Движение частиц в твердом веществе затруднено, поэтому молекулы лишь колеблются или вращаются около одного места, а движения по всему телу нет. Это создает внутренний порядок, неизменную форму, постоянный объем, прочность. Существуют кристаллические (к примеру, поваренная соль, алмаз, золото) и аморфные (многие пластмассы, стекло, смола и др.) вещества. Молекулы в таких состояниях образуют системы, похожие на решетки: кристаллические решетки имеют правильную форму (одинаковые расстояния и равные углы), аморфные решетки – неправильную форму (расстояния различны и углы различны).
Когда молекулы еще хорошо контактируют, но структура решеток частично нарушается – это уже жидкость. Упорядоченность частиц уменьшается, но все же ее больше, чем в газе. Жидкость – состояние промежуточное между газообразным и твердым.
Газ или пар обычно рассматривается одинаково. Здесь далекие друг от друга, быстрые молекулы создают сильно разреженную систему частиц. В газе очень большие скорости и незначительные силы взаимодействия частиц. Поэтому между молекулами существует много свободного пространства, что приводит во-первых к стремлению газа занимать большие объемы, а во-вторых, наоборот легко сжиматься.
Твёрдое состояние
Если у жидкости, в отличие от газа, молекулы движутся уже не хаотически, а вокруг определенных центров, то в твёрдом агрегатном состоянии вещества
атомы и молекулы имеют четкую структуру и похожи на построенных солдат на параде. И благодаря кристаллической решетке твердые вещества занимают определенный объем и имеют постоянную форму.
При определенных условиях вещества, находящиеся в агрегатном состоянии жидкости, могут переходить в твердое, а твердые тела, наоборот, при нагревании плавиться и переходить в жидкое.
Это происходит потому, что при нагревании увеличивается внутренняя энергия, соответственно молекулы начинают двигаться быстрее, а при достижении температуры плавления кристаллическая решетка начинает разрушаться и изменяется агрегатное состояние вещества. У большинства кристаллических тел объем увеличивается при плавлении, но есть исключения, например – лед, чугун.
В зависимости от вида частиц, образующих кристаллическую решетку твердого тела, выделяют следующую структуру:
молекулярную,
металлическую.
У одних веществ
изменение агрегатных состояний
происходит легко, как, например, у воды, для других веществ нужны особые условия (давление, температура). Но в современной физике ученые выделяют еще одно независимое состояние вещества – плазма.
Плазма
– ионизированный газ с одинаковой плотностью как положительных, так и отрицательных зарядов
. В живой природе плазма есть на солнце, или при вспышке молнии. Северное сияние и даже привычный нам костер, согревающий своим теплом во время вылазки на природу, также относится к плазме.
Искусственно созданная плазма добавляет яркости любому городу. Огни неоновой рекламы – это всего лишь низкотемпературная плазма в стеклянных трубках. Привычные нам лампы дневного света тоже заполнены плазмой.
Плазму делят на низкотемпературную – со степенью ионизации около 1% и температурой до 100 тысяч градусов, и высокотемпературную – ионизация около 100% и температурой в 100 млн градусов (именно в таком состоянии находится плазма в звездах).
Низкотемпературная плазма в привычных нам лампах дневного света широко применяется в быту.
Высокотемпературная плазма используется в реакциях термоядерного синтеза и ученые не теряют надежду использовать ее в качестве замены атомной энергии, однако контроль в этих реакциях очень сложен. А неконтролируемая термоядерная реакция зарекомендовала себя как оружие колоссальной мощности, когда 12 августа 1953 года СССР испытал термоядерную бомбу.
Купить
Для проверки усвоения материала предлагаем небольшой тест.
1. Что не относится к агрегатным состояниям:
жидкость
свет +
2. Вязкость ньютоновских жидкостей подчиняется:
закону Архимеда
закону вязкости Ньютона +
3. Почему атмосфера Земли не улетает в открытый космос:
потому что молекулы газа не могут развить вторую космическую скорость
потому что на молекулы газа воздействует сила земного притяжения +
оба ответа правильные
4. Что не относится к аморфным веществам:
- сургуч
железо +
5.При охлаждении объем увеличивается у:
льда +
ОПРЕДЕЛЕНИЕ
Вещество
– это совокупность большого количества частиц (атомов, молекул или ионов).
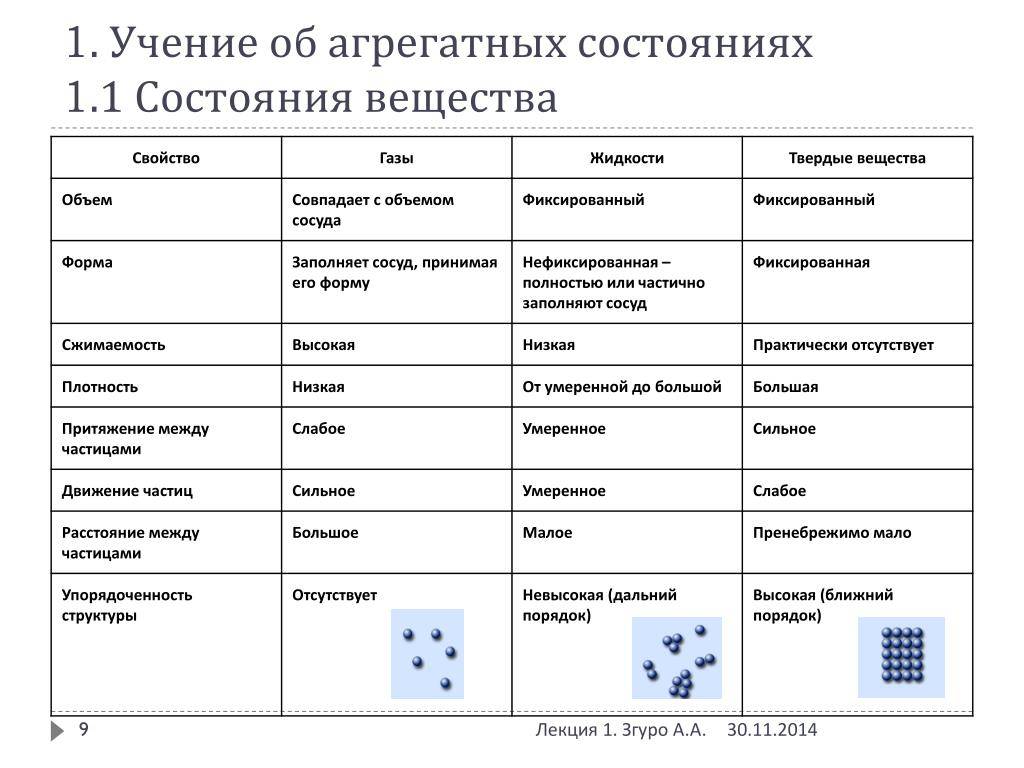
Вещества имеют сложное строение. Частицы в веществе взаимодействуют между собой. Характер взаимодействия частиц в веществе определяет его агрегатное состояние.
Жидкие и твердые тела
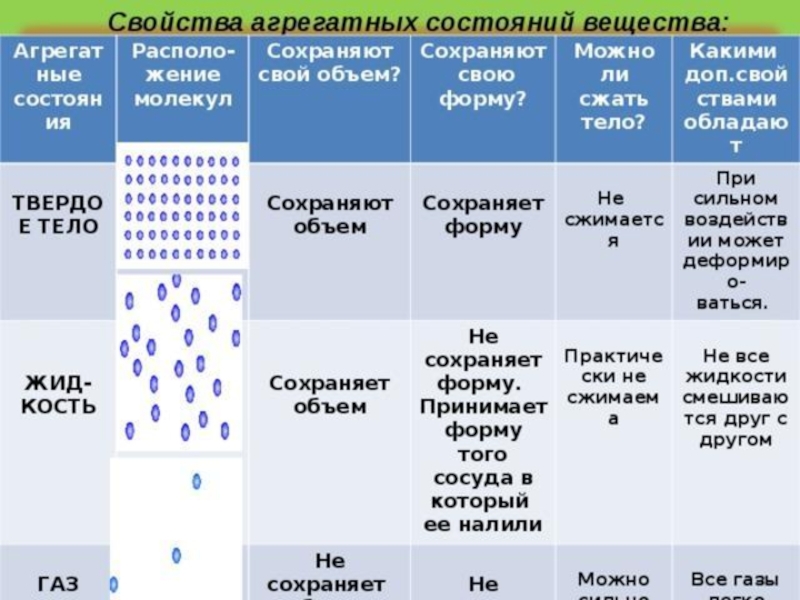
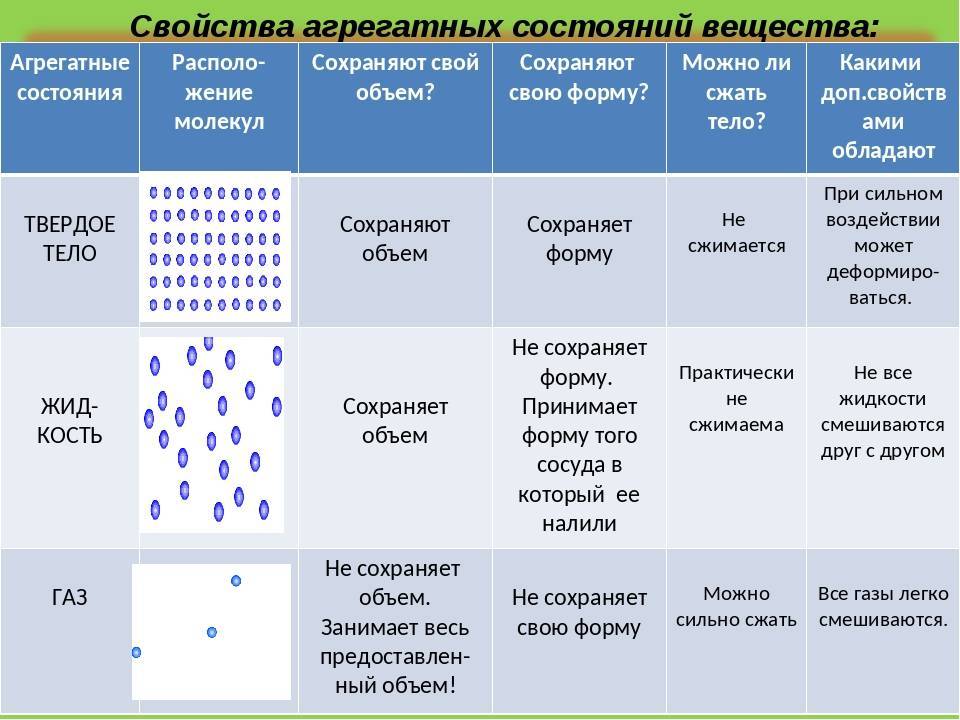
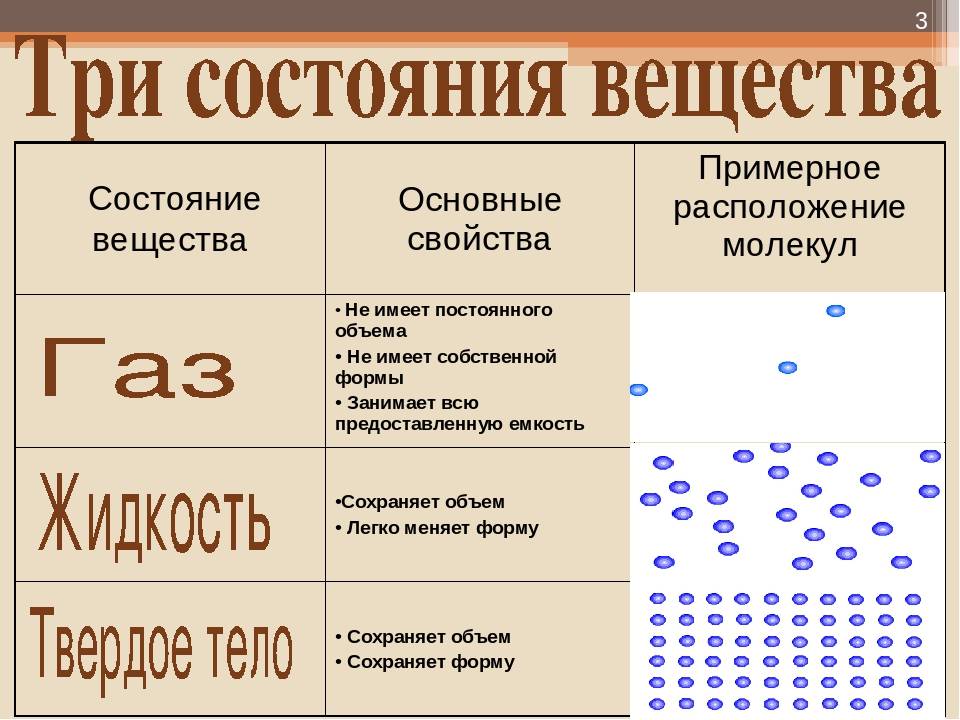
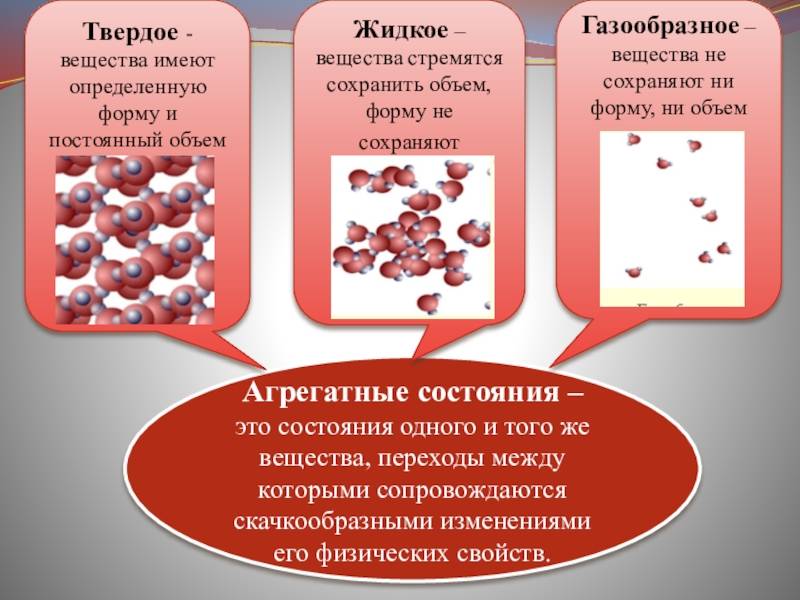
Твердыми телами называют те тела, отличительной чертой которого является постоянство объема и формы.
Межмолекулярные расстояния в твердых телах довольно малы, потенциальная энергия молекул аналогична кинетической энергии. Такие тела подразделяют на две разновидности: аморфные и кристаллические. В состоянии термодинамического равновесия могут быть только твердые тела кристаллического типа. Если говорить об аморфных телах, то им свойственно метастабильное состояние – по своему строению они сходны с неравновесными жидкостями, которые долго кристаллизуются. В аморфном теле процесс кристаллизации (постепенный переход в другую фазу) протекает очень медленно. Главное отличное кристаллов от аморфных тел – это анизотропия его свойств. Направление в пространстве оказывает существенное влияние на характеристики кристаллического тела. Такие процессы как электропроводность и теплопроводность, звук и свет, распространяются в разных направлениях в зависимости от твёрдого тела. В случае аморфных тел (пластмассы, смолы и так далее) наблюдается изотропия, аналогичная жидкостям. Единственное их отличие в том, что жидкостям свойственна текучесть и статическая деформация сдвига в них оказывается невозможной.
Для кристаллических тел является характерным правильное молекулярное строение. Именно благодаря этому оказывается возможной анизотропия его характеристик. Правильным образом расположенные атомы кристалла образуют кристаллическую решётку. Расположение атомов в таких решётках может меняться в разных направлениях, что и приводит к анизотропии. Ионы, атомы или даже целые молекулы в такой решётке совершают беспорядочные движения колебательного характера, рассматриваемые в качестве её узлов. Чем большей будет температура, тем большей окажется энергия колебаний и как следствие – возрастёт среднее значение амплитуды колебаний. Размер кристалла находится в зависимости от данных колебаний. Растущая амплитуда колебаний является причиной роста размеров тела. Таким образом, объясняется расширение твёрдых тел под действием тепла.
Жидкими являются те тела, которые обладают конкретным объемом, но при этом лишенные упругости формы.
Жидкостям свойственно сильное межмолекулярное взаимодействие и малая способность изменения объема. Такое состояние является промежуточным между газом и твердым телом. Аналогично газам, жидкости изотропны и не имеют касательных напряжений тел. Помимо этого, им свойственна текучесть. Жидкости характеризуются тяжестью, следовательно, их удельный вес соответствует удельному весу тел, находящихся в твердом состоянии. Вблизи температурных значений кристаллизации их теплоемкость и прочие тепловые показатели находятся довольно близко к аналогичным показателям твёрдых тел.
До определенной степени в жидкостях может быть зафиксировано правильное расположение атомов, но исключительно в малых областях. Тут атомами также совершается движение колебательного типа в районе узлов квазикристаллической ячейки, но они отличаются от атомов твёрдых тел тем, что с той или иной периодичностью перескакивают между узлами. Вследствие этого движение атомов усложняется: оно становится колебательным, но при этом центр колебаний будет перемещаться в пространстве.
Жидкое состояние
При повышении давления и/или снижении температуры газы можно перевести в жидкое состояние. Еще на заре ХIХ века английскому физику и химику Майклу Фарадею удалось перевести в жидкое состояние хлор и углекислый газ, сжимая их при очень низких температурах. Однако некоторые из газов не поддались ученым в то время, и, как оказалось, дело было не в недостаточном давлении, а в неспособности снизить температуру до необходимого минимума.
Жидкость, в отличие от газа, занимает определенный объем, однако она также принимает форму заполняемого сосуда ниже уровня поверхности. Наглядно жидкость можно представить как круглые бусины или крупу в банке. Молекулы жидкости находятся в тесном взаимодействии друг с другом, однако свободно перемещаются относительно друг друга.
Если на поверхности останется капля воды, через какое-то время она исчезнет. Но мы же помним, что благодаря закону сохранения массы-энергии, ничто не пропадает и не исчезает бесследно. Жидкость испарится, т.е. изменит свое агрегатное состояние на газообразное.
Испарение
– это процесс преобразования агрегатного состояния вещества, при котором молекулы, чья кинетическая энергия превышает потенциальную энергию межмолекулярного взаимодействия, поднимаются с поверхности жидкости или твердого тела
.
Испарение с поверхности твердых тел называется сублимацией
или возгонкой
. Наиболее простым способом наблюдать возгонку является использование нафталина для борьбы с молью. Если вы ощущаете запах жидкости или твердого тела, значит происходит испарение. Ведь нос как раз и улавливает ароматные молекулы вещества.
Жидкости окружают человека повсеместно. Свойства жидкостей также знакомы всем – это вязкость, текучесть. Когда заходит разговор о форме жидкости, то многие говорят, что жидкость не имеет определенной формы. Но так происходит только на Земле. Благодаря силе земного притяжения капля воды деформируется.
Однако многие видели как космонавты в условиях невесомости ловят водяные шарики разного размера. В условиях отсутствия гравитации жидкость принимает форму шара. А обеспечивает жидкости шарообразную форму сила поверхностного натяжения. Мыльные пузыри – отличный способ познакомиться с силой поверхностного натяжения на Земле.
Еще одно свойство жидкости – вязкость. Вязкость зависит от давления, химического состава и температуры. Большинство жидкостей подчиняются закону вязкости Ньютона, открытому в ХIХ веке. Однако есть ряд жидкостей с высокой вязкостью, которые при определенных условиях начинают вести себя как твердые тела и не подчиняются закону вязкости Ньютона. Такие растворы называются неньютоновскими жидкостями. Самый простой пример неньютоновской жидкости – взвесь крахмала в воде. Если воздействовать на неньютоновскую жидкость механическими усилиями, жидкость начнет принимать свойства твердых тел и вести себя как твердое тело.
Твердое состояние: особенности и свойства
Основные особенности твердого состояния:
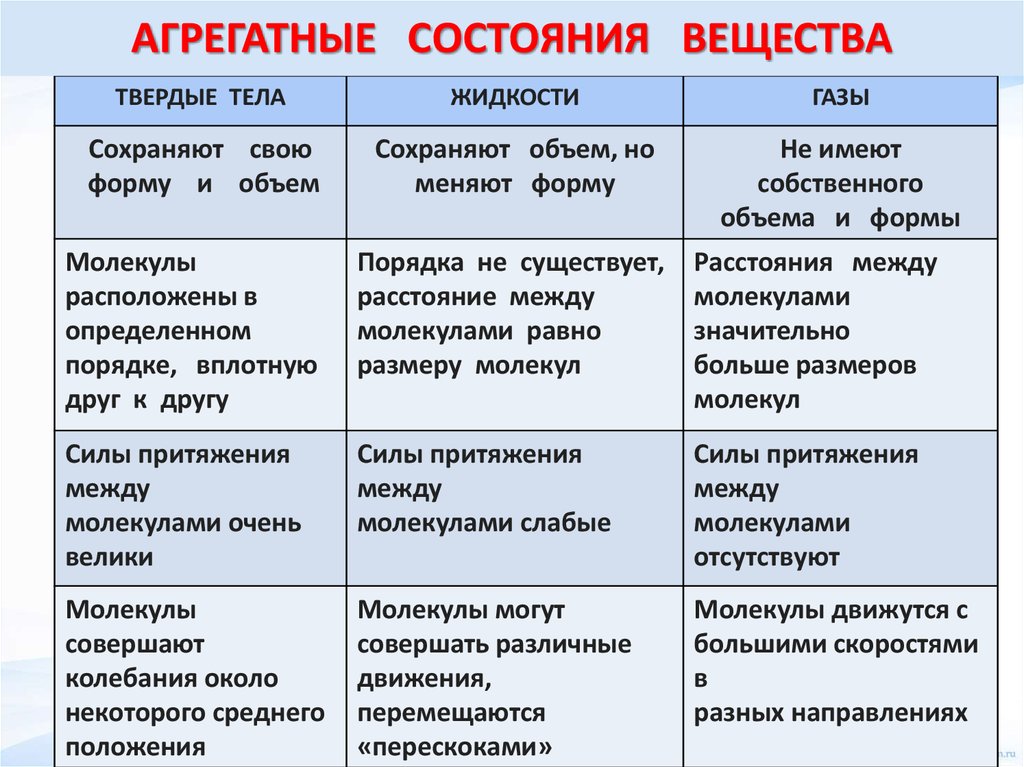
- Молекулы, атомы или ионы, образующие твердые вещества, находятся в фиксированном положении. Они колеблются только вокруг своих исходных позиций, практически не меняя расстояние между друг другом.
- Твердые вещества обладают определенной формой и объемом. Они имеют жесткую структуру, которая не подвержена расширению или сжатию под воздействием давления.
- Кристаллические твердые вещества имеют регулярную и упорядоченную структуру, образованную решеткой из атомов или ионов. Аморфные твердые вещества, напротив, не обладают строго упорядоченной структурой.
- Твердые вещества имеют высокую плотность по сравнению с газообразными и жидкими веществами. Это связано с тесной упаковкой молекул или атомов.
- Свойства твердых веществ, такие как твердость, прочность и теплопроводность, также обусловлены особенностями их структуры.
Твердое состояние вещества является наиболее распространенным и используется во многих сферах нашей жизни. Оно обеспечивает прочность и устойчивость материалов, используемых в строительстве, машиностроении, электронике и других отраслях. Также твердое состояние позволяет образовывать различные кристаллические структуры, которые являются основой для множества химических соединений и минералов.
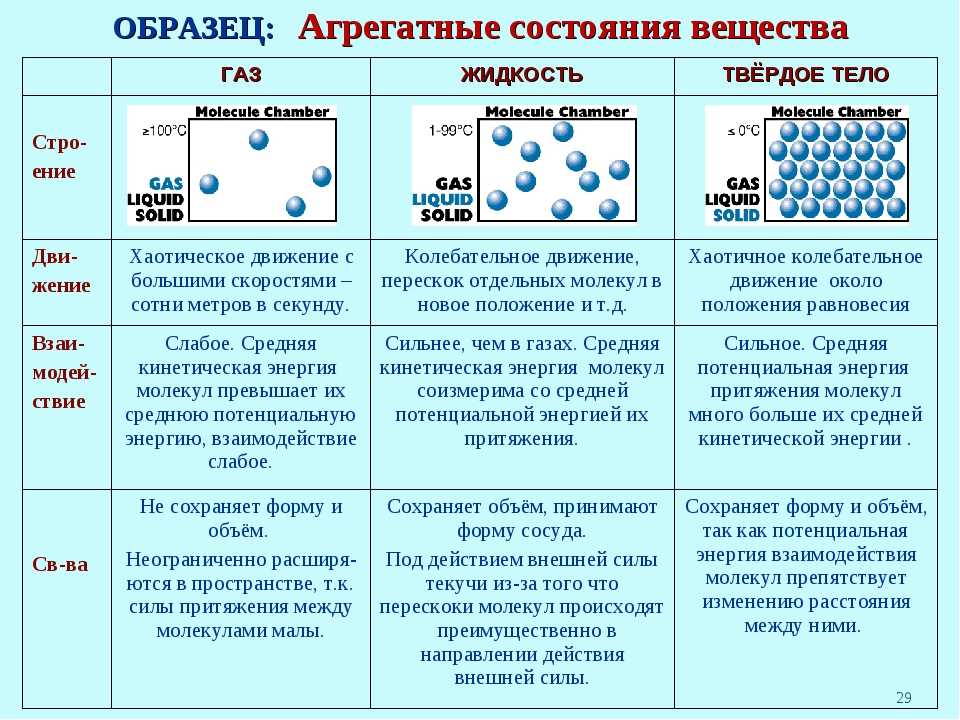
| Свойство | Твердое состояние | Газообразное состояние |
|---|---|---|
| Форма | Определенная форма | Нет определенной формы |
| Объем | Определенный объем | Принимает объем сосуда |
| Плотность | Высокая плотность | Низкая плотность |
| Расстояние между молекулами | Малое расстояние | Большое расстояние |
Газообразное состояние
При нормальных условиях (273 К, 101325 Па) в газообразном состоянии могут находиться как простые вещества, молекулы которых состоят из одного атома (Не, Ne, Ar) или из нескольких несложных атомов (Н2, N2, O2), так и сложные вещества с малой молярной массой (СН4 , HCl, C2H6).
Поскольку кинетическая энергия частиц газа превышает их потенциальную энергию, то молекулы в газообразном состоянии непрерывно хаотически двигаются. Благодаря большим расстояниям между частицами силы межмолекулярного взаимодействия в газах настолько незначительны, что их не хватает для привлечения частиц друг к другу и удержания их вместе. Именно по этой причине газы не имеют собственной формы и характеризуются малой плотностью и высокой способностью к сжатию и к расширению. Поэтому газ постоянно давит на стенки сосуда, в котором он находится, одинаково во всех направлениях.
Для изучения взаимосвязи между важнейшими параметрами газа (давление Р, температура Т, количество вещества n, молярная масса М, масса m) используется простейшая модель газообразного состояния вещества — идеальный газ, которая базируется на следующих допущениях:
- взаимодействием между частицами газа можно пренебречь;
- сами частицы являются материальными точками, которые не имеют собственного размера.
Наиболее общим уравнением, описывающим модель идеального газа, считается уравнения Менделеева-Клапейрона для одного моля вещества:
Однако поведение реального газа отличается, как правило, от идеального. Это объясняется, во-первых, тем, что между молекулами реального газа все же действуют незначительные силы взаимного притяжения, которые в определенной степени сжимают газ. С учетом этого общее давление газа возрастает на величину a/V2, которая учитывает дополнительное внутреннее давление, обусловленное взаимным притяжением молекул. В результате общее давление газа выражается суммой Р+ а/V2. Во-вторых, молекулы реального газа имеют хоть и малый, но вполне определенный объем b , поэтому действительный объем всего газа в пространстве составляет V — b. При подстановке рассмотренных значений в уравнение Менделеева-Клапейрона получаем уравнение состояния реального газа , которое называется уравнением Ван-дер-Ваальса:
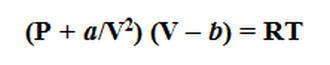
где а и b — эмпирические коэффициенты, которые определяются на практике для каждого реального газа. Установлено, что коэффициент a имеет большую величину для газов, которые легко сжижаются (например, СО2 , NH3 ), а коэффициент b — наоборот, тем выше по величине, чем больше размеры имеют молекулы газа (например, газообразные углеводороды).
Уравнение Ван-дер-Ваальса гораздо точнее описывает поведение реального газа, чем уравнения Менделеева-Клапейрона, которое тем не менее, благодаря наглядному физическому смыслу широко используется в практических расчетах. Хотя идеальное состояние газа является предельным, мнимым случаем, однако простота законов, которые ему отвечают, возможность их применения для описания свойств многих газов в условиях низких давлений и высоких температур делает модель идеального газа очень удобной.
Твердые тела
При нормальных условиях находятся в стабильной форме и сохраняют свой объем. По внутреннему строению и свойствам разделяются на кристаллические и аморфные. Первые отличаются строго упорядоченным положением частиц, между которыми установлены сильные взаимосвязи — ковалентные полярные и неполярные, ионные, металлические. Тип взаимодействия определяет физические свойства твердого тела. Это, как правило, металлы и их оксиды, обладающие хорошей тепло- и электропроводностью, прочные и упругие.
Свойства аморфных тел близки к жидкостным, так как их молекулы передвигаются между хаотично расположенными условными центрами. К ним относятся разнообразные смолы, пластмассы, стекло и другие неметаллы. Нагревание кристаллических веществ приводит к нарушению упорядоченного расположения частиц, увеличению расстояний между ними и рекристаллизации. При определенной температуре, которая называется температурой плавления, перестройка молекул приводит к превращению твердого тела в жидкость. Количество теплоты, которое нужно, чтобы расплавить некоторую массу вещества, вычисляют по формуле: Q = km, где k — удельная теплота плавления этого вещества, m — его масса.
Молекулярная кинетическая энергия остается неизменной, поэтому дальнейшее нагревание вещества не приводит к повышению его температуры до тех пор, пока все оно не превратится в жидкость. Если продолжать нагрев, то с поверхности расплавленного металла начнется испарение — беспорядочный отрыв отдельных молекул, который является началом перехода в газообразное состояние. При кристаллизации, начинающейся при снижении температуры, остывающее тело само отдает тепло в атмосферу.
Опытным путем установлено, что температуры плавления и кристаллизации у каждого металла равны друг другу, а их точно известное значение отличает кристаллические тела от аморфных. В отличие от металлов, аморфные вещества не плавятся, а размягчаются. Например, стекло при нагревании сначала становится мягким, его легко согнуть или растянуть.
Жидкость — одно из базовых агрегатных состояний
Если налить в круглодонную колбу 50 мл воды, то можно заметить, что вещество сразу же примет форму химического сосуда. Но как только мы выльем воду из колбы, то жидкость сразу же растечется по поверхности стола. Объем воды останется тот же — 50 мл, а ее форма изменится. Перечисленные особенности характерны для жидкой формы существования материи. Жидкостями являются многие органические вещества: спирты, растительные масла, кислоты.
Молоко — эмульсия, т. е. жидкость, в которой находятся капельки жира. Полезное жидкое ископаемое — нефть. Добывают ее из скважин с помощью буровых вышек на суше и в океане. Морская вода тоже является сырьем для промышленности. Ее отличие от пресной воды рек и озер заключается в содержании растворенных веществ, в основном солей. При испарении с поверхности водоемов в парообразное состояние переходят только молекулы Н 2 О, растворенные вещества остаются. На этом свойстве основаны методы получения полезных веществ из морской воды и способы ее очистки.
При полном удалении солей получают дистиллированную воду. Она кипит при 100 °С, замерзает при 0 °С. Рассолы кипят и превращаются в лед при других температурных показателях. Например, вода в Северном Ледовитом океане замерзает при температуре на поверхности 2 °С.
Агрегатное состояние ртути при обычных условиях — жидкость. Этим серебристо-серым металлом обычно заполняют медицинские термометры. При нагревании столбик ртути поднимается по шкале, происходит расширение вещества. Почему же в используется подкрашенный красной краской спирт, а не ртуть? Объясняется это свойствами жидкого металла. При 30-градусных морозах агрегатное состояние ртути меняется, вещество становится твердым.
Если медицинский термометр разбился, а ртуть вылилась, то собирать руками серебристые шарики опасно. Вредно вдыхать пары ртути, это вещество очень токсичное. Детям в таких случаях надо обратиться за помощью к родителям, взрослым.

Жидкие вещества
Жидкое вещество обычно содержится в каком-либо сосуде. При этом оно может занимать только его часть, но перетекать по всей поверхности. Это объясняется тем, что жидкость имеет следующие свойства:
- сохраняет объём;
- неограниченно меняет форму под действием механических напряжений.

Жидкость — промежуточное состояние между твёрдым и газообразным. Её связи с ними следующие:
- при испарении (с помощью нагрева, уменьшения атмосферного давления или вакуумирования) превращается в газ;
- при замерзании — в твёрдое тело.
Переход между фазами обусловлен не только температурой, но и давлением.
Область применения

Способность металлов плавиться и поддаваться обработке в жидком состоянии широко применяется в черной и цветной металлургии. В технологиях получения соли и других химических соединений используется процесс выпаривания, при котором нужное вещество получается после испарения жидкости. В разных областях промышленности и техники распространено применение жидких газов.
Инертные газы используются в осветительных приборах, жидкий кислород — в медицине в качестве средства анестезии, при сварке металлов в смеси с ацетиленом.
Источник
Изменение жидкостей
Жидкости — это тела, занимающие весь объем, в котором находятся, образующие поверхность, но не способные удерживать упругую форму. Для них свойственно сильное межмолекулярное взаимодействие и низкая сжимаемость, что определяет их положение между газообразным и твердым АС. Жидкости изотропны, текучи и обладают удельным весом, сравнимым с тем же показателем у твердых тел.
Правильное расположение внутренних частиц распространяется на небольшие области — они не только колеблются вокруг узлов так называемой квазикристаллической решетки, но и могут перескакивать между ними. Получается сложная траектория — колебания вокруг центра, перемещающегося в пространстве. Этим объясняется текучесть тел в жидком АС. Если понизить температуру до границ кристаллизации, то различные тепловые свойства жидкостей приблизятся к показателям твердых тел.
Процесс парообразования
Некоторые молекулы жидкости могут преодолеть силы поверхностного натяжения и перейти в парообразную форму, чем объясняется явление испарения, происходящее при любой температуре. Когда она повышается, процесс становится интенсивней и распространяется на весь объем. Появляется все больше пузырьков насыщенного пара, прорывающихся из глубины на поверхность.
При температуре кипения, имеющей определенное значение для каждого жидкого тела, давление пара внутри пузырьков превышает атмосферное, и начинается интенсивный переход жидкости в газообразное АС. При пониженном атмосферном давлении температура кипения той же жидкости становится ниже.
Динамическое равновесие
Когда жидкость находится в открытой емкости, то ее количество обязательно уменьшится вследствие испарения. Но если сосуд закрыть, то этого не произойдет. Сначала начнется процесс испарения и продолжится до тех пор, пока число покинувших жидкость молекул не станет равно возвратившимся назад из паров.
Можно сказать, что замкнутая система придет в динамическое (подвижное) равновесие, так как процесс обмена молекул будет продолжаться и дальше, т. е. испарение и конденсация в замкнутой системе происходят одновременно и компенсируют друг друга. Пар, который находится в таком равновесии с соответствующей жидкостью, называется насыщенным. Изменение внутренней энергии вещества определяется по формуле: ΔU = ± mr, где m — масса тела, r — удельная теплота парообразования.
Динамическое равновесие у разных жидкостей наступает при разной плотности пара. Это зависит от силы межмолекулярного взаимодействия. Если они велики как, например, у ртути, то только незначительное число самых быстрых молекул может покидать поверхность жидкости, а равновесие наступает при малой плотности пара. У летучих жидкостей молекулы разлетаются очень быстро, поэтому нужна высокая плотность для наступления равновесия.
Основные различия между твердым веществом, жидкостью и газом
Разница между твердым веществом, жидкостью и газом может быть четко определена по следующим причинам:
- Вещество, обладающее структурной жесткостью и имеющее твердую форму, которую трудно изменить, называется твердым веществом. Водоподобная жидкость, которая течет свободно, имеет определенный объем, но не имеет постоянной формы, называется жидкостью. Газ относится к состоянию вещества, не имеет какой-либо формы, но полностью соответствует форме контейнера, в который он помещен.
- Хотя твердые вещества имеют определенную форму и объем, жидкости имеют только определенный объем, но не форму, газы не имеют ни формы, ни объема.
- Уровень энергии самый высокий в газах, средний в жидкости и самый низкий в твердых веществах.
- Сжатие твердых частиц затруднено, жидкости почти несжимаемы, но газы легко сжимаются.
- Молекулярное расположение твердых веществ является регулярным и близким, но жидкости имеют неправильное и редкое молекулярное расположение, а газы также имеют случайное и более редкое расположение молекул.
- Молекулярное расположение в твердых телах хорошо организовано. Однако в случае жидкостей слои молекул скользят и скользят друг над другом. Напротив, частицы в газах совсем не организованы, из-за чего частицы движутся случайно.
- Когда дело доходит до текучести, твердые вещества не могут течь, однако жидкости могут течь, и это также от более высокого уровня до более низкого уровня. В отличие от этого газы текут во всех направлениях.
- Пространства между молекулами и кинетической энергией минимальны в твердых телах, средние в жидких и максимальные в газах. Таким образом, движение молекул незначительно в твердых телах, тогда как в жидкостях наблюдается беспорядочное, случайное движение молекул. В отличие от газов, которые имеют свободное, постоянное и случайное движение молекул.
- В твердых телах частицы плотно удерживаются сильным межмолекулярным притяжением, хотя в жидкостях притяжение между частицами является промежуточным. В отличие от этого частицы слабо удерживаются, потому что межмолекулярное притяжение слабое.
- Скорость звука самая высокая в твердых телах, а скорость немного ниже в жидкостях и минимальная в газах.
- Поскольку твердые вещества имеют определенную форму и размер, им не требуется контейнер для хранения. Жидкости нельзя хранить без контейнера. И наоборот, для хранения газов необходим закрытый контейнер.
Изменение в состоянии материи
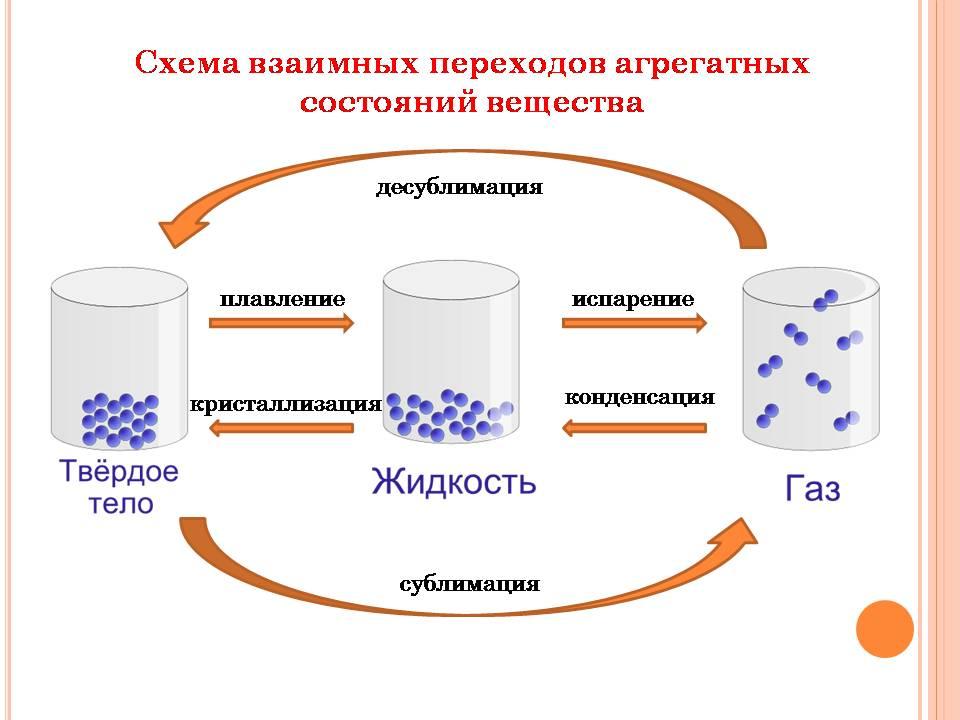
Вещество меняет свое состояние от одной формы к другой, когда нагревается или охлаждается, что подпадает под физическое изменение. Итак, ниже приведены некоторые процессы, посредством которых состояние вещества может быть изменено:
- Плавление : процесс превращения твердого вещества в жидкость.
- Замораживание : процесс, который помогает в превращении жидкости в твердое вещество.
- Испарение : процесс, используемый для превращения жидкости в газ.
- Конденсация : процесс, при котором газ превращается в жидкость.
- Сублимация . Когда твердое вещество превращается в газ, оно называется сублимацией.
- Описание : процесс, посредством которого газ превращается в твердое вещество.
Заключение
Следовательно, в этой статье мы узнали, что вещество присутствует в трех состояниях: твердое тело, жидкость и газ. Кроме того, состояние вещества являются взаимозаменяемыми, то есть форма может быть изменена путем изменения температуры или давления.
Плавится или отвердевает
На примере воды всегда можно наблюдать переходные процессы в веществе. Вода удобна для исследований, так как не нужно создавать специальные сложные условия для опытов. Увидеть плавление и отвердевание можно на улице осенью или весной.
 Тает снег
Тает снег
Весной, когда наступает пора солнечных дней, температура воздуха может быть положительной. А если измерить температуру тающего снега, то она будет равной 0оС, пока весь снег в этом месте не растает. Происходит это следующим образом.
Пусть на улице 5 градусов мороза. Воздух, все предметы вокруг и снег – все имеет температуру -5оС. Весенний воздух и все вокруг нагревается. При достижении нуля градусов воздух и окружающие тела продолжают нагреваться, а снег – нет. Он начинает таять, то есть плавиться. Все тепло, поглощаемое снегом, идет не на рост его внутренней энергии и повышение температуры, а на разрыв связей, которые держат кристаллическую решетку. Решетка постепенно разрушается, идет плавление снега. В нем уже есть частично вода, но еще много твердых частей снега. Похоже это на кашеобразную массу. Вот почему иногда говорят: «Снег сегодня сырой». Пока весь снег не растает, температура этой смеси будет 0оС. И как только вода полностью заменит снег, она, как и все окружающее, начнет под действием солнечных лучей нагреваться.
 Первый лед на лужах
Первый лед на лужах
Осенью, когда температура опускается до 0оС, на лужах образуется первый лед. Вода переходит в твердое состояние. Такой процесс называют отвердеванием или кристаллизацией. А теперь – важный момент. Если температура окружающего воздуха будет понижаться, то количество льда станет больше и лужа застынет до самого дна. Но, пока вся вода в луже не превратится в лед, температура льда и воды останется 0оС. Почему так?
При снижении окружающей температуры вода выделяет (отдает) тепло. Внутренняя энергия соответственно становится меньше. В этой ситуации молекулы начинают объединяться в кристаллическую решетку, происходит отвердевание. В луже есть одновременно и лед, и вода. Пока эта смесь не превратится чисто в лед, тепло будет выделяться наружу, частицы, потерявшие энергию, «будут строить решетку», то есть устанавливать межмолекулярные связи.
Как только лед заполнит всю лужу, его температура начнет снижаться и станет такой же, как и все окружающие предметы.
Кристаллические решетки у веществ различны, соответственно и разрушаются или создаются эти решетки в разных условиях, при разных температурах.
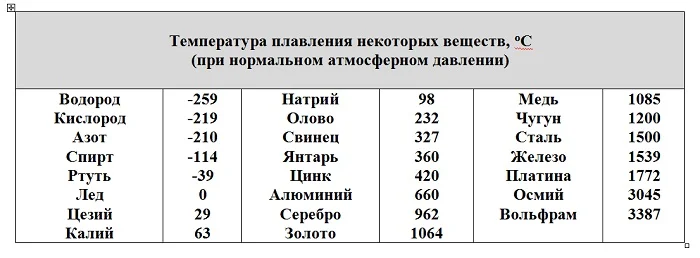
По таблице свободно находится ответ на классический вопрос: можно ли расплавить в серебряной ложке медь и олово? Олово – можно, его температура плавления, 232 градуса, меньше, чем у серебра. Медь расплавить нельзя. Серебро расплавится раньше, чем медь. У серебра температура плавления 962 градуса, а у меди – 1085о С.
 Олово в серебряной ложке Источник
Олово в серебряной ложке Источник
Еще одно интересное сравнение, результаты которого применяются в измерении температуры воздуха. В уличных термометрах используется подкрашенный спирт. Его температура плавления, а значит и кристаллизации -114оС. Значит, спирт в стеклянном столбике прибора будет находиться в жидком виде. Ртуть же имеет температуру кристаллизации -39оС. На севере планеты или в Сибири зимние температуры бывают гораздо ниже. Достигнув -39оС, ртуть в термометре затвердеет и стеклянная трубочка лопнет, прибор испортится. Поэтому используется спиртовой термометр.
В настоящее время жизнь человека немыслима без изделий, полученных путем плавления. Цветная и черная металлургия опираются на процесс плавления и отвердевания. Они же лежат в основе технологий литья деталей машин, металлической и пластиковой посуды, прорезиненной обуви и многого другого.
 Изготовление слитка золота Работа со стеклом
Изготовление слитка золота Работа со стеклом
Интересен старый пример из жизни сельчан, который помогает сохранить бочки, ведра, бидоны, наполненные водой, от разрывания льдом.
 Деревянный кол в бочке с водой
Деревянный кол в бочке с водой
Уезжая со своего участка, многие дачники вставляют в бочку с водой деревянный кол. Им хочется оставить запас воды до следующего приезда. Если дело происходит осенью, то велика вероятность, что в течение недели вода застынет. Кол не позволит разорваться бочке. На ней не будет даже трещин. Объясняется это тем, что присутствие в жидкости посторонних твердых тел облегчает процесс кристаллизации. Эти тела становятся центрами кристаллизации, вокруг которых начинают образовываться кристаллы. В данном случае центром будет кол. Первый лед появится именно на нем, а другие кристаллы начнут к нему прилипать, оттягиваясь от стенок бочки. Поэтому на бочку будет оказано минимальное давление, которое не способно ее испортить.