О путешествиях по всему миру

Чем отличается испарение от кипения
Твердое, жидкое и газообразное — каждое вещество может находиться при определенных условиях в этих агрегатных состояниях. Испарение и кипение представляют собой процесс перехода вещества из жидкого состояния в газообразное.
Сравнение испарения и кипения
В чем же разница между испарением и кипением?
Испарение с поверхности любой жидкости происходит всегда при любой температуре. Молекулы жидкости располагаются почти вплотную друг к другу, они колеблются около своего положения равновесия и связаны между собой силами притяжения. Молекулы жидкости не привязаны к определенным центрам, поэтому могут перемещаться по всей жидкости. Но у жидкостей есть всегда свободная поверхность, пограничный слой с газом. Молекулы в этом слое притягиваются с одной стороны молекулами, которые находятся внутри жидкости. Но наиболее быстрые молекулы, с кинетической энергией, которая выше энергии их связи с остальными молекулами, способны вылететь с поверхности жидкости. Они, отделившись от поверхности жидкости, образуют над ней пар. Часть молекул могут вследствие хаотического движения возвратится обратно в жидкость, а остальные безвозвратно теряются. У оставшихся молекул уменьшается средняя кинетическая энергия, это ведет к охлаждению жидкости.
Кипение — это испарение, которое происходит в самом объеме жидкости. Вода в обычном состоянии при комнатной температуре насыщена воздухом. В жидкости всегда есть пузырьки газа еще до кипения. При нагревании воды газ, который в ней есть, выделяется на дно и стенки сосуда. Так образуются воздушные пузырьки. Если давление насыщенного пара жидкости будет равняться или превышать давление газа в пузырьках, то жидкость начнет испаряться в них. При нагревании пузырьки, которые наполнены паром, раздуваются, расширяются и, наконец, всплывают на поверхность. Кипение представляет собой процесс, при котором происходит непрерывное образование и рост в жидкости пузырьков пара, куда идет испарение жидкости. Кипение данной жидкости происходит при определенной температуре и при определенном давлении и обнаруживается, когда пузырьки пара образуются во всей жидкости. Этот процесс будет происходить, когда давление ее насыщенных паров будет равняться внешнему давлению при определенной температуре.
Испарение — это переход жидкости в газ, который происходит с пограничного слоя жидкости.
Испарение жидкости имеет место быть всегда при любой температуре.
Кипение — это процесс парообразования в жидкости.
Кипение происходит при определённой температуре и давлении.
Газ:
Газ — это одно из агрегатных состояний вещества, обладающее свойствами заполнять все имеющиеся пространства. В отличие от жидкостей и твердых тел, газ не имеет определенной формы и объема, он расширяется, заполняя доступное ему пространство.
Основной характеристикой газа является то, что он может быть сжат и расширен под давлением. Газы обычно имеют низкую плотность по сравнению с жидкостями и твердыми телами, их молекулы находятся на большом расстоянии друг от друга.
Газы обладают плохой теплопроводностью, что означает, что они плохо передают тепло. Это свойство газов объясняется наличием больших промежутков между молекулами, через которые тепловая энергия не может эффективно передвигаться.
В отличие от жидкостей и твердых тел, газы могут существовать при различных температурах и давлениях. Например, вода может существовать в виде газа при высоких температурах и низком давлении, но при низких температурах и высоком давлении она переходит в жидкое состояние.
Определение
Пар и газ — два основных состояния вещества, которые отличаются своим физическим состоянием. Пар является газообразным состоянием вещества при температурах ниже его критической точки. Газ, в свою очередь, является газообразным состоянием при температуре и давлении, которые находятся выше его критических значений.
Основное отличие пара от газа заключается в температуре и давлении, при которых они находятся. Пар образуется при нагревании жидкости до ее кипения или испарения, а газ образуется при нагревании или сжатии уже существующего газа. Кроме того, пар имеет свойства испарительного охлаждения и может конденсироваться обратно в жидкость при снижении температуры и давления.
Эти различия между паром и газом имеют важное значение во многих областях науки и техники. Например, использование пара в паровых двигателях и турбинах позволяет преобразовывать тепловую энергию в механическую энергию, что является основой многих технологических процессов
Понимание отличий между паром и газом помогает оптимизировать эффективность этих процессов и исследовать новые способы использования энергии.
Состояние
Отличие газа от пара
Газ и пар являются двумя различными состояниями вещества. В чем же отличие между ними?
Газ — это состояние вещества, при котором его молекулы находятся в свободном движении и занимают весь объем, в котором они находятся. Газ стремится заполнить все имеющееся пространство, равномерно распределяться и не имеет определенной формы или объема.
Пар — это тоже газообразное состояние, но пар образуется при нагревании жидкости. В отличие от газа, пар имеет определенную температуру кипения и формируется из веществ, которые при комнатной температуре находятся в жидком состоянии.
Таким образом, отличие между газом и паром заключается в их происхождении. Газ может быть как природным, так и образоваться при изменении давления и температуры. Пар же образуется при переходе вещества из жидкого состояния в газообразное, когда достигается его температура кипения.
Свойства
Газ и пар — два агрегатных состояния вещества, которые отличаются своими свойствами. Газ является состоянием вещества при обычных условиях температуры и давления, когда его молекулы свободно двигаются в пространстве. Пар, в отличие от газа, образуется при переходе вещества из жидкого состояния в газообразное при нагревании.
Одно из отличий между газом и паром — это их температуры кипения. Газы обладают низкой температурой кипения, что означает, что они могут перейти в жидкое состояние при относительно низкой температуре. В то же время, пары образуются при нагревании жидкости до ее точки кипения.
Еще одно отличие между газом и паром — это их плотности. Газы, как правило, имеют низкую плотность, связанную с отсутствием прочных взаимодействий между их молекулами. Пары, с другой стороны, имеют более высокую плотность, так как их молекулы образуются при кипении жидкости и могут находиться ближе друг к другу.
И наконец, газы и пары имеют разную прозрачность. Газы, такие как воздух, прозрачные и невидимы для глаза. Пары, с другой стороны, могут быть видимыми, особенно когда они образуются при кипении воды или других жидкостей.
Что такое пар?
Пар представляет собой тип газа, который находится в равновесном состоянии между газом и водой; он может вернуться в исходное жидкое состояние, если на него будет оказано давление и температура будет постоянной. Исходное состояние пара также может быть твердым, поэтому пар в его нейтральной фазе при комнатной температуре должен быть либо жидким, либо твердым. Пары легче сжимаются по сравнению с газами, так как они постоянно находятся в процессе перехода. Когда пар должен вернуться в исходное состояние, требуется, чтобы на него оказывалось давление, а изменение температуры не требовалось. Пар – это термин, используемый для газообразной молекулы, которая может быть жидкостью при комнатной температуре. Вода, испаряемая из воды, описывается как водяной пар, и когда давление оказывается водяным паром, оно возвращается в жидкое состояние. Другими словами, водяной пар – это вода, присутствующая в газообразном состоянии. Пары видны невооруженным глазом, поскольку в них происходят физические изменения.
Резюме – газ против пара
Газ расположен выше критической точки, а пар – ниже критической точки. Жидкая фаза не может существовать выше критической точки. Пар также существует ниже критической точки. Следовательно, основное различие между газом и паром состоит в том, что газ существует только в одном физическом состоянии, тогда как пар может сосуществовать с другим физическим состоянием.
Изображение предоставлено: 1. «Phase-diag2» от Matthieumarechal (CC BY-SA 3.0) через Commons Wikimedia 2. «Парожидкостная равновесная смесь этанола и воды» Вилфрид Кордес – de: Dortmunder Datenbank; ru: Банк данных Дортмунда (CC BY-SA 3.0) через Commons Wikimedia
Разница между синтез-газом и водяным газом
Определение
Синтез-газ: Синтез-газ – это краткое название синтез-газа, который в основном состоит из оксида углерода (CO), диоксида углерода (CO2) и водород.
Водяной газ: Водяной газ – это горючее, содержащее окись углерода (CO) и водород (H2).
Состав
Синтез-газ: Синтез-газ содержит окись углерода, двуокись углерода и водород.
Водяной газ: Водяной газ содержит окись углерода и водород.
Производство
Синтез-газ: Синтез-газ получают путем газификации углеродсодержащего топлива.
Водяной газ: Водяной газ производится из синтез-газа с использованием реакции конверсии водяного газа.
Заключение
В качестве топливных газов используются синтез-газ и водяной газ. Синтез-газ – это продукт, получаемый в результате газификации углеродсодержащих материалов, таких как уголь. Водяной газ производится из синтез-газа. Основное различие между синтез-газом и водяным газом состоит в том, что синтез-газ состоит из диоксида углерода, тогда как водяной газ не содержит диоксида углерода.
Ссылка:
1. Хельменстин, Энн Мари. «Определение водяного газа». ThoughtCo, 9 августа 2017 г., доступно здесь 2. «Сингаз». Википедия, Фонд Викимедиа, 22 января 2018 г., доступно здесь 3. «Что такое Syngas?» Biofuel.org.uk, доступно здесь.
Безопасность испарителя
Для того, чтобы обеспечить безопасность использования ингаляционных анестетиков, могут быть применены следующие меры:
Специальная маркировка приспособлений для залива ингаляционных анестетиков, позволяющая исключить ошибки при выполнении этой манипуляции
Указатель уровня препарата
Надежный крепеж испарителя, предотвращающий разлив анестетика
Правильное размещение испарителя в контуре
Испарители заполнения размещаются за ротаметрами и перед кислородом
Испарители втягивания располагаются перед дыхательным мехом или мешком
Система специальных замков, предотвращающая некорректное использование различных испарителей
При размещении нескольких испарителей в контуре испарители для анестетиков с более высоким давлением насыщенных паров (ДНП) размещаются в конце. Менее летучие анестетики обладают более низким разделительным соотношением, что снижает контаминацию испарителя, расположенного дальше по ходу контура. Галотановый испаритель располагается последним, для того, чтобы избежать контаминации других испарителей тимолом
Мониторинг анестетика, подтверждающий, что его концентрация в контуре является адекватной
Потенциальные опасности
Переполнение испарителя может привести к непредсказуемому изменению концентрации анестетика на выходе. Жидкий анестетик при этом попадает в контур в избыточном количестве, и концентрация препарата на вдохе резко повышается или, наоборот, при снижении площади поверхности фитиля, снижается. При переполнении испарителя необходимо слить анестетик до рекомендуемого уровня.
Перекрестное или обратное соединение также ведет к непредсказуемому эффекту на выходную концентрацию анестетика. В испарителях Тес производители указывают, что уровень препарата может повышаться в 2 раза. В связи с этим нужно избегать таких технических ошибок.
Опрокидывание испарителя может привести к повышению концентрации ингаляционного анестетика, так как при этом препарат попадает на вход разделительного оборудования. Кроме того, газ в обходном канале также будет загрязнен парами анестетика. После опрокидывания до начала использования через испаритель необходимо пропустить свежий газ в течение 10 мин при газотоке 10 л/мин. В качестве альтернативы можно оставить испаритель в обычном положении до следующего дня.
Некорректное заполнение испарителя другим препаратом. Выходная концентрация анестетика может не соответствовать установленной. Это может вести к передозировке анестетика или к слишком поверхностной анестезии.
Определение пара
Он приобретает такую форму благодаря процессу кипения или нагрева, который происходит, когда мы кипятим воду. В такой момент, когда температура становится равной максимуму, необходимому для придания ей отличительного характера, она начинает испаряться и затем принимает парообразную форму. Пар превращается в газовую стадию при температуре, при которой аналогичное вещество также может существовать в жидком или активном состоянии при начальной температуре элемента. Если пар находится в контакте с жидкостью или последним этапом, эти два этапа будут находиться в состоянии гармонии.
Термин газ указывает на сжимаемую жидкую ступень. Такие газы будут газами, для которых никакая жидкость или активный компонент не могут образовываться при температуре газа, например воздуха при средних окружающих температурах. Жидкость или твердое вещество не нуждаются в пузыре для выпуска пара. Вес такой же, как вес жидкости или стабильной при определенной температуре. В большинстве случаев температурные диапазоны опускаются ниже критических, и даже некоторые приложения давления меняют свое состояние с одного на другое. Для разных веществ температура меняется, чтобы она стала жидкой и поэтому нуждается в надлежащей калибровке.
Фазовые переходы газа и пара
Почему газ и пар можно считать эквивалентными? Основная причина заключается в том, что газ и пар отличаются только температурой и давлением, при которых они существуют. Газ образуется при комнатной температуре и давлении, в то время как пар образуется при повышенных температурах и/или давлениях.
Вещество, находящееся в газообразной фазе, имеет определенную критическую температуру и критическое давление. При превышении этих значений, вещество переходит из газообразной фазы в парообразную. Наоборот, при снижении температуры или давления ниже критических значений, пар может конденсироваться обратно в газообразное состояние.
Фазовые переходы газа и пара играют важную роль во многих процессах и явлениях. Кипение жидкостей, плавление твердых веществ и образование облаков и тумана — все это является результатом фазовых переходов газа и пара.
Таким образом, газ и пар являются двумя состояниями вещества, которые различаются условиями, при которых они существуют. Однако, они эквивалентны друг другу, так как могут превращаться друг в друга при изменении температуры и давления.
Главное отличие
Людям трудно дифференцировать его между газом и паром, поскольку последний также является разновидностью газа, и он не обозначен как любое другое отдельное состояние вещества. Газ – это состояние вещества, которое имеет наименьшее межмолекулярное притяжение между своими молекулами и невидимо невооруженным глазом. В противоположность этому, пар – это состояние равновесия между газами и жидкостью, которое может прийти в норму до своей первоначальной формы, жидкости после того, как на нее будет оказано давление и температура будет постоянной. Здесь следует отметить, что газообразный материал, который мы получаем из жидкостей в равновесном состоянии, называется паром. Газообразный материал, который мы получаем из воды (жидкость), называется водяным паром, а не водяным газом.
Ключевое различие – газ против пара
Газовая фаза – одна из четырех основных фаз всего вещества, наряду с твердой фазой, жидкой фазой и плазмой. Газы можно четко отличить от твердой и жидкой фаз, потому что, в отличие от твердых тел или жидкостей, атомы находятся в свободном движении и разбросаны по всему контейнеру. Газ и пар кажутся похожими из-за их прозрачности, но это две разные фазы, в которых может существовать материя. В ключевое отличие между газом и паром заключается в том, что газ существует только в одном физическом состоянии тогда как пар может сосуществовать с другим физическим состоянием.
1. Обзор и основные отличия 2. Что такое газ 3. Что такое пар 4. Параллельное сравнение – газ и пар 5. Резюме
Ключевое различие – газ против пара
Газовая фаза – одна из четырех основных фаз всего вещества, наряду с твердой фазой, жидкой фазой и плазмой. Газы можно четко отличить от твердой и жидкой фаз, потому что, в отличие от твердых тел или жидкостей, атомы находятся в свободном движении и разбросаны по всему контейнеру. Газ и пар кажутся похожими из-за их прозрачности, но это две разные фазы, которые могут существовать. В ключевое отличие между газом и паром заключается в том, что газ существует только в одном физическом состоянии в то время как пар может сосуществовать с другим физическим состоянием.
1. Обзор и основные отличия 2. Что такое газ 3. Что такое пар 4. Параллельное сравнение – газ и пар 5. Резюме
Появление газообразных и парообразных состояний вещества
Однако, газ и пар являются одним и тем же веществом, и их различие состоит только в условиях, при которых они находятся. Это объясняется молекулярной природой вещества.
В газе молекулы свободно движутся и заполняют всё доступное пространство. Их движение хаотично и скорости молекул высоки. Газ обладает свойствами компрессии и экспансии.
При повышенной температуре и/или давлении, молекулы вещества получают больше энергии, что позволяет им преодолевать силы притяжения между собой и переходить в парообразное состояние. В паре молекулы также движутся хаотично, но они имеют более высокие скорости движения и занимают меньшее пространство.
Таким образом, газ и пар являются двумя состояниями одного и того же вещества и могут переходить друг в друга при изменении физических условий, таких как температура и давление.
Появление газообразных и парообразных состояний вещества
Однако, газ и пар являются одним и тем же веществом, и их различие состоит только в условиях, при которых они находятся. Это объясняется молекулярной природой вещества.
В газе молекулы свободно движутся и заполняют всё доступное пространство. Их движение хаотично и скорости молекул высоки. Газ обладает свойствами компрессии и экспансии.
При повышенной температуре и/или давлении, молекулы вещества получают больше энергии, что позволяет им преодолевать силы притяжения между собой и переходить в парообразное состояние. В паре молекулы также движутся хаотично, но они имеют более высокие скорости движения и занимают меньшее пространство.
Таким образом, газ и пар являются двумя состояниями одного и того же вещества и могут переходить друг в друга при изменении физических условий, таких как температура и давление.
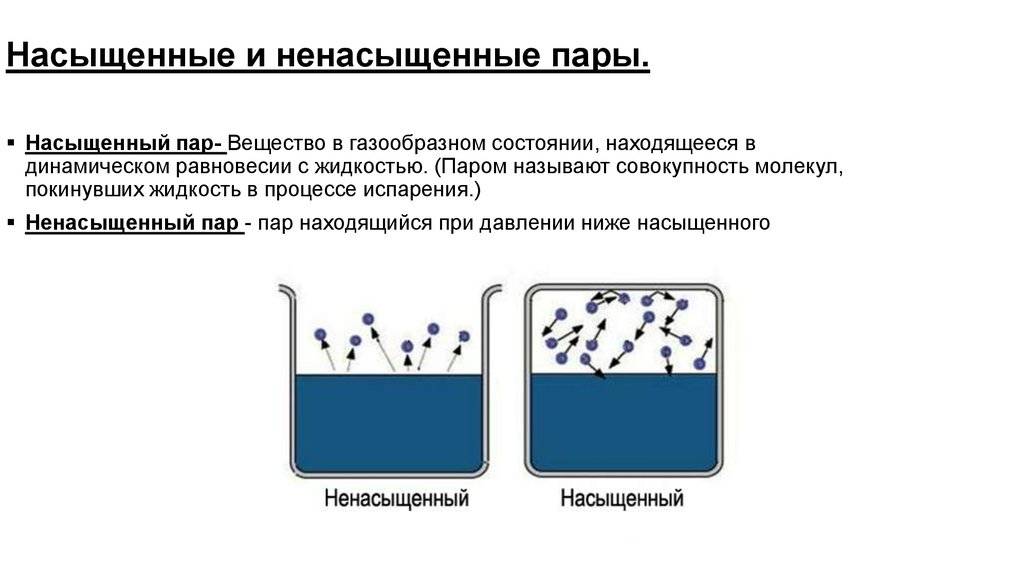
Что такое пар насыщенный и ненасыщенный
Само слово «насыщенный» несет определенную информацию, трудно насытить большую область пространства. Значит, чтобы получить насыщенный пар, надо ограничить пространство, в котором находится жидкость. Температура при этом должна быть меньше критической для данного вещества. Теперь испарившиеся молекулы остаются в пространстве, где находится жидкость. Сначала большинство переходов молекул будет происходить из жидкости, при этом плотность пара будет повышаться. Это в свою очередь вызовет большее число обратных переходов молекул в жидкость, что увеличит скорость процесса конденсации.
Наконец, устанавливается состояние, для которого среднее число молекул, переходящих из одной фазы в другую будет равным. Такое состояние называется динамическое равновесие. Для этого состояния характерно одинаковое изменение величины и направления скоростей испарения и конденсации. Это состояние соответствует насыщенному пару. Если состояние динамического равновесия не достигнуто, это соответствует ненасыщенному пару.
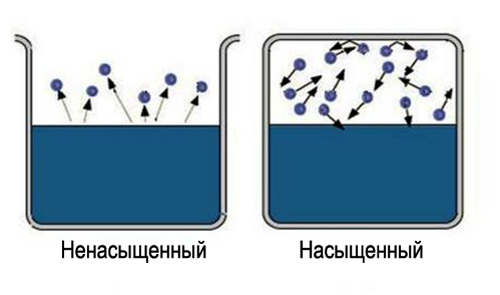
Начинают изучение какого-то объекта, всегда с самой простой его модели. В молекулярно-кинетической теории это — идеальный газ. Основные упрощения здесь — пренебрежение собственным объемом молекул и энергией их взаимодействия. Оказывается, подобная модель вполне удовлетворительно описывает ненасыщенный пар. Причем чем менее он насыщен, тем правомернее ее применение. Идеальный газ — это газ, он не может стать ни паром, ни жидкостью. Следовательно, для насыщенного пара подобная модель не является адекватной.
Что такое водяной газ
Водяной газ – это горючее, содержащее окись углерода (CO) и газообразный водород (H2). Водяной газ производится из синтез-газа. Процесс производства включает пропускание пара над нагретыми углеводородами. Между паром и углеводородами происходит реакция с образованием синтез-газа. Водяной газ получают за счет снижения уровня углекислого газа в синтез-газе и обогащения его большим количеством водорода. Основная реакция, используемая при производстве синтез-газа из водяного газа, – это реакция конверсии водяного газа (см. Ниже).
CO + H2O → CO2 + H2
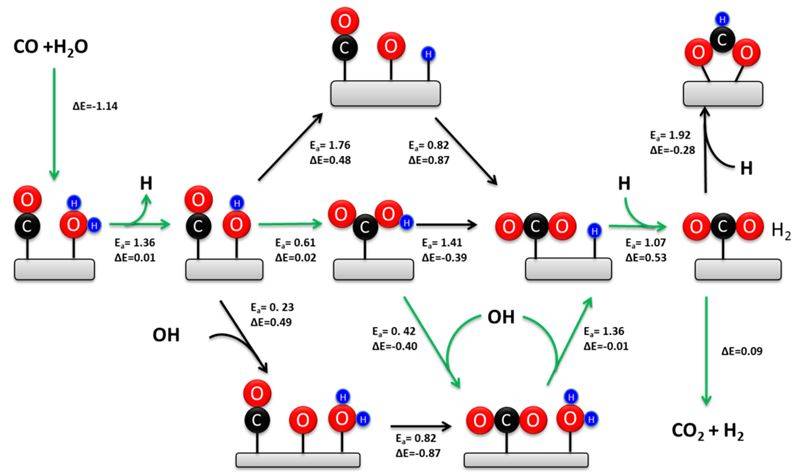
Рисунок 1: Ассоциативный и окислительно-восстановительный механизм сдвига водяного газа.
Вот несколько типов водяного газа.
Сравнительный анализ газа и пара
Состояние вещества определяется состоянием его молекул. В газе молекулы свободно перемещаются в пространстве, между ними существуют слабые притяжения. Газ характеризуется высокой подвижностью, рассеянностью и способностью заполнять любой объем. Химическое состояние газа обычно не зависит от агрегатного состояния вещества.
В паре также присутствуют молекулы, но они находятся в состоянии равновесия между жидким и газообразным состояниями. При нагревании жидкости молекулы получают больше энергии и начинают переходить в газообразное состояние, образуя пар. Химический состав пара и жидкости одинаков, а различия заключаются в количестве молекул и их движении.
Основное отличие между газом и паром заключается в том, что газ образуется при фазовом переходе твердого или жидкого вещества, а пар образуется при нагревании жидкости. Кроме того, газ характеризуется конкретной температурой кипения, при которой происходит переход из жидкого в газообразное состояние, в то время как температура пара зависит от температуры жидкости и давления.
| Газ | Пар |
|---|---|
| Молекулы свободно перемещаются | Молекулы находятся в состоянии равновесия |
| Высокая подвижность | Меньшая подвижность |
| Может заполнять любой объем | Заполняет пространство над жидкостью |
| Зависит от агрегатного состояния вещества | Состояние равновесия между жидкостью и газом |
What is Gas?
Gas is a state of matter characterized by its ability to expand to fill the container it occupies, its low density compared to liquids and solids, and its tendency to diffuse rapidly. Unlike solids and liquids, gases have no definite shape or volume, and their particles move freely and independently of each other.
Characteristics of Gas
- Particle Behavior: Gas particles exhibit constant, random motion, traveling in straight paths until they collide with other particles or the walls of their container. These collisions result in pressure, which is the force exerted by the gas per unit area.
- Expansion and Contraction: Gases uniformly expand to fill the available space of their container. Conversely, when the volume of the container decreases, gases contract to occupy less space. This property allows gases to adapt to the shape and size of their container.
- Compressibility: Gases are highly compressible, meaning their volume can be significantly reduced under pressure. When pressure is applied to a gas, the space between its particles decreases, leading to a decrease in volume.
- Ideal Gas Behavior: The behavior of ideal gases is described by the ideal gas law, which relates pressure, volume, temperature, and the number of gas particles. While real gases may deviate from ideal behavior under certain conditions, the ideal gas law provides a useful approximation in many situations.
Significance of Gas
- Industrial Applications: Gases are integral to various industrial processes, including combustion for energy production, chemical manufacturing, and as feedstocks for producing a wide range of products, such as fertilizers, plastics, and pharmaceuticals.
- Environmental Impact: Understanding the composition and behavior of gases in Earth’s atmosphere is crucial for addressing environmental issues such as climate change, air pollution, and ozone depletion. Monitoring gas emissions and their effects on air quality and climate is essential for mitigating these challenges.
- Technological Advancements: Gas-based technologies drive innovation in numerous fields, including transportation (e.g., internal combustion engines, fuel cells), healthcare (e.g., medical gases for anesthesia and respiratory therapy), and space exploration (e.g., propulsion systems for rockets).
- Scientific Research: Gas behavior serves as the foundation for studying fundamental principles in physics and chemistry, such as thermodynamics, kinetics, and molecular interactions. Insights gained from gas studies contribute to advancements in scientific knowledge and technological development.
Формирование и состояние
Пар же является состоянием вещества, при котором оно находится при температуре, близкой к точке конденсации. При нагревании вещества его молекулы приобретают достаточную энергию для преодоления силы взаимодействия и переходят из жидкого состояния в пар. Пар образуется при испарении жидкости, при этом молекулы пара находятся в постоянном движении, как и молекулы газа.
Таким образом, химическое отличие между газом и паром заключается в процессе их образования. Газ может существовать без прямого связывания его молекул, в то время как пар образуется при конденсации жидкости и состоит из молекул, которые ранее составляли жидкость.
| Газ | Пар |
|---|---|
| Свободное движение молекул | Движение молекул после испарения |
| Существует постоянно | Образуется при конденсации |
| Молекулы не связаны друг с другом | Молекулы ранее составляли жидкость |
Газ
Основное отличие газа от пара заключается в процессе получения. Пар образуется путем конденсации вещества, т.е. перехода из газообразного состояния в жидкое. В то время как газ образуется при повышенной температуре и давлении или при нагревании пара. У пара и газа различные свойства и поведение в разных условиях.
Важно отметить, что газ и пар являются различными формами одного вещества и могут превращаться друг в друга в зависимости от изменения температуры и давления
Пар
Пар образуется, когда жидкость нагревается до точки кипения и переходит в газообразное состояние. При этом молекулы жидкости получают достаточно энергии для разрыва химических связей и перехода в состояние пара.
В отличие от обычного газа, пар может существовать при температуре ниже его точки кипения, при условии что процесс конденсации перевешивает испарение. Когда пар достигает точки росы, он начинает конденсироваться обратно в жидкость или твердое состояние.
Молекулы пара также отличаются от молекул обычного газа своими свойствами. Они обладают большей энергией и скоростью движения, поэтому могут проявлять более агрессивные химические свойства при взаимодействии с другими веществами.
В природе пар образуется при естественных физических процессах, таких как испарение воды из океанов, рек и озер при повышенной температуре, а также при искусственных процессах, например, при кипячении воды на плите.