Переходы между агрегатными состояниями
Многие вещества при изменении условий могут переходить из одного агрегатного состояния в другое.
Пример. При температуре ниже 0 °C вода превращается в лёд, т. е. переходит из жидкого состояния в твёрдое.
Переход вещества из газообразного состояния в жидкое называется конденсацией. Переход вещества из жидкого состояния в газообразное называется испарением.
При увеличении температуры вещества испарение становится интенсивнее. И, наконец, при определённой температуре испарение становится настолько интенсивным, что жидкость закипает. Такая температура называется температурой кипения вещества. Испарение и кипение — это два способа перехода жидкости в газообразное состояние.
Испарение происходит с поверхности жидкости, а при кипении жидкость переходит в газообразное состояние, как с поверхности, так и внутри неё.
Когда говорят о веществах в газообразном состоянии, иногда помимо термина газ используется и слово пар. Газ и пар очень похожи между собой. Они представляют собой разновидности газообразного состояния вещества.
Разница между газом и паром в том, что газ имеет температуру выше критической или равную ей, а пар — ниже.
Пример. Критическая температура воды равна примерно 374 °C. Вода в газообразном состоянии, которая имеет температуру ниже критической, например, 5 °C или 120 °С, будет именно паром, а не газом. А вот, например, кислород, гелий и азот – газы, так как они имеют температуру выше критической (у каждого из них критическая температура ниже -100 °C).
В быту под словом пар обычно подразумевают именно водяной пар.
Переход вещества из жидкого состояния в твёрдое называется кристаллизацией. Переход вещества из твёрдого состояния в жидкое называется плавлением.
Переход вещества из твёрдого состояния сразу в газообразное называется возгонкой или сублимацией. Переход из газообразного состояния в твёрдое называется десублимацией.
При всех этих явлениях частицы вещества не разрушаются. Таким образом, вещество, изменяя агрегатное состояние, не превращается в другое вещество.
Одни вещества могут иметь любое из трёх агрегатных состояний, другие — нет.
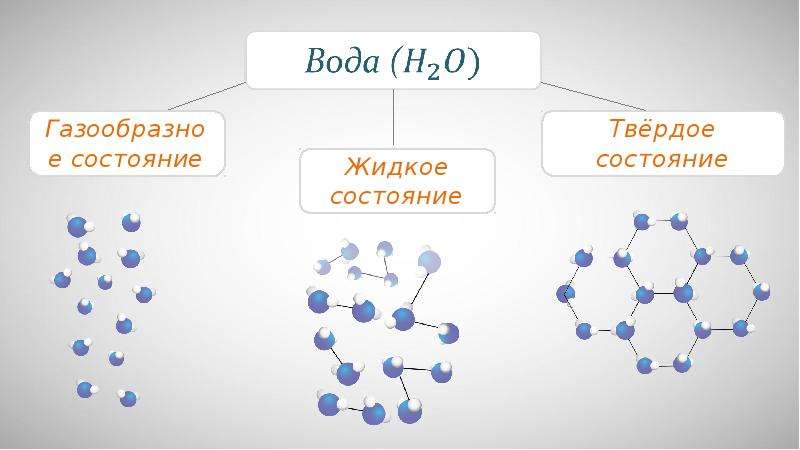
Пример. Вода может находиться в твёрдом состоянии (лёд), жидком (вода) и газообразном (водяной пар). Для сахара известны только два агрегатных состояния: твёрдое и жидкое.
При нагревании сахар плавится, затем его расплав темнеет, и появляется неприятный запах. Это свидетельствует о превращении сахара в другие вещества. Значит, газообразного состояния для сахара не существует.
Взаимные переходы веществ из одного агрегатного состояния в другое в виде схемы:
Источник
Main Differences Between Vapor and Gas
- Origin:
- Vapor originates from substances that are liquids or solids at room temperature and pressure, undergoing vaporization.
- Gas refers to the general state of matter, encompassing substances in their gaseous phase, regardless of their origin.
- Formation:
- Vapor forms when a substance undergoes vaporization, transitioning from liquid or solid to the gas phase.
- Gas exists as a state of matter, either naturally occurring or artificially produced, without a specific transformation process like vaporization.
- Composition:
- Vapor maintains the chemical composition of the substance from which it originates.
- Gas can consist of various elements or compounds in their gaseous states, with diverse compositions and properties.
- Temperature Dependence:
- Vaporization occurs at specific temperatures unique to each substance, influenced by factors such as pressure and molecular interactions.
- Gas behavior is influenced by temperature changes but does not necessarily involve a phase transition like vaporization.
- Examples:
- Examples of vapor include water vapor (steam), vaporized alcohol, or evaporated perfume.
- Examples of gas include oxygen, nitrogen, carbon dioxide, and other substances in their gaseous states, whether naturally occurring or artificially produced.
Жидкое агрегатное состояние
Отличительным свойством жидкости является их текучесть, вследствие чего они способны менять свою форму. Жидкость, налитая в сосуд, моментально принимает его форму и под воздействием гравитационной силы Земли располагается на его дне.
Граница верхней поверхности жидкости при этом образует гладкую плоскость. Кинетическая энергия движения молекул воды превосходит их взаимное притяжение, которое не способно в свою очередь удержать их не месте.
Молекула воды словно перекатывается от одной к другой создавая видимую нашим глазом текучесть.
Жидкость, в отличие от твердых тел, не имеет кристаллической решетки.
Изменение жидкостей
Жидкости — это тела, занимающие весь объем, в котором находятся, образующие поверхность, но не способные удерживать упругую форму. Для них свойственно сильное межмолекулярное взаимодействие и низкая сжимаемость, что определяет их положение между газообразным и твердым АС. Жидкости изотропны, текучи и обладают удельным весом, сравнимым с тем же показателем у твердых тел.
Правильное расположение внутренних частиц распространяется на небольшие области — они не только колеблются вокруг узлов так называемой квазикристаллической решетки, но и могут перескакивать между ними. Получается сложная траектория — колебания вокруг центра, перемещающегося в пространстве. Этим объясняется текучесть тел в жидком АС. Если понизить температуру до границ кристаллизации, то различные тепловые свойства жидкостей приблизятся к показателям твердых тел.
Процесс парообразования
Некоторые молекулы жидкости могут преодолеть силы поверхностного натяжения и перейти в парообразную форму, чем объясняется явление испарения, происходящее при любой температуре. Когда она повышается, процесс становится интенсивней и распространяется на весь объем. Появляется все больше пузырьков насыщенного пара, прорывающихся из глубины на поверхность.
При температуре кипения, имеющей определенное значение для каждого жидкого тела, давление пара внутри пузырьков превышает атмосферное, и начинается интенсивный переход жидкости в газообразное АС. При пониженном атмосферном давлении температура кипения той же жидкости становится ниже.
Динамическое равновесие
Когда жидкость находится в открытой емкости, то ее количество обязательно уменьшится вследствие испарения. Но если сосуд закрыть, то этого не произойдет. Сначала начнется процесс испарения и продолжится до тех пор, пока число покинувших жидкость молекул не станет равно возвратившимся назад из паров.
Можно сказать, что замкнутая система придет в динамическое (подвижное) равновесие, так как процесс обмена молекул будет продолжаться и дальше, т. е. испарение и конденсация в замкнутой системе происходят одновременно и компенсируют друг друга. Пар, который находится в таком равновесии с соответствующей жидкостью, называется насыщенным. Изменение внутренней энергии вещества определяется по формуле: ΔU = ± mr, где m — масса тела, r — удельная теплота парообразования.
Динамическое равновесие у разных жидкостей наступает при разной плотности пара. Это зависит от силы межмолекулярного взаимодействия. Если они велики как, например, у ртути, то только незначительное число самых быстрых молекул может покидать поверхность жидкости, а равновесие наступает при малой плотности пара. У летучих жидкостей молекулы разлетаются очень быстро, поэтому нужна высокая плотность для наступления равновесия.
Точка кипения
Пожалуй, самое распространенное явление перехода жидкого состояния в газообразное в быту — это кипение воды. Заваривая чай каждый из нас мог наблюдать рождение процесса кипения воды.
Маленькие пузырьки пара в толще подогревающейся воды постепенно растут и достигая критических размеров начинают подниматься на поверхность, где лопаясь превращаются в газообразное состояние — пар.
Как и в случае с плавлением существует граничная температура, называемая точкой кипения, при которой кинетическая энергия становится достаточной для того, чтобы преодолеть силы взаимного притяжения частиц, не дающие оторваться друг от друга и покинуть занимаемый объем. Любой элемент таблицы Менделеева или вещество из нескольких элементов имеет свою точку кипения. Чистая дистиллированная вода (H2O) имеет температуру кипения 100 0 С, этиловый спирт — (-79 0 С), а высококонцентрированная серная кислота кипит при температуре 338 0 С.
Температура кипения также зависит от давления и сил притяжения между частицами.
Однако, существуют исключения, при котором вещества могут миновать при переходе из одного агрегатного состояния в другую целую фазу превращения — переходя из твердого сразу в газообразную. Этот эффект называют сублимацией или возгонкой.Видео подборки опытов с сухим льдом
В качестве примера можно привести превращение сухого льда (диоксид углерода в твердом виде сразу в газообразное при температуре -78,5 0 С.
Что такое жидкость?
Жидкость представляет собой свободно движущееся вещество постоянного или определенного объема. Это то состояние материи, которое имеет случайные и свободно расположенные частицы. У жидкости низкие силы притяжения между ее молекулами. Таким образом, он имеет больше межмолекулярных пространств и не имеет какой-либо конкретной формы. Сжать жидкость практически невозможно из-за небольших зазоров между молекулами, но она может легко перетекать из более высокой концентрации в более низкую концентрацию. Контейнер необходим для хранения жидкости. например вода, соки, молоко и т. д.
Получение газов в лаборатории и промышленности
Методы получение газов в лаборатории и в промышленности отличаются.
В лаборатории:
- реагенты могут быть дорогими и редкими, но необходимыми для проведения опытов;
- условия регулируются для получения желаемого вещества, реакции проводятся в мягких условиях;
- реагентами выступают жидкости и твердые вещества.
В промышленности процессы заточены для получения быстрого результата с меньшими затратами. Из-за этого:
- используемые реагенты доступны и дешевы;
- процессы могут протекать в довольно жестких условиях, допускаются высокие температуры и давление;
- в качестве реагентов выступают газы и жидкости, реже вещества в твердом агрегатном состоянии.
Методы сбора газов в лаборатории
Для собирания газов в сосуд в лаборатории используются два основных способа:
- вытеснение воды;
- вытеснение воздуха.
Первый способ применяется для получения газов, которые химически не реагируют с водой и не растворяются в ней, например, водород, метан, азот.
Второй способ используется для газов, которые отличаются от воздуха по плотности, являются либо легче, либо тяжелее него. Для определения соотношения плотностей получаемого газа и воздуха необходимо вычислить молекулярную массу вещества и сравнить ее с молекулярной массой воздуха, равной 29.
Если вытесняемый газ легче воздуха (молекулярная масса менее 29), то сосуд для сбора газа закрепляют вверх дном, в обратном случае (молекулярная масса более 29) — дном вниз.
Химия – это просто
- Популярно о химии
- · Что такое химия
· Периодическая таблица - ОБЩАЯ ХИМИЯ
- Вещества и смеси
- · Понятие вещества
· Вещество и его состояния
· Простые и сложные вещества
· Чистые вещества и смеси
· Свойства вещества
· Энергия вещества
· Газы
· Растворы
· Коллоидные растворы
· Состав растворов
· Электролитическая диссоциация
· Уравнение ионных реакций
· Степень диссоциации
· Диссоциация кислот и оснований
· Диссоциация воды
· Твердые вещества
· Неорганические вещества
· Оксиды
· Основания
· Кислоты
· Соли
· Гидролиз солей
· Электролиз - Атомы и молекулы
- Строение веществ
- Взаимодействие веществ
- НЕОРГАНИЧЕСКАЯ ХИМИЯ
- ОРГАНИЧЕСКАЯ ХИМИЯ
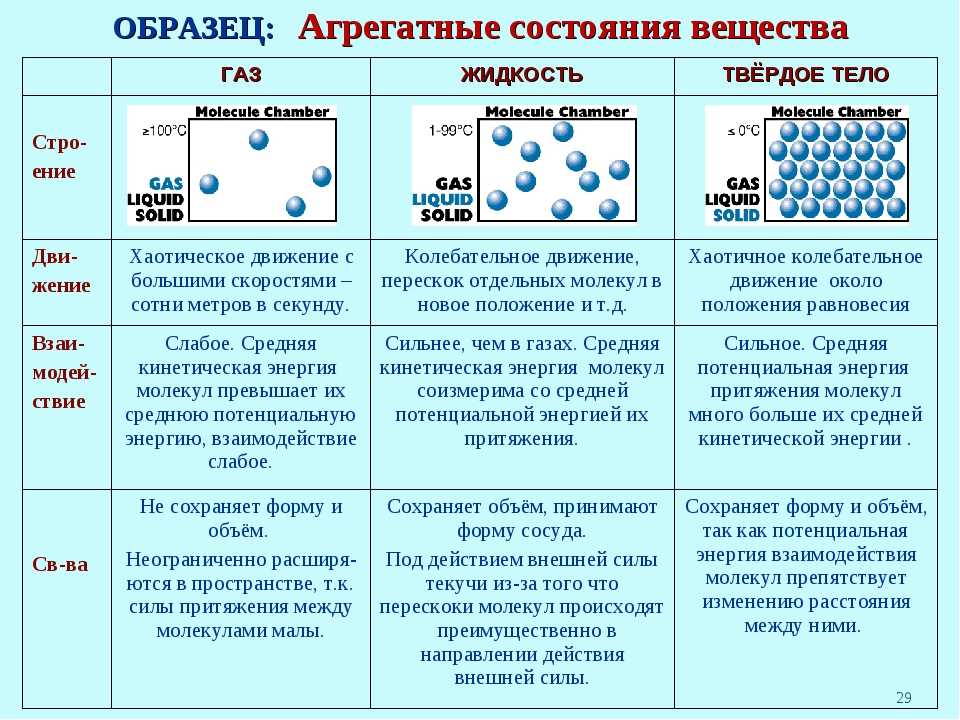
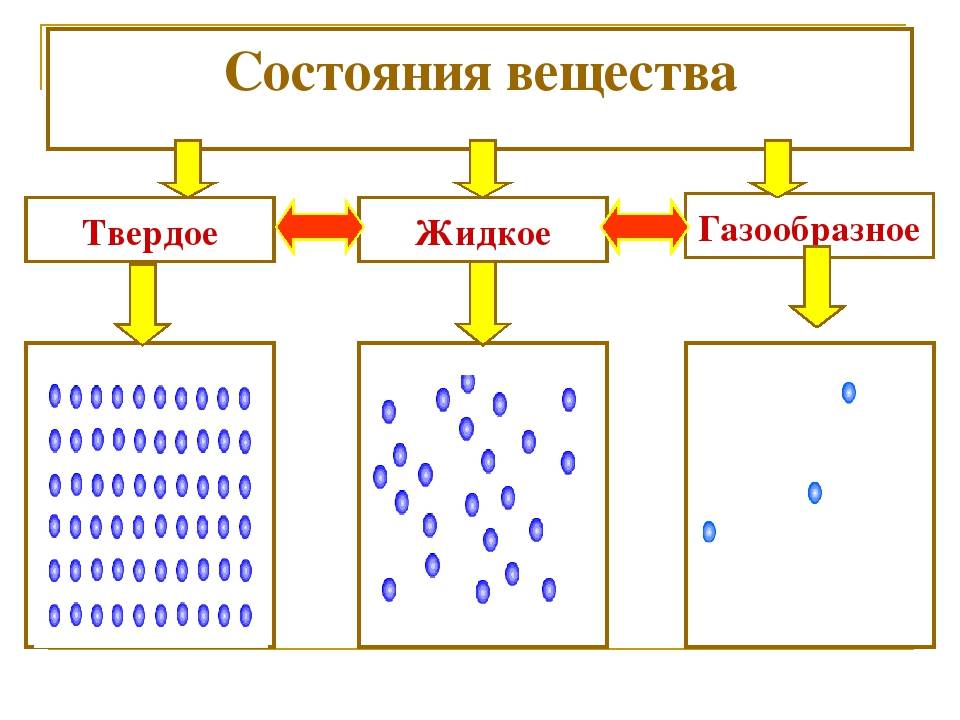
Состояния вещества
Состояние вещества — это физическое состояние, в котором находится вещество в зависимости от условий окружающей среды, таких как температура и давление.
Газы являются одним из состояний вещества, при котором молекулы перемещаются свободно и разделены значительными расстояниями. Они не имеют определенной формы и объема, а заполняют всё доступное им пространство.
Жидкости представляют собой состояние вещества, при котором молекулы находятся ближе друг к другу, чем в газах, но все еще могут перемещаться. Жидкости имеют определенный объем, но не имеют определенной формы и принимают форму сосуда, в котором они находятся.
Твердые вещества — это состояние вещества, при котором молекулы находятся очень близко друг к другу и не имеют возможности свободно перемещаться. Твердые вещества обладают определенной формой и объемом.
Температура и давление оказывают влияние на состояние вещества. При изменении температуры и давления, вещество может переходить из одного состояния в другое. Например, при нагревании творога он переходит из твердого вещества в жидкое состояние.
Таким образом, состояние вещества влияет на его физические свойства и поведение. Изучение состояний вещества позволяет лучше понять его прочность, изменение объема, способность течь или испаряться.
Агрегатные состояния, наблюдающихся практически у всех веществ[]
- твёрдое тело (аморфное либо кристаллическое), держит как форму, так и объём.
- жидкость, характеризуется более низкой плотностью и промежуточными температурами. Жидкость держит объём, но не держит форму.
- газообразное состояние, характеризуется низкой плотностью и достаточно высокой температурой. Газ не держит ни форму, ни объём.
- плазма (часто называемое четвёртое состояние вещества), представляет собой частично или полностью ионизованный газ и возникает при высокой температуре, от нескольких тысяч кельвинов и выше. В целом её свойства напоминают свойства газообразного состояния вещества, за исключением того факта, что для плазмы принципиальную роль играет электродинамика.
Агрегатные состояния вещества
Все вещества в зависимости от условий могут находиться в трёх агрегатных состояниях: твёрдом, жидком и газообразном. Различные агрегатные состояния существуют у каждого вещества. Наглядным примером этому служат лёд, вода и водяной пар.
ЧЕМ ОПРЕДЕЛЯЕТСЯ АГРЕГАТНОЕ СОСТОЯНИЕ ВЕЩЕСТВА
Вы уже знаете, что молекулы одного и того же вещества в твёрдом, жидком и газообразном состоянии ничем не отличаются друг от друга. То или иное агрегатное состояние определяется взаимным расположением составляющих вещество молекул, а также характером их движения и взаимодействия.
В газах при атмосферном давлении расстояния между молекулами намного больше размера самих молекул. Именно поэтому притяжение между молекулами газа мало. При обычных температурах средняя кинетическая энергия молекул газа вполне достаточна для совершения работы по преодолению сил их взаимного притяжения, поэтому молекулы газа разлетаются, если газ не сдерживают стенки сосуда.
Плотности жидкостей и твёрдых тел во много раз больше плотности газа, а их молекулы расположены гораздо ближе друг к другу. В этом случае сила взаимного притяжения молекул намного больше и средней кинетической энергии молекул уже недостаточно для того, чтобы совершить работу по преодолению сил межмолекулярного притяжения. Это является причиной того, что молекулы в жидкостях и особенно в твёрдых телах не могут значительно удаляться друг от друга.
https://youtube.com/watch?v=okKuP4B1YWw
ПЕРЕХОД ВЕЩЕСТВА ИЗ ОДНОГО АГРЕГАТНОГО СОСТОЯНИЯ
Вещества могут переходить из одного агрегатного состояния в другое. Изменение агрегатного состояния вещества всегда связано с выделением или поглощением некоторого количества теплоты.
Переход вещества из одного агрегатного состояния в другое используется для решения огромного числа практических задач. Например, в крупных городах используют снегоплавильные машины, для того чтобы грязный снег с улицы отправлять в канализацию и не загрязнять окружающую среду. На тепловых и атомных электростанциях в паровых турбинах применяют водяной пар. Сжиженный газ (фреон) используют в холодильных установках.
Всего различают шесть процессов, при которых происходит переход вещества из одного агрегатного состояния в другое.
ПЛАВЛЕНИЕ И КРИСТАЛЛИЗАЦИЯ
Переход вещества из твёрдого состояния в жидкое называется плавлением. В твёрдых телах, в отличие от жидкостей, частицы расположены упорядоченно. Поэтому, для того чтобы перевести частицы из упорядоченного состояния в неупорядоченное, нужно совершить работу по преодолению сил молекулярного притяжения. Внутренняя энергия вещества при этом увеличивается за счёт увеличения энергии взаимодействия молекул. Примерами плавления могут служить таяние льда, плавление металлов в металлургии и пр.
https://youtube.com/watch?v=es5o-C90krY
Обратный процесс, связанный с переходом вещества из жидкого состояния в твёрдое, называется кристаллизацией или отвердеванием. Пример кристаллизации — замерзание воды. Процесс кристаллизации сопровождается уменьшением внутренней энергии вещества за счёт уменьшения энергии взаимодействия молекул.
ПАРООБРАЗОВАНИЕ И КОНДЕНСАЦИЯ
Переход вещества из жидкого состояния в газообразное называется парообразованием. Пример парообразования — испарение воды.
Обратный процесс, связанный с переходом вещества из газообразного состояния в жидкое, называется конденсацией (от лат. condense — уплотнение, сгущение). Пример конденсации — образование росы.
СУБЛИМАЦИЯ (ВОЗГОНКА) И ДЕСУБЛИМАЦИЯ
Переход вещества из твёрдого состояния в газообразное (минуя жидкое) называется сублимацией (от лат. sublimo — возношу) или возгонкой. Возгонкой объясняются также запахи, которыми обладают многие твёрдые тела. Вылетая из твёрдого тела, молекулы образуют над ним газ (или пар), который и вызывает запах. Например, разные сорта древесины имеют различный запах.
Переход вещества из газообразного состояния в твёрдое (минуя жидкое) называется десублимацией. Пример десублимации — образование на окнах зимой инея, узоров из кристалликов льда. Данный процесс десублимации может осуществляться только на внутренней поверхности оконного стекла, где молекулы паров воды превращаются в кристаллики льда.
Вы смотрели Конспект по физике для 8 класса «Агрегатные состояния вещества».
Вернуться к Списку конспектов по физике (Оглавление).
Просмотров: 7 037
Другие состояния[]
При глубоком охлаждении газы некоторых (далеко не всех) веществ переходят в состояние бозе-конденсата.
Некоторые другие вещества при низких температурах переходят в сверхпроводящее или сверхтекучее состояние.
Эти состояния безусловно являются отдельными термодинамическими фазами, однако их вряд ли стоит называть новыми агрегатными состояниями вещества в силу их неуниверсальности.
Неоднородные вещества типа паст, гелей, суспензий, аэрозолей и т. д., которые при определённых условиях демонстрируют свойства как твёрдых тел, так и жидкостей и даже газов, обычно относят к классу дисперсных материалов, а не к каким-либо конкретным агрегатным состояниям вещества.
Состояния материи
| Твёрдое тело | Жидкость | Газ | ПлазмаКоллоид | Сверхкритическая жидкость | Сверхтекучая жидкость | Сверхтвёрдое тело | Вырожденная материя | Кварк-глюонная плазма | Конденсат Ферми-Дирака | Конденсат Бозе — Эйнштейна | Странная материяПереходные точки: точка плавления | точка кипения | тройная точка | критическая точкаДругие понятия: уравнение состояния | кривая охлаждения |
| Выделить Агрегатное состояние и найти в:
|
|
|
- Страница – краткая статья
- Страница 1 – энциклопедическая статья
- Разное – на страницах: 2 , 3 , 4 , 5
- Прошу вносить вашу информацию в «Агрегатное состояние 1», чтобы сохранить ее
Газообразное состояние
При нормальных условиях (273 К, 101325 Па) в газообразном состоянии могут находиться как простые вещества, молекулы которых состоят из одного атома (Не, Ne, Ar) или из нескольких несложных атомов (Н2, N2, O2), так и сложные вещества с малой молярной массой (СН4 , HCl, C2H6).
Поскольку кинетическая энергия частиц газа превышает их потенциальную энергию, то молекулы в газообразном состоянии непрерывно хаотически двигаются. Благодаря большим расстояниям между частицами силы межмолекулярного взаимодействия в газах настолько незначительны, что их не хватает для привлечения частиц друг к другу и удержания их вместе. Именно по этой причине газы не имеют собственной формы и характеризуются малой плотностью и высокой способностью к сжатию и к расширению. Поэтому газ постоянно давит на стенки сосуда, в котором он находится, одинаково во всех направлениях.
Для изучения взаимосвязи между важнейшими параметрами газа (давление Р, температура Т, количество вещества n, молярная масса М, масса m) используется простейшая модель газообразного состояния вещества — идеальный газ, которая базируется на следующих допущениях:
- взаимодействием между частицами газа можно пренебречь;
- сами частицы являются материальными точками, которые не имеют собственного размера.
Наиболее общим уравнением, описывающим модель идеального газа, считается уравнения Менделеева-Клапейрона для одного моля вещества:
Однако поведение реального газа отличается, как правило, от идеального. Это объясняется, во-первых, тем, что между молекулами реального газа все же действуют незначительные силы взаимного притяжения, которые в определенной степени сжимают газ. С учетом этого общее давление газа возрастает на величину a/V2, которая учитывает дополнительное внутреннее давление, обусловленное взаимным притяжением молекул. В результате общее давление газа выражается суммой Р+ а/V2. Во-вторых, молекулы реального газа имеют хоть и малый, но вполне определенный объем b , поэтому действительный объем всего газа в пространстве составляет V — b. При подстановке рассмотренных значений в уравнение Менделеева-Клапейрона получаем уравнение состояния реального газа , которое называется уравнением Ван-дер-Ваальса:
где а и b — эмпирические коэффициенты, которые определяются на практике для каждого реального газа. Установлено, что коэффициент a имеет большую величину для газов, которые легко сжижаются (например, СО2 , NH3 ), а коэффициент b — наоборот, тем выше по величине, чем больше размеры имеют молекулы газа (например, газообразные углеводороды).
Уравнение Ван-дер-Ваальса гораздо точнее описывает поведение реального газа, чем уравнения Менделеева-Клапейрона, которое тем не менее, благодаря наглядному физическому смыслу широко используется в практических расчетах. Хотя идеальное состояние газа является предельным, мнимым случаем, однако простота законов, которые ему отвечают, возможность их применения для описания свойств многих газов в условиях низких давлений и высоких температур делает модель идеального газа очень удобной.