Физические свойства
Физические свойства химического элемента включают в себя такие характеристики, как плотность, температура плавления и кипения, теплоемкость, теплопроводность, электропроводность и прочие параметры, связанные с его состоянием и способностью взаимодействовать с другими веществами.
Плотность
Плотность элемента — это масса единицы объема этого вещества. Она является физической характеристикой, которая может изменяться при изменении условий (например, температуры и давления). Плотность может быть выражена в различных единицах измерения, таких как г/см³ или кг/м³.
Температура плавления и кипения
Температура плавления — это температура, при которой химический элемент переходит из твердого состояния в жидкое состояние. Температура кипения — это температура, при которой элемент переходит из жидкого состояния в газообразное состояние. Температуры плавления и кипения могут быть различными для разных элементов и являются важными характеристиками, которые указывают на изменение состояния элемента при изменении температуры.
Важно отметить, что значения температуры плавления и кипения могут быть указаны для элементов при стандартных условиях (например, 0°C и 1 атмосфере давления), но могут также изменяться при изменении давления и других факторов
Теплоемкость, теплопроводность и электропроводность
Теплоемкость элемента — это количество теплоты, которое необходимо передать элементу для изменения его температуры на определенное количество градусов. Теплопроводность — это способность элемента проводить тепло. Электропроводность — это способность элемента проводить электрический ток.
Эти свойства могут быть различными для разных элементов и могут зависеть от их структуры и состава. Например, металлы обычно обладают высокой теплопроводностью и электропроводностью, в то время как неметаллы могут иметь более низкую проводимость.
Физические свойства химического элемента являются важными при изучении его химических и физических свойств, а также при применении элементов в различных областях, таких как промышленность, медицина, электроника и другие.
Структура химического элемента
Структура химического элемента основана на его атомной структуре. Атом — это наименьшая частица элемента, которая сохраняет его химические свойства. Атом состоит из ядра и электронной оболочки.
Ядро атома содержит протоны и нейтроны. Протоны имеют положительный заряд, а нейтроны не имеют заряда. Заряд ядра определяет атомный номер элемента и его положение в периодической системе.
Вокруг ядра находится электронная оболочка, которая содержит электроны. Электроны имеют отрицательный заряд и движутся по определенным орбитам вокруг ядра. Количество электронов в оболочке определяет химические свойства элемента и его атомный радиус.
Химический элемент может иметь различное количество протонов, но обязательно имеет одинаковое количество протонов и электронов, что делает его электрически нейтральным. Изменение количества протонов приводит к образованию иных элементов, но это уже будет относиться к другим химическим веществам.
Таким образом, структура химического элемента определяется его атомным составом — ядром и электронной оболочкой. Это позволяет каждому элементу иметь уникальные химические свойства, которые определяют его поведение в химических реакциях.
Свойства химического элемента
Химические элементы имеют ряд уникальных свойств, которые определяют их поведение и взаимодействие с другими веществами.
Один из основных параметров, характеризующих элемент, — это атомная масса, которая определяет его массу в атомах. Атомная масса указывается в таблице химических элементов и позволяет сравнивать массу атомов разных элементов.
Другим свойством является атомный номер, который определяет положение элемента в таблице. Атомный номер также указывает на количество протонов в ядре атома, что определяет его химические свойства и положение в периодической системе.
Важным свойством элементов является их химическая активность. Некоторые элементы обладают высокой активностью и легко вступают в химические реакции с другими веществами, а некоторые элементы наоборот, практически не реактивны.
Также каждый элемент имеет специфическую электронную конфигурацию, которая определяет расположение электронов в атомных оболочках. Электронная конфигурация влияет на химические свойства элемента и его способность вступать в химические реакции.
Большинство элементов имеют различные изотопы, которые отличаются по числу нейтронов в ядре. Изотопы элементов имеют различные физические и химические свойства, что позволяет использовать их в различных научных и промышленных целях.
| Свойство | Описание |
|---|---|
| Атомная масса | Масса атома элемента, определяющая его относительную массу в атомах. |
| Атомный номер | Число протонов в ядре атома элемента, определяющее его положение в таблице химических элементов. |
| Химическая активность | Способность элемента вступать в химические реакции с другими веществами. |
| Электронная конфигурация | Расположение электронов в атомных оболочках элемента, определяющая его химические свойства. |
| Изотопы | Различные версии элемента с разным числом нейтронов в ядре, имеющие различные физические и химические свойства. |
Темы, которые нужно изучить для сдачи огэ по химии
Для успешной сдачи ОГЭ по химии необходимо углубленное изучение следующих тем:
1. Основные понятия химии
Перед началом изучения других тем необходимо освоить основные понятия химии, такие как атом, молекула, ион, элемент, соединение, реакция и другие. Знание этих основных понятий поможет в дальнейшем понимании более сложных тем.
2. Структура и свойства вещества
Изучение структуры и свойств вещества является основой для понимания реакций и превращений в химических процессах. В этой теме необходимо изучить такие понятия, как агрегатные состояния, растворы, кристаллическая решетка, жидкость и газ, теплоемкость и другие.
3. Органическая химия
Органическая химия изучает соединения, содержащие углерод. Для сдачи ОГЭ по химии необходимо знать основные классы органических соединений, такие как углеводороды, алканы, алкены, алкадиены, алкоголи, карбоновые кислоты и их производные.
Кроме этих тем, важно изучить основы физической химии, такие как законы химической динамики и термодинамики, химические свойства и превращения элементов, кислоты и щелочи, основы электрохимии и другие важные темы. Тщательная подготовка и систематическое изучение этих тем помогут успешно сдать ОГЭ по химии
Структура ОГЭ по химии
Первая часть экзамена состоит из 30 тестовых заданий, каждое из которых имеет один правильный ответ. Эти задания основаны на знаниях учащихся по теории и законам химии, а также на их практических навыках и умении решать химические задачи. Учащимся предлагается выбрать правильный ответ из нескольких предложенных вариантов.
Во второй части экзамена учащимся предлагается выполнить краткое изложение по предложенной теме. Темы для изложений связаны с основами химии и требуют от учащихся умения выразить свои мысли и идеи в письменной форме. Здесь важным аспектом является ясность и последовательность изложения мыслей.
Третья часть экзамена состоит из практических заданий, которые требуют от учащихся навыков проведения химических экспериментов и определения различных веществ. Учащимся предлагается выполнить конкретные химические операции, такие как разведение растворов, измерение объема газов, проведение простых химических реакций и интерпретацию полученных результатов.
Четвертая часть: Контрольные задания
Четвертая часть экзамена содержит контрольные задания, которые проверяют понимание и усвоение основных понятий и законов химии. Эти задания требуют от учащихся решения конкретных химических задач на основе предоставленной информации
Здесь важно правильно применить полученные знания для решения задач и объяснения явлений в химических процессах.
Структура ОГЭ по химии позволяет оценить знания учащихся в различных аспектах химии и выявить их уровень подготовки. Экзамен проверяет как теоретические знания, так и практические навыки, что позволяет оценить полноценное понимание предмета и его применение в реальных ситуациях. Успешное прохождение ОГЭ по химии является одним из ключевых критериев для дальнейшего обучения в области химических наук.
Атомно-молекулярное учение. Мельчайшие частицы
Как и каждая наука, химия имеет свои термины и понятия, которые изучаются на протяжении всего курса. Эти термины для вас будут не новыми, вы с ними знакомились на уроках физики и природоведения. А речь пойдёт об атомах, молекулах, химических элементах и веществах. Эти понятия являются основой атомно-молекулярного учения.
Рассмотрим подробно каждое понятие.
Атом
Наверняка вы в учебнике или кабинете химии видели периодическую систему химических элементов (ПСХЭ). Она имеет разный вид и структуру, с которой вы позже подробно познакомитесь. Классический вид периодической системы химических элементов изображён на рисунке.
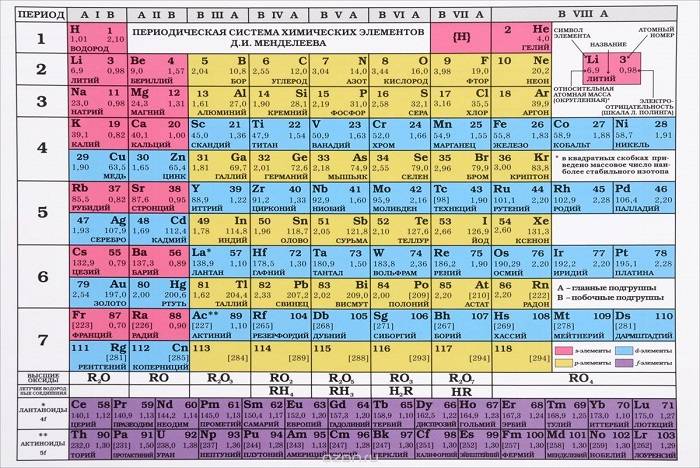
С уроков природоведения вам известно, что атомы это кирпичики мироздания.
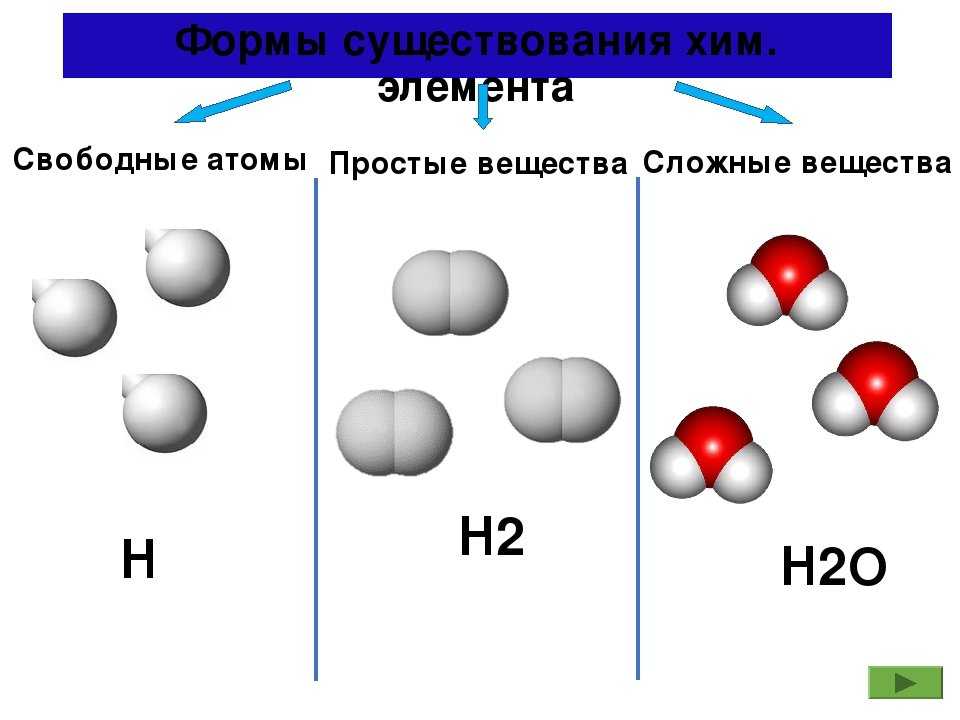
Атом – мельчайшая частица химического элемента, которая отвечает за его свойства и химически неделима.
На данный момент известно 126 видов атомов – химических элементов. Какая связь между химическим элементом и атомом? Химический элемент состоит из атомов определённого вида. В чём состоит отличие этих понятий. Почему алхимики не могли найти философский камень? Почему железо или медь не превращаются в золото? Чтобы ответить на эти вопросы, необходимо рассмотреть строение атома.
Абсолютно каждый атом имеет положительно заряженное ядро и, вращающиеся вокруг него, отрицательные электроны.
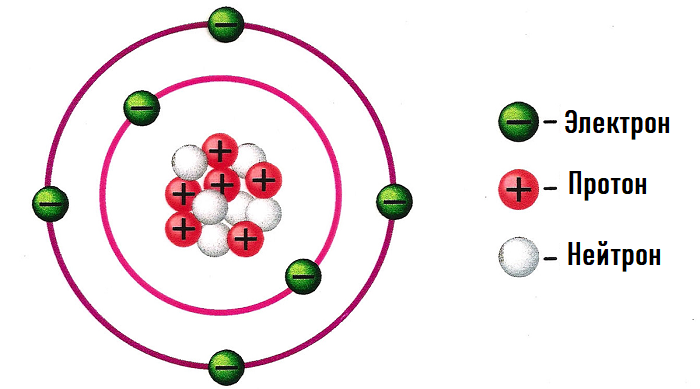
Самое тяжёлое в атоме – это ядро, которое состоит с протонов (имеют заряд +) и нейтронов (заряд 0).
Атом не имеет никакого заряда, иными словами нейтрален.
Число протонов = число электронов
Чтобы узнать количество частиц, необходимо определить порядковый номер элемента в ПСХЭ.
Например, если в состав атома входит 10 электронов и 10 протонов, посмотрев в периодическую систему, увидим, что данный набор частиц отвечает химическому элементу – Неон. Химический элемент Золото имеет 79 протонов и 79 электронов. Состав атомов, а точнее, количество протонов, не изменяется в ходе химических реакций. Именно по этой причине, алхимики не смогли найти рецепт философского камня.
Атомы (подобно буквам, которые соединяются в слоги, а потом в слова) соединяются в молекулы.
Молекула
Молекула – наименьшая частица вещества
Как образуются молекулы? Снова проведём аналогию с буквами. Чтобы получилось читаемое и со смыслом слово, необходима определённая комбинация букв и чёткие правила. Также происходит и при образовании молекулы. Атомы соединяются в молекулу с помощью химических связей. Свойства молекул зависят от того, атомы каких элементов входят в их состав, а также каким образом они соединены между собой.
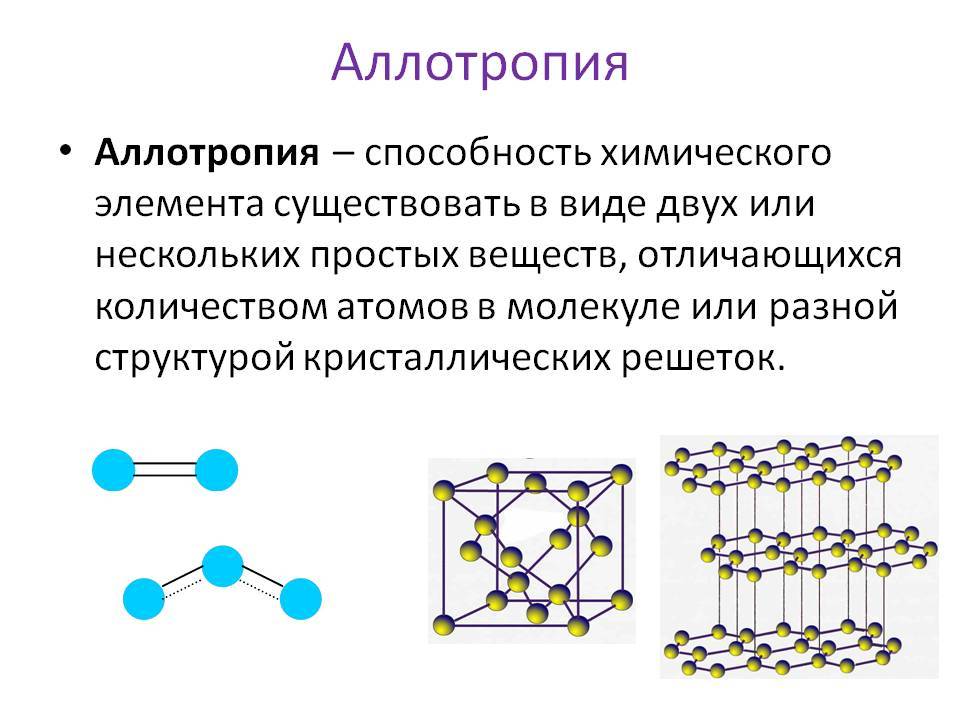
Рассмотрим на примере молекул веществ, которые образованные атомами кислорода, это кислород и озон. Обе эти молекулы образованы атомами химического элемента Кислород, но в состав озона, химическая формула которого О3, входит 3 атома Кислорода, а в молекулу кислорода, формула вещества О2 – два атома химического элемента Кислород.
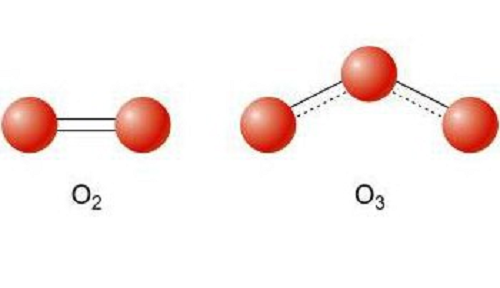
Данное явление называется аллотропией. Это явление существования простых веществ, образованных одинаковым химическим элементом, но различным по свойствам и строению.
Рекордсменом по образованию аллотропных форм является углерод, который существует в виде алмаза, графита, карбина, фуллеренов, углеродных нанотрубок.
Как видно из определения, атомы и молекулы – это частицы, но в чём их разница? Снова проведём аналогию с буквами и словами. Буквы – это атомы, слова – это молекулы. Буквы не могут состоять из слов, так же как и атомы не могут состоять из молекул.
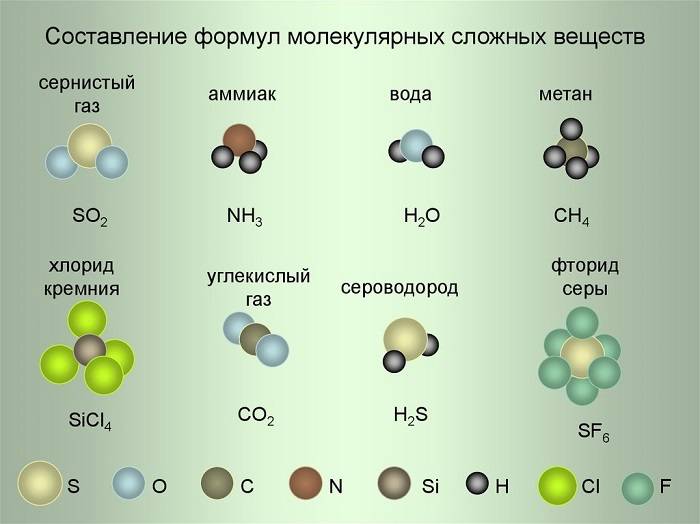
Молекула сернистого газа SO2 состоит из одного атома Серы и двух атомов Кислорода. Молекула аммиака состоит из одного атома Азота и трёх атомов Водорода и т. д.
Таким образом, мы видим, что все вещества состоят из атомов химических элементов. Живая и неживая природа – это также комбинация химических элементов.
Ионы
Что происходит с атомом, если он присоединяет или отдаёт электроны? Он становится заряженной частицей.
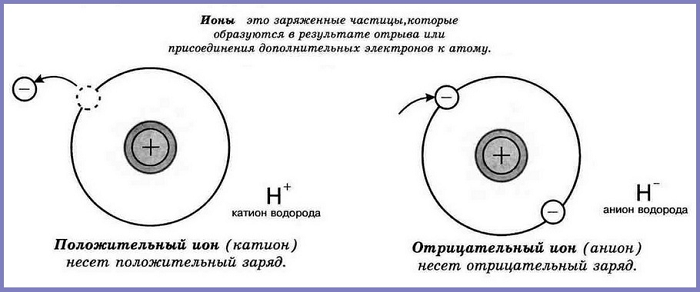
Ионы – частицы, которые положительно или отрицательно заряжены.
Обобщив все вышесказанное, выделим основные постулаты атомно-молекулярного учения, которое является фундаментом в химии, физике и естествознании:
- Вещества состоят из молекул;
- Атомы являются частью молекулы;
- Атомам и молекулам характерно самопроизвольное движение;
- Во время химических реакций происходит изменение состава молекулы и образуются новые вещества.
Уравнения химических реакций
Вещества, состав которых отражают химические формулы, могут участвовать в химических процессах (реакциях). Графическая запись, соответствующая данной химической реакции, называется уравнением химической реакции. Например, при сгорании (взаимодействии с кислородом) угля происходит химическая реакция:
Запись показывает, что один атом углерода С, соединяясь с одной молекулой кислорода O2, образует одну молекулу углекислого газа СО2. Число атомов каждого химического элемента до и после реакции должно быть одинаково! Это правило — следствие Закона сохранения массы вещества: масса исходных веществ равна массе продуктов реакции. Закон был открыт в 18-м веке М. В. Ломоносовым и, независимо от него, А. Л. Лавуазье.
Выполняя этот закон, необходимо в уравнениях химических реакций расставлять коэффициенты так, чтобы число атомов каждого химического элемента не изменялось в результате реакции. Например, при разложении бертолетовой соли КClO3, получается соль КСl и кислород О2:
Число атомов калия и хлора одинаково, а кислорода — разное. Уравняем их:
Теперь изменилось число атомов калия и хлора до реакции. Уравняем их:
Теперь между правой и левой частями уравнения можно поставить знак равенства:
Полученная запись показывает, что при разложении двух молекул КClO3 получается две молекулы КСl и три молекулы кислорода O2. Число молекул показывают при помощи коэффициентов.
При подборе коэффициентов необязательно считать отдельные атомы. Если в ходе реакции не изменился состав некоторых атомных групп, то можно учитывать число этих групп, считая их единым целым:
Последовательность действий такова:
1. Определим валентность исходных атомов и группы PO4:
2. Перенесём эти числа в правую часть уравнения:
3. Составим химические формулы полученных веществ по валентностям составных частей:
4
Обратим внимание на состав «самого сложного» соединения: Ca3(PO4)2 и уравняем число атомов кальция (их три) и число групп РО4 (их две):
5. Число атомов натрия и хлора до реакции теперь стало равным шести; доставим соответствующий коэффициент:
Эти правила образуют Алгоритм составления уравнений химических реакций обмена, так как, пользуясь этой последовательностью, можно уравнять схемы многих химических реакций, за исключением более сложных окислительно-восстановительных реакций (см. урок 7).
Химические реакции бывают разных типов. Основными являются:
1. Реакции соединения:
Здесь из двух и более веществ образуется одно вещество:
2. Реакции разложения:
Здесь из одного вещества получаются два вещества и более веществ:
3. Реакции замещения:
Здесь реагируют простое и сложное вещества, образуются также простое и сложное вещества, причём простое вещество замещает часть атомов сложного вещества:
4. Реакции обмена:
Здесь реагируют два сложных вещества и получаются два сложных вещества. В ходе реакции сложные вещества обмениваются своими составными частями:
Существуют и другие типы химических реакций.
Задание 1.5. Расставьте коэффициенты в предложенных выше примерах.
Задание 1.6. Расставьте коэффициенты и определите тип химической реакции:
Различие между атомами
Атом представляет собой связанную электрическими силами систему из ядра и электронного облака. Ядро образовано протонами и нейтронами и имеет положительный электрический заряд, складывающийся из зарядов протонов. Нейтроны, не имеющие заряда, вносят вклад в массу ядра и, соответственно, атома.
Мельчайшие носители отрицательного заряда – электроны – образуют вокруг ядра облако. Зарядом ядра определяется их число, от которого зависит конфигурация облака, – в частности, заполнение электронами его внешней оболочки, то есть химические свойства атома. Разнообразие атомов – это следствие существования ядер с разным количеством протонов.
Роль в природе и промышленности
Роль в природе
Химические элементы составляют все, что нас окружает в природе. Они входят в состав воздуха, воды, почвы и многих других компонентов окружающей среды. Некоторые элементы играют важную роль в биологических процессах и жизни организмов. Например, кислород необходим для дыхания, а углерод является основой органических соединений.
Некоторые химические элементы играют роль в геологических процессах. Например, железо является основным компонентом земной коры и находится в составе многих минералов, таких как гематит и магнетит. Элементы, такие как сера и фосфор, также встречаются в различных геологических образованиях.
Роль в промышленности
Химические элементы играют важную роль в промышленности, где они используются для производства различных продуктов. Например, железо используется для производства стали, которая является основным строительным материалом. Алюминий широко применяется в авиации, строительстве, электронике и других отраслях промышленности.
Некоторые химические элементы используются в качестве катализаторов в процессах производства различных химических соединений. Например, никель используется в качестве катализатора в процессе производства пластмасс и синтетических волокон.
| Элемент | Роль в промышленности |
|---|---|
| Железо | Производство стали |
| Алюминий | Применение в авиации, строительстве, электронике и др. |
| Никель | Производство пластмасс и синтетических волокон |
Химические элементы также играют важную роль в производстве энергии. Например, уран используется в ядерной энергетике для производства электричества.
Таким образом, химические элементы являются неотъемлемой частью природы и промышленности, играя ключевую роль в различных процессах и производстве различных материалов и продуктов.
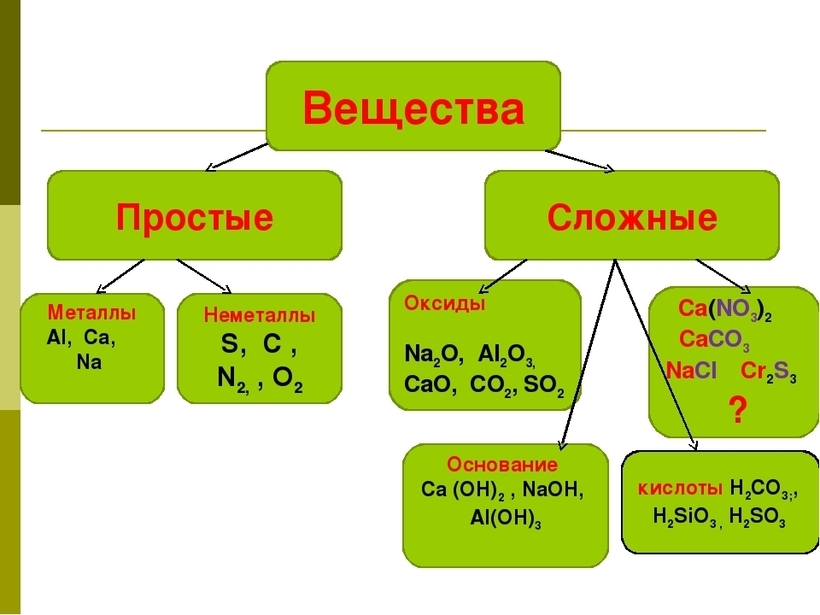
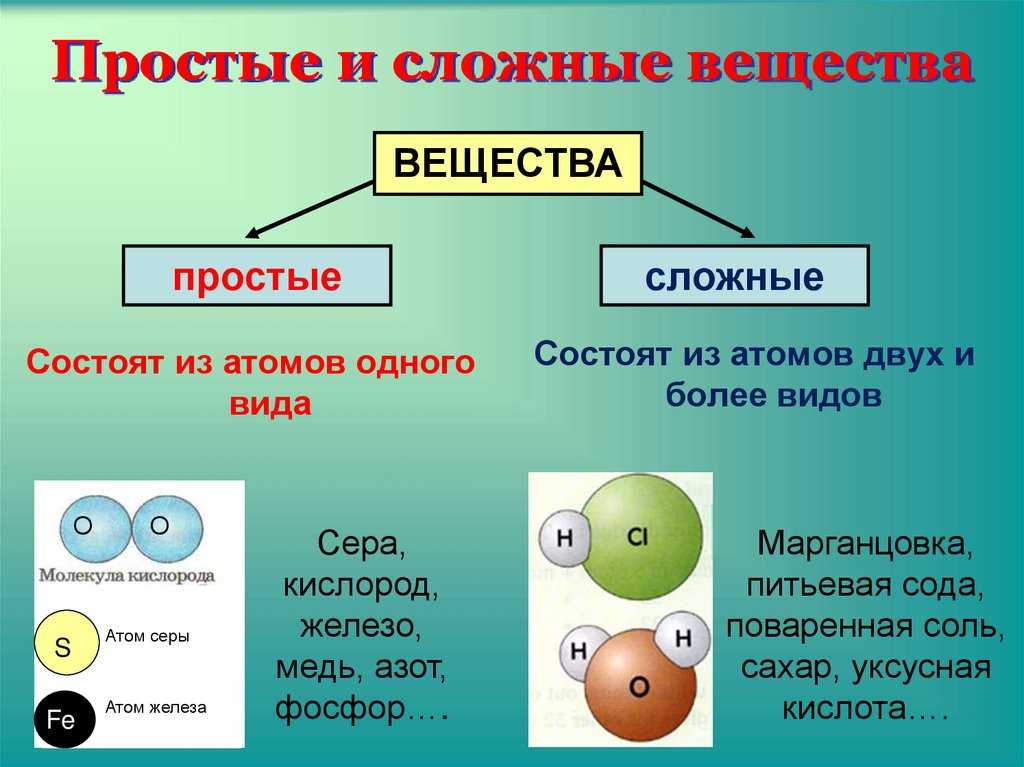
Сложные вещества и их классификация
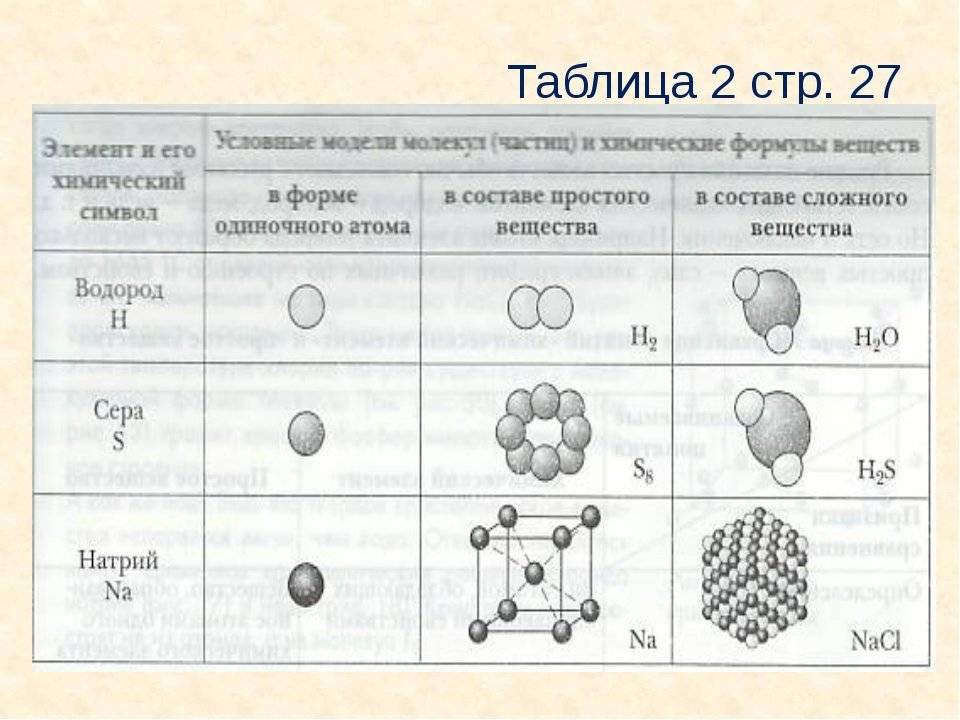
Если в состав простых веществ входят атомы только одного вида, несложно догадаться, что в состав сложных веществ будут входить несколько видов различных атомов, как минимум двух. Примером сложного вещества является вода, ее химическая формула вам известна – Н2О.
Молекулы воды состоят из двух видов атомов: водорода и кислорода.
Проведем следующий эксперимент. Смешаем порошки серы и цинка. Поместим смесь на металлический лист и подожжем при помощи деревянной лучины. Смесь загорается и быстро сгорает ярким пламенем. После завершения химической реакции образовалось новое вещество, в состав которого входят атомы серы и цинка. Свойства этого вещества совершенно другие, нежели свойства исходных веществ – серы и цинка.
Сложные вещества принято делить на две группы: неорганические вещества и их производные и органические вещества и их производные. Например, каменная соль – это неорганическое вещество, а крахмал, содержащийся в картофеле – органическое вещество.
Символ
Символы элементов часто основаны на их латинском или английском названии. Например, символ для кислорода — «O» (от латинского слова «oxygenium»). Некоторые символы могут быть производными от латинского названия, такие как «Na» для натрия (от латинского слова «natrium»).
Символы элементов являются универсальными и узнаваемыми, и они широко используются в химических формулах и уравнениях. Они также используются в научных публикациях, учебниках и других источниках, связанных с химией.
Символы элементов могут содержать одну или две буквы. Буквы могут быть как прописными, так и заглавными, и часто их написание соответствует правилам латинского алфавита. Например, символы для кислорода, азота и углерода обозначаются как «O», «N» и «C» соответственно.
Символы элементов являются важной частью системы обозначения химических элементов и помогают идентифицировать и различать элементы друг от друга. Они являются основой для дальнейшего изучения химии и понимания его основных принципов и закономерностей
Атомная масса
Атомная масса является средним значением массы атомов всех изотопов данного элемента, учитывая их относительное распространение на Земле. Это связано с тем, что атомы элементов могут иметь различное количество нейтронов в своем ядре, что приводит к различным изотопам.
Таким образом, атомная масса — это среднее арифметическое всех изотопов элемента, взвешенное по их процентному содержанию.
Для учета различий в атомных массах элементов, принято использовать отдельную единицу массы — атомную единицу массы (а.е.м.). Она определена как 1/12 массы атома углерода-12. Таким образом, атом углерода-12 имеет атомную массу, приравненную к 12 а.е.м. Атомная масса других элементов выражается относительно этого стандарта.
Атомные массы элементов приведены в периодической таблице химических элементов. Они позволяют сравнивать массу атомов различных элементов и использовать ее для расчета количества вещества в химических реакциях.
Примеры атомных масс некоторых элементов
Элемент
Атомная масса (а.е.м.)
Водород
1
Углерод
12
Кислород
16
Железо
56
Золото
197
Связь атомной массы и молярной массы
Атомная масса элемента выражается в атомных единицах массы, а молярная масса — это масса одного моля данного вещества. Молярная масса выражается в г/моль и равна числовому значению атомной массы данного элемента.
Например, атомная масса кислорода равна 16 а.е.м., а его молярная масса равна 16 г/моль. То есть, одна моль кислорода содержит 6,022 × 10^23 атомов, массой в 16 г.
Химический элемент: история открытия
В различные исторические эпохи в понятие «элемент» вкладывался различный смысл. Древнегреческие философы в качестве таких «элементов» рассматривали 4 «стихии» – тепло, холод, сухость и влажность. Сочетаясь попарно они образовывали четыре «начала» всего на свете – огонь, воздух, воду и землю.
В XVII веке Р. Бойль указал на то, что все элементы носят материальный характер и их число может быть достаточно велико.
В 1787 году французский химик А. Лавуазье создал «Таблицу простых тел». В нее вошли все известные к тому времени элементы. Под последними понимались простые тела, которые не удавалось разложить химическими методами на еще более простые. Впоследствии выяснилось, что в таблицу вошли и некоторые сложные вещества.
К моменту, когда Д. И. Менделеев открыл периодический закон, было известно всего 63 химических элементов. Открытие ученого не только привело к упорядоченной классификации химических элементов, а также помогло предсказать существование новых, еще не открытых элементов.
Рис. 1. А. Лавуазье.
Знакомство с химией
Когда мы слышим слово «химия», сразу представляем человека, окружённого колбами, пробирками, наполненными веществами всевозможных цветов. Он записывает непонятные символы, которые нам кажутся иероглифами. Перед нами встает вопрос: что это за наука, какие задачи изучает? Ответ достаточно прост, предмет химии – вещества.
Химия — наука о веществах, их свойствах и превращениях в другие вещества.
Как и каждая наука, химия имеет свою историю развития. Первые химические знания появились до нашей эры, в Древнем Египте. Египтяне обладали химической наукой, которую называли «Священным искусством». Некоторые рецепты приготовления парфюмерии и лекарственных препаратов используют и до сих пор. Наверняка вы слышали об алхимиках и философском камне, с помощью которого, можно превратить любой металл в золото.
В современном представлении термин «химия» можно услышать в нескольких интерпретациях: химия как наука, а также продукты химического производства (одним словом химия). Мы не представляем наше существование без химических веществ. Просыпаясь утром, идём умываться: мыло, зубная паста ждут нас в ванной комнате. Ароматный чай и хрустящие хлопья на завтрак. Одежда, обувь, школьные принадлежности и многое другое мы получаем благодаря химическим технологиям.
Но также можно сказать, что химия – это вред. Неоднократно слышали о кислотных дождях, о гибели морских жителей из-за нефтяных пятен, о нитратах в овощах и фруктах и т. д.
Химия тесно связана с человечеством, является неотъемлемой его частью. Чтобы не наносить вред нашей планете, необходимо применять химические знания и рационально использовать вещества.
Именно благодаря своей многогранности химия применяется в каждой области:
- Медицина: лекарственные препараты, вакцины, искусственные органы, косметические средства;
- Искусство: живопись, архитектура, фотографии, изготовление ювелирных изделий, ковка, литье;
- Сельское хозяйство: удобрение, средства для борьбы с вредителями;
- Криминалистика: опознание личности по ДНК, отпечаткам пальцев, определение состава ядовитых и взрывчатых веществ;
- Строительство: производство строительных материалов, обработка древесины;
- Металлургия: без металлов не существует ни одна отрасль. Металлы и сплавы окружают нас повсюду;
- В быту: средство бытовой химии, при приготовлении обеда также применяем химические знания;
- Пищевая промышленность: молочная, мясная продукция, соусы, кондитерские изделия и т. д.;
- Охрана окружающей среды. На данный момент остро стоит проблема охраны окружающей среды. Деятельность человека губительно действует на планету. Но с помощью химических знаний, которые базируются на свойствах веществ, учёные находят способы очистки воды, почвы, воздуха от вредных веществ.
 (Источник)
(Источник)
Химия – наука очень обширная и включает в себя много разделов, которые имеют своё назначение и изучают вещества, их строение и свойства.
- Неорганическая химия или её ещё называют химия неживой природы. Предмет изучения химические элементы и их соединения;
- Биохимия изучает процессы, которые происходят в организмах при обмене веществ, дыхании и т. д.;
- Органическая химия или химия углерода. Это увлекательный раздел знакомит о множестве соединений, благодаря уникальным свойствам углерода;
- Физическая химия рассматривает закономерности реакций;
- Аналитическая химия, благодаря качественному и количественному анализу позволяет исследовать смеси.
Чтобы овладеть химическими знаниями, необходимо изучить физику, биологию, а также математику. Как видно из схемы, химия тесно перекликается с другими науками.
Простые и сложные вещества. Валентность
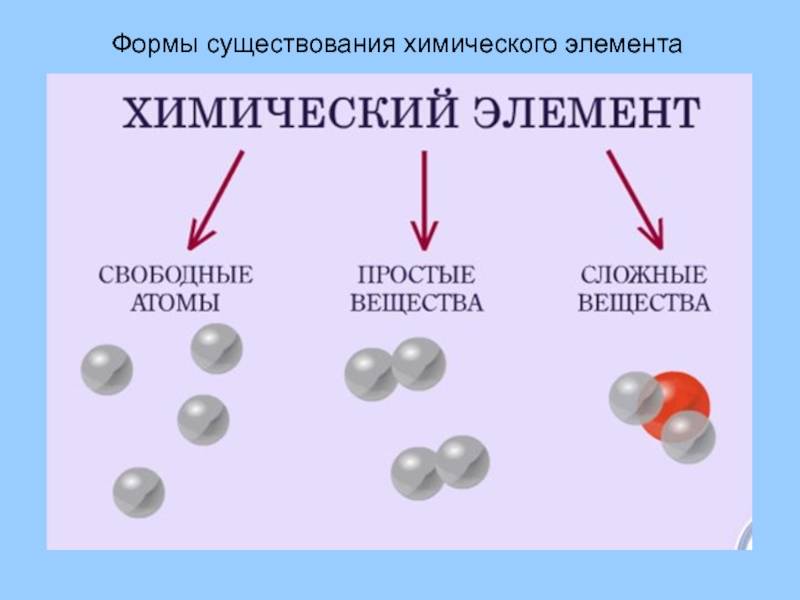
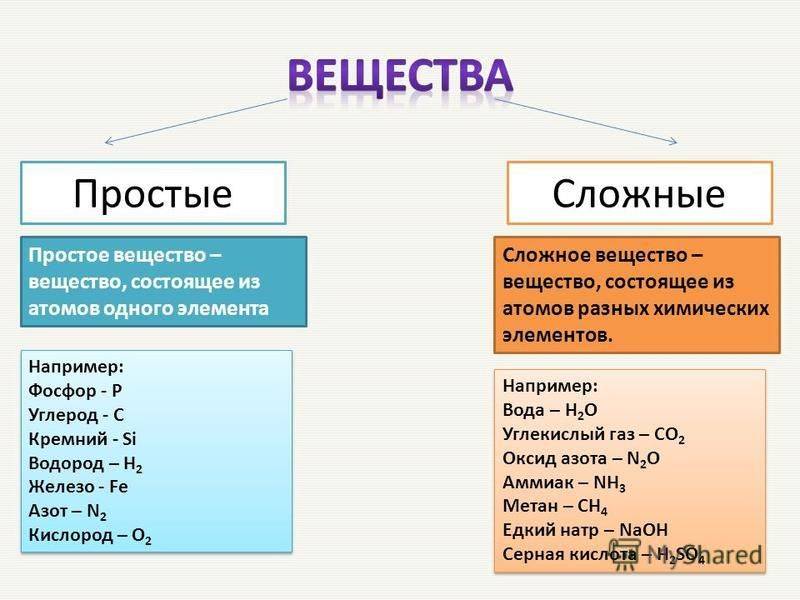
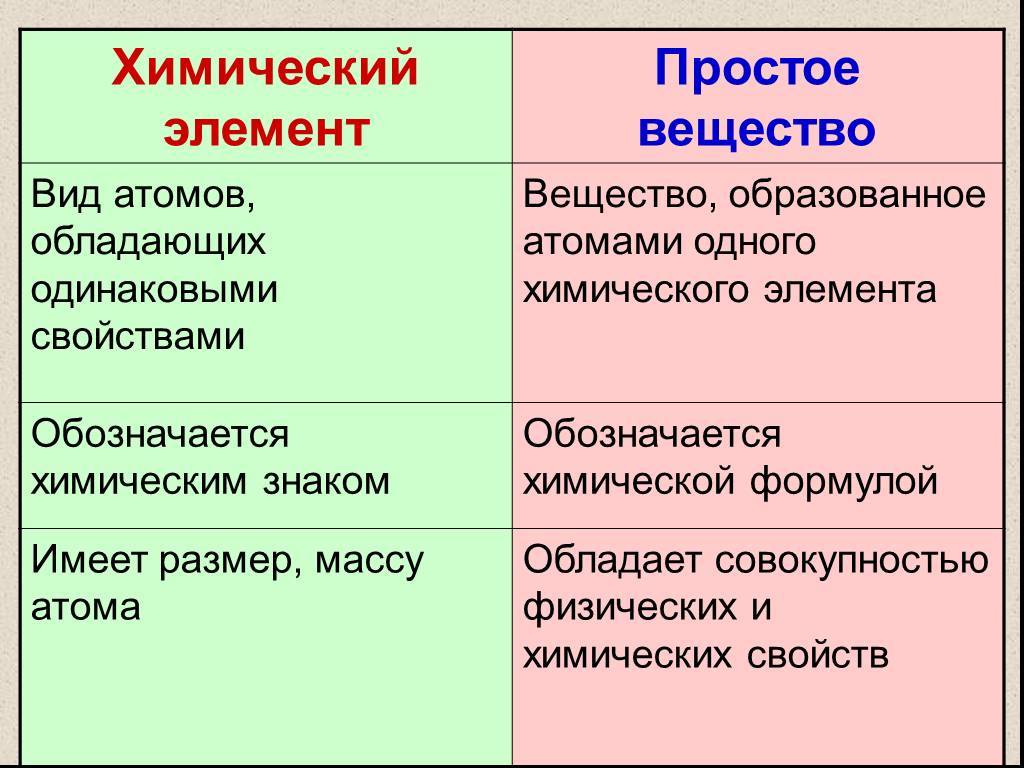
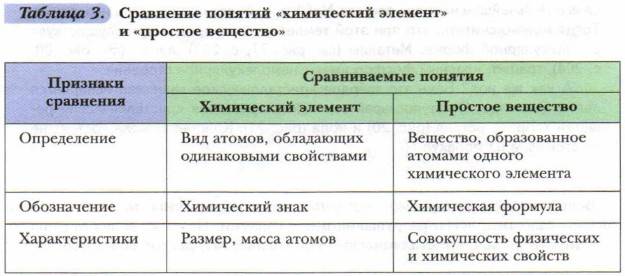
Вещества бывают простые и сложные. Если молекула состоит из атомов одного химического элемента, — это простое вещество:
Если в состав вещества входят атомы только одного химического элемента — это простое вещество. Причём некоторые химические элементы образуют несколько простых веществ. Так, химический элемент кислород образует простое вещество «кислород» О2 и простое вещество «озон» О3*.
А химический элемент углерод образует четыре простых вещества, причём ни одно из них не называется «углерод». Эти вещества отличаются пространственным расположением атомов:
Алмаз — атомы углерода находятся в вершинах воображаемых тетраэдров;
Графит — атомы углерода находятся в одной плоскости;
Карбин — атомы углерода образуют «нити».
В четвертой модификации «углерода» — фуллерене — атомы углерода образуют сферу, т. е. молекулы фуллерена напоминают мячик.
Существование элемента в виде нескольких простых веществ называется аллотропией. Алмаз, графит, карбин, фуллерен — аллотропные модификации элемента «углерод», а кислород и озон — аллотропные модификации элемента «кислород».
Таким образом, не следует путать эти понятия: «химический элемент» и «простое вещество», а также «молекула» и «атом».
Очень часто в письменных записях слова «молекула» или «атом» заменяют соответствующими символами, но не всегда правильно. Так, нельзя писать: «В состав воды входит Н2», так как речь здесь идёт о химическом элементе водороде — Н. Нужно писать: «В состав воды входит (Н)». Аналогично, правильной будет запись: «При действии металла на раствор кислоты выделится Н2», т. е. вещество водород, молекула которого двухатомна.
Молекулы сложных веществ состоят из атомов разных химических элементов:
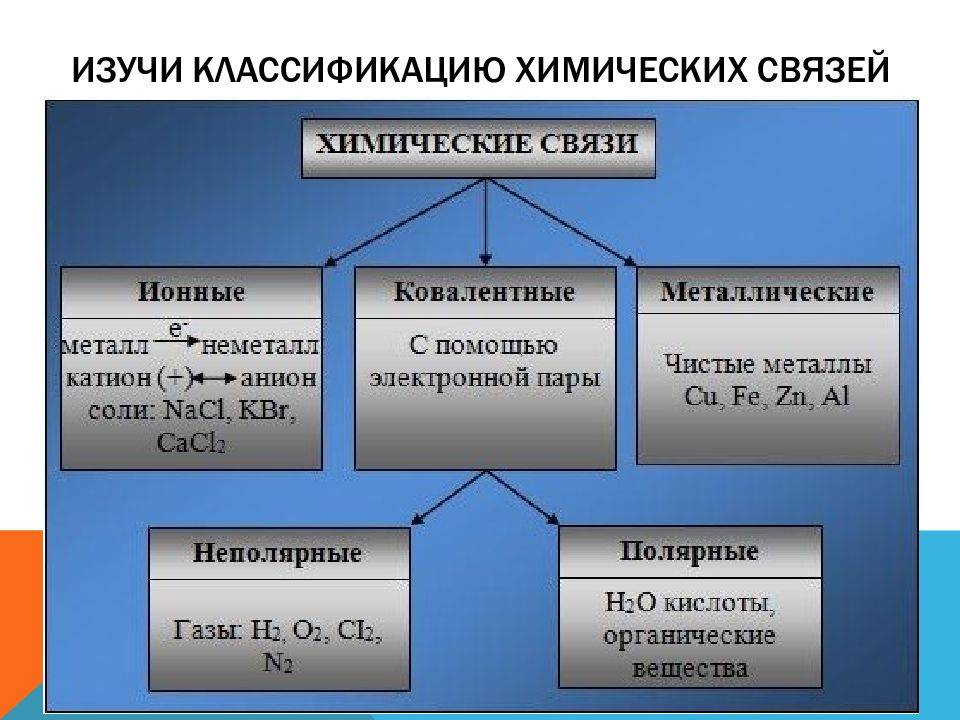
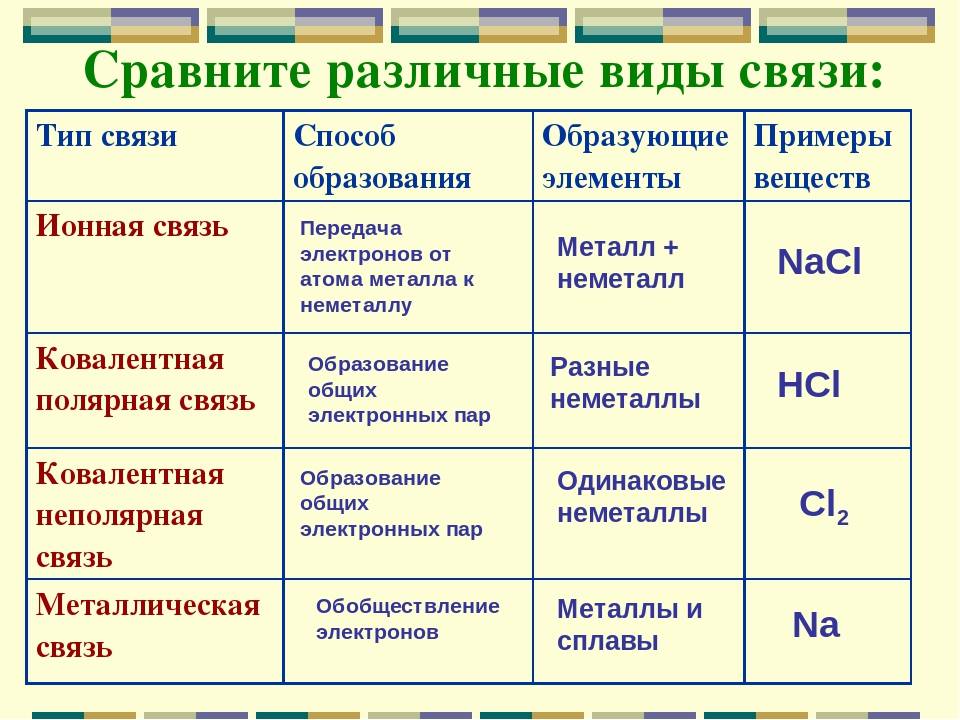
Как известно, в состав сложных веществ входят атомы разных химических элементов. Эти атомы соединяются между собой химическими связями: ковалентными, ионными, металлическими.
Способность атома образовывать определённое число ковалентных химических связей называется валентностью. (Подробнее см. урок 4 «Химическая связь».) Правильнее всего определять валентность по графическим или структурным формулам:
В таких формулах одна чёрточка обозначает одну ковалентную связь, т. е. «одну валентность». На практике чаще всего валентность определяют по молекулярной формуле, хотя здесь правильнее говорить о степени окисления элемента (см. урок 7). Иногда результат определения степени окисления соответствует реальному значению валентности, но бывают и неодинаковые результаты.
Задание 1.1. Определите «валентность» (степени окисления) атомов кальция и углерода по формуле СаС2. Совпадает ли полученный результат с реальным значением валентности?
В устойчивой молекуле не может быть «свободных», «лишних» валентностей! Поэтому для двухэлементной молекулы число химических связей (валентностей) атомов одного элемента равно общему числу химических связей атомов другого элемента.
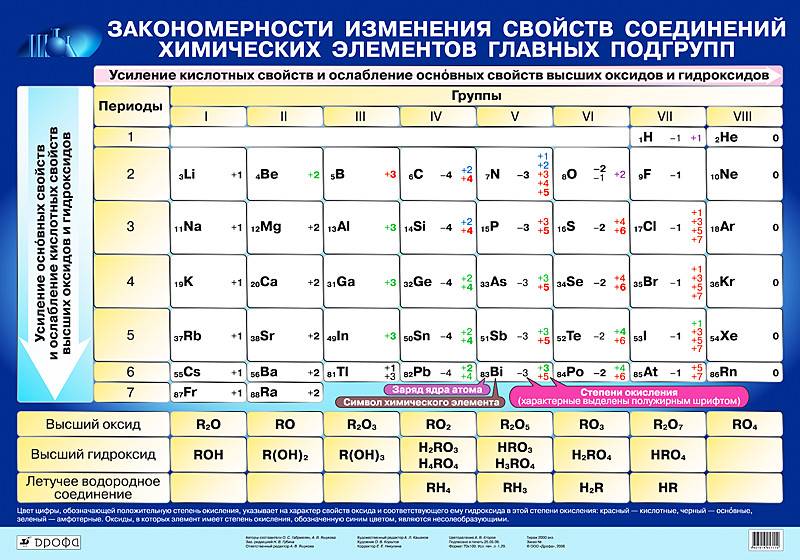
Валентность атомов некоторых химических элементов постоянна (табл. 2).
Для других атомов валентность можно определить (вычислить) из химической формулы вещества.
При этом следует учитывать изложенное выше правило о химической связи.
Сделаем практические выводы.
1. Если один из атомов в молекуле одновалентен, то валентность второго атома равна числу атомов первого элемента (см. на индекс!):
2. Если число атомов в молекуле одинаково, то валентность первого атома равна валентности второго атома:
3. Если у одного из атомов индекс отсутствует, то его валентность равна произведению валентности второго атома на его индекс:
4. В остальных случаях ставьте валентности «крест-накрест», т. е. валентность первого атома равна числу атомов второго элемента и наоборот:
Задание 1.2. Определите валентности элементов в соединениях:
Вначале укажите валентности атомов, у которых она постоянна! Аналогично определяется валентность атомных групп (ОН), (РО4), (SО4) и так далее.
Задание 1.3. Определите валентности атомных групп (в формулах выделены курсивом):
Обратите внимание! Одинаковые группы атомов (OH), (РО4), (SO4) имеют одинаковые валентности во всех соединениях. Зная валентности атома или группы атомов можно составить формулу соединения
Для этого пользуются правилами:
Зная валентности атома или группы атомов можно составить формулу соединения. Для этого пользуются правилами:
Если валентности одинаковы, то и число атомов одинаково, т. е. индексы не ставим:
Если валентности кратны (одно число делится на другое), то число атомов элемента с меньшей валентностью определяем делением:
В остальных случаях индексы определяют «крест-накрест»:
Задание 1.4. Составьте химические формулы соединений:
Физические характеристики
Физические характеристики химических элементов и простых веществ могут существенно отличаться друг от друга. Рассмотрим основные физические свойства химических элементов.
Одним из основных физических свойств элементов является их атомная масса. Атомная масса показывает массу одного атома данного элемента и измеряется в атомных единицах массы (аму). Она может значительно различаться у разных элементов и является одним из ключевых параметров при описании элементов.
Также важным физическим свойством элементов является их плотность. Плотность показывает отношение массы вещества к его объему и измеряется в граммах на кубический сантиметр или в килограммах на кубический метр. Различные элементы имеют разные значения плотности, что связано с различиями в упаковке атомов и межатомных взаимодействиях.
Температура плавления и кипения также являются важными физическими характеристиками элементов. Температура плавления — это температура, при которой элемент переходит из твердого состояния в жидкое, а температура кипения — это температура, при которой элемент переходит из жидкого состояния в газообразное. Значения этих температур могут существенно отличаться у разных элементов и зависят от внутренней структуры атомов и межатомных взаимодействий.
Также физическими характеристиками элементов являются их электрические свойства. Некоторые элементы являются хорошими проводниками электричества, другие — полупроводниками, а третьи — изоляторами. Это связано с внутренней структурой атомов и уровнем заполнения их электронных оболочек.
Таким образом, физические характеристики химических элементов и простых веществ различны и определяются их внутренней структурой и взаимодействиями атомов. Изучение этих характеристик позволяет лучше понять свойства и реакционную способность элементов и использовать их в различных областях науки и техники.
Это интересно: Тело с нарушенной топологией Компас 3D: как исправить ошибки