Аллотропные модификации углерода
Аллотропия – это способность химических элементов существовать в двух и более физических формах (аллотропах). Самой широкой из всех открытых является аллотропия углерода.
Если вы перечислите основные углеродные аллотропные видоизменения, то это будут:
- алмаз;
- графит;
- карбин;
- фуллерен.
Из указанных выше два аллотропа углерода синтезированы. Карбин и фуллерен – полученные искусственно аллотропные видоизменения углерода. Карбин – порошок из мелких кристалликов черного цвета. После открытия в лаборатории было найдено и природное вещество. Фуллерен – синтезированный в конце прошлого века в США желтый кристалл около 5 мм в диаметре.
Аллотропические формы углерода могут трансформироваться. Сам по себе переход алмаза в другое состояние не произойдет. Но при нагревании кристалла в безвоздушном пространстве до 1800 градусов он превратится в графит.
Известны методы, позволяющие осуществить и обратные превращения.
Как получить драгоценный камень из графита
Получить алмаз можно из графита. При давлении выше 1000 Па и температуре 3000 градусов с добавлением металлов углерод в графите меняет ковалентные связи. Полученные в результате камни мутные и пористые.
Другой метод – это применение ударной волны, после которой можно любоваться чистыми, прозрачными кристаллами правильной геометрической формы, но очень маленького размера.
Несовершенство этих методов привело к выводу, что алмазы лучше всего выращивать. При нагреве бриллианта до 1,5 тысячи градусов он растет. Но это дорого, поэтому сегодня искусственные драгоценности получают из метана.
Краткая характеристика: алмаз, графит и уголь
Кристаллические решетки графита не имеют прочных связей, они представляют собой отдельные чешуйки и как бы скользят друг по другу, легко отделяясь от общей массы. Графит часто используют в качестве смазки для трущихся поверхностей.
Уголь состоит из мельчайших частиц графита и таких же малых частиц углерода, находящегося в соединении с водородом, кислородом, азотом.
Кристаллическая решетка алмаза жесткая, компактная, обладает высокой твердостью. Тысячелетиями люди даже не подозревали, что эти три вещества имеют что-то общее. Все это – открытия более позднего времени.
Графит серый, мягкий, жирный на ощупь совсем не похож на черный уголь. Внешне он скорее напоминает металл. Алмаз – сверхтвердый, прозрачный, сверкающий, по внешнему виду совсем отличен от графита и угля, (подробнее: Как используют минералы). Никаких признаков их родства не давала и природа. Месторождения угля никогда не соседствовали с графитом.
В их залежах никогда геологи не обнаруживали сверкающих кристаллов алмаза. Но время не стоит на месте. В конце XVII века флорентийским ученым удалось сжечь алмаз. После этого не осталось даже крохотной кучки золы. Английский химик Теннант через 100 лет после этого установил, что при сжигании одинаковых количеств графита, угля, и алмаза образуется одинаковое количество углекислого газа. Этот опыт открыл истину.
Различия между графитом и алмазом
Атомы углерода в формуле графита и алмаза имеют различную структуру. В графите атомы углерода связаны в слоях, при этом слои между собой легко скользят, что обуславливает характерную смазку графита. В алмазе же атомы углерода образуют тетраэдры, которые связаны между собой ковалентными связями, придающими алмазу особую прочность и твердость.
Минерал графит обладает черным цветом и мягкостью, благодаря своей структуре слоистых зон. Графит имеет антифрикционные свойства и часто используется в промышленности для производства карандашей, смазок и электродов. Алмаз, напротив, является одним из самых твердых минералов на земле, имеет прозрачную или окрашенную структуру, и используется в ювелирном и индустриальном производстве.
Физические свойства графита и алмаза
- Формула: Графит имеет формулу C (углерод), а алмаз имеет ту же формулу C (углерод).
- Структура: Структура графита состоит из слоев атомов углерода, которые имеют шестиугольную решетку. Атомы углерода в слое графита связаны с трех спирально связанными атомами углерода из соседних слоев. Структура алмаза представляет собой кристаллическую решетку, в которой каждый атом углерода связан с четырьмя соседними атомами углерода.
Вот основные различия в физических свойствах графита и алмаза:
- Твердость: Графит является одним из самых мягких материалов и находится на уровне 1-2 по шкале твердости Мооса. Алмаз же является одним из самых твердых известных материалов и находится на уровне 10 по шкале твердости Мооса.
- Проводимость электричества: Графит отличается высокой проводимостью электричества благодаря свободным электронам в структуре. Алмаз же является изолятором, так как все электроны участвуют в ковалентных связях.
- Цвет: Графит имеет серый или черный цвет, а алмаз может быть прозрачным, бесцветным или иметь различные оттенки.
Эти физические свойства делают графит и алмаз уникальными материалами, каждый из которых обладает определенными особенностями и применяется в различных областях науки и промышленности.
Реакции и применение графита и алмаза
Формула графита и алмаза отличается, и это обусловлено их структурой. Алмаз состоит из трехмерной кристаллической структуры, где каждый атом углерода связан с четырьмя соседними атомами с помощью ковалентных связей. Графит, напротив, обладает двумерной структурой, а его атомы углерода соединены только с тремя соседними атомами.
Такая разница в структуре приводит к различным свойствам этих минералов. Алмаз является твердым материалом, который обладает высокой твердостью, прочностью и теплопроводностью. Графит, напротив, является мягким материалом, который легко пишется и используется для производства карандашей. Также графит обладает хорошей электропроводностью и используется в производстве электродов, батарей и других электронных устройств.
Каждый из этих минералов имеет свое применение. Алмаз используется в ювелирном производстве для создания украшений, а также в промышленности для производства режущих инструментов, ножей и алмазных дисков. Графит находит применение в производстве карандашей, смазок, теплоизоляционных материалов и других изделий. Кроме того, графит играет важную роль в нанотехнологиях и энергетике, используется в литий-ионных аккумуляторах, а также является основным компонентом ядерного топлива.
Графит и алмаз: общая структура и свойства
Структурно графит и алмаз представляют собой атомы углерода, но их атомная решетка выглядит совершенно по-разному. В графите атомы углерода соединены в слои, называемые графитными пластинами. Каждая пластина состоит из шестиугольных колец, объединенных в сетку. Между слоями графита находятся слабые взаимодействия, что придает графиту свойство мягкости и смазывания.
Алмаз, в свою очередь, имеет очень плотную структуру. Его атомы углерода соединены в трехмерную кристаллическую решетку, формируя твердое и прочное вещество. Каждый атом углерода тесно связан с соседними атомами через ковалентные связи, что делает алмаз одним из самых твердых материалов на Земле.
| Свойства | Графит | Алмаз |
|---|---|---|
| Твердость | Мягкий | Очень твердый |
| Проводимость электричества | Хороший проводник | Плохой проводник |
| Прозрачность | Непрозрачный | Прозрачный |
| Цвет | Черный | Прозрачный/разноцветный |
Как можно видеть из таблицы, графит и алмаз имеют разные свойства, несмотря на то, что оба являются разновидностями углерода. Графит мягкий, хороший проводник электричества и непрозрачный. Алмаз же очень твердый, плохо проводит электричество, и может быть прозрачным или даже разноцветным.
Между графитом и алмазом существует обратимое превращение, которое может происходить при высоких температурах и давлениях. При этом структура и свойства углерода изменяются, превращая графит в алмаз или наоборот. Это превращение имеет большое значение для промышленности и научных исследований.
Отличие графита от алмаза, особенности строения и процесс перехода одного минерала в другой
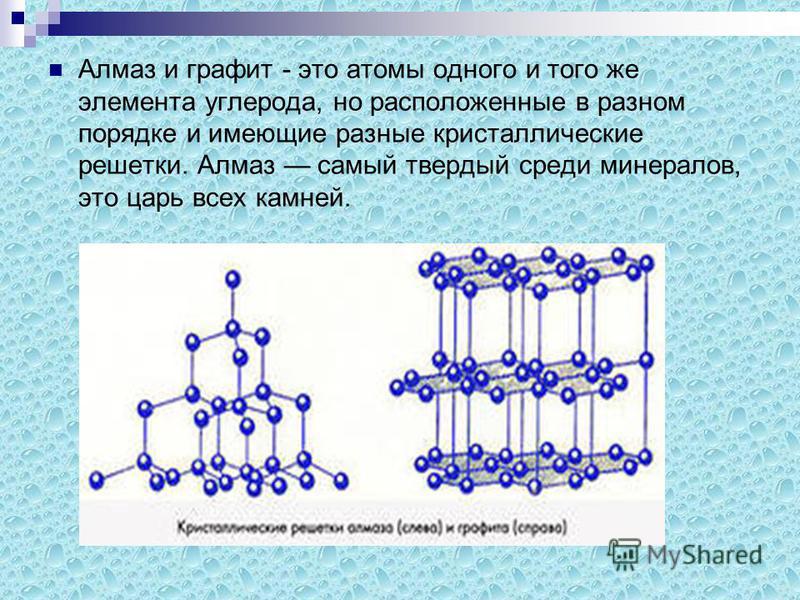
Алмаз и графит – аллотропные по отношению друг к другу минералы, то есть имеют различные свойства, но являются разными формами углерода. Их основное отличие заключается лишь в химическом строении кристаллической решетки.
Кристаллическая решетка алмаза имеет вид тэтраэдра, в котором каждый атом окружен еще 4 атомами и является вершиной соседнего тэтраэдра, образуя бесконечное множество атомов, имеющих прочные ковалентные связи.
Графит на атомном уровне состоит из пластов шестиугольников с вершинами-атомами. Атомы хорошо связаны между собой только на уровне пластов, но пласты между собой сильной связи не имеют, что делает графит мягким и нестойким к разрушению. Именно эта особенность и позволяет получить из графита алмаз.
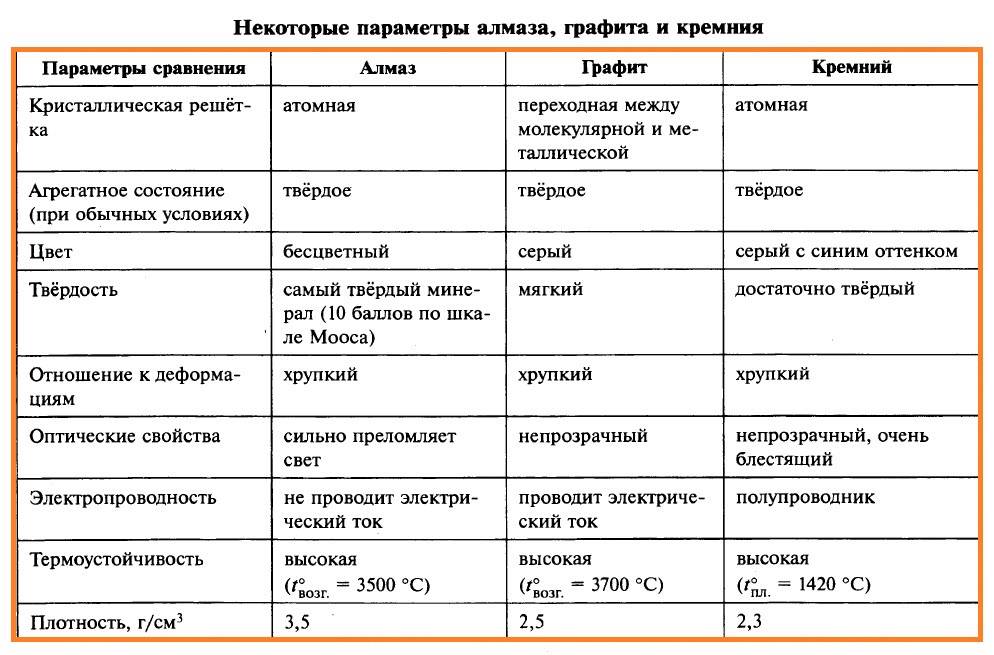
Физические и химические свойства алмаза и графита хорошо видны из таблицы.
| Характеристика | ||
|---|---|---|
| Строение атомной решетки | Кубическая форма | Гексагональная |
| Светопроводимость | Хорошо проводит свет | Не пропускает свет |
| Электропроводимость | Не обладает | Имеет хорошую электропроводимость |
| Связи атомов | Пространственные | Плоскостные |
| Структура | Твердость и хрупкость | Слоистость |
| Максимальная температура, при которой минерал остается неизменным | 720 по Цельсию | 3700 по Цельсию |
| Цвет | Белый, голубой, черный, желтый, бесцветный | Черный, серый, стальной |
| Плотность | 3560 кг/м.куб. | 2230 кг/м.куб. |
| Использование | Ювелирное дело, промышленность | Литейное производство, электроугольная промышленность. |
| Твердость по шкале Мооса | 10 | 1 |
Химическая формула алмаза и графита одна и та же – углерод (С), но процесс создания в природе разный.
Алмаз возникает при очень высоких давлениях и мгновенном охлаждении, а графит, наоборот, при низком давлении и высокой температуре.
Выделяют следующие методы получения алмазов:
Процесс алмаза в графит аналогичен. Разница лишь в показателях давления и температуры.
Месторождение минералов
Алмазы пролегают на глубинах более 100 км при температуре 1300 ̊С. От взрывной волны вступает в действие кимберлитовая магма, образуя так называемые кимберлитовые трубки, которые и являются коренными месторождениями алмазов.
Кимберлитовая трубка названа в честь африканской провинции Кимберли, где она и была впервые открыта. Породы с алмазными залежами называют кимберлитами.
Самые известные ныне месторождения находятся в Индии, Южной Африке и в России.
На коренных месторождениях, состоящих из кимберлитовых и лампроитовых трубок, добывают до 80% всех алмазов.
Найти алмазы в добытой породе помогают рентгеновские лучи. Большинство найденных камней используется в промышленности, так как не обладают достаточными характеристиками для ювелирной области. Промышленные камни разделяют на 3 вида:
- борт – мелкие камни, имеющие зернистую структуру;
- баллас – камни круглой или грушевидной формы;
- карбонадо – камень черного цвета, получивший свое название из-за сходства с углем.
Любопытно, что наиболее крупные и выдающиеся по характеристикам алмазы получают свое уникальное название. Самые известные из них – «Шах», «Звезда Минаса», «Кохинур», «Звезда Юга», «Президент Варгас», «Минас-Жерайс», «Английский алмаз Дрездена» и др.
Графит образуется в результате видоизменения осадочных пород. Мексиканские, ногинские и мадагаскарские графитовые месторождения богаты рудой с графитом низкого качества. Менее распространенные – ботогольский и цейлонский тип, отличаются рудой, богатой высоким содержанием графита. Крупнейшие известные месторождения находятся на Украине и в Краснодарском крае.
Общая характеристика алмаза
При слове «алмаз» сразу же вспоминаются тайные истории, повествующие о поисках сокровищ. Когда-то люди, охотившиеся за алмазами, и не подозревали, что предметом их страсти является кристаллический углерод, который образует сажу, копоть и уголь. Впервые это доказал Лавуазье. Он поставил опыт по сжиганию алмаза, используя собранную специально для этой цели зажигательную машину. Оказалось, алмаз сгорает на воздухе при температуре около 850-1000*С, не оставляя твердого остатка, как и обычный уголь, а в струе чистого кислорода сгорает при температуре 720-800*С. При нагревании до 2000-3000*С без доступа кислорода он переходит в графит (это объясняется тем, что гомеополярные связи между атомами углерода в алмазе очень прочны, что обусловливает очень высокую температуру плавления.
Алмаз — бесцветное, прозрачное кристаллическое вещество, чрезвычайно сильно преломляющее лучи света.
Атомы углерода в алмазе находятся в состоянии sp3-гибридизации. В возбужденном состоянии происходит распаривание валентных электронов в атомах углерода и образование четырёх неспаренных электронов.
Каждый атом углерода в алмазе окружен четырьмя другими, расположенными от него в направлении от центра в вершинах тетраэдра.
Расстояние между атомами в тетраэдрах равно 0,154 нм.
Прочность всех связей одинакова.
Весь кристалл представляет собой единый трехмерный каркас.
При 20*С плотность алмаза составляет 3,1515 гр/см. Этим объясняется его исключительная твердость, которая по граням различна и уменьшается в последовательности: октаэдр — ромбододекаэдр — куб. В то же время алмаз обладает совершенной спайностью (по октаэдру), а предел прочности на изгиб и сжатие у него ниже, чем у других материалов, поэтому алмаз хрупок, при резком ударе раскалывается и при дроблении сравнительно легко превращается в порошок. Алмаз обладает максимальной жесткостью. Сочетание этих двух свойств позволяет использовать его для абразивных и других инструментов, работающих при значительном удельном давлении.
Показатель преломления (2,42) и дисперсия (0,063) алмаза намного превышают аналогичные свойства других прозрачных минералов, что в сочетании с максимальной твердостью обусловливает его качество как драгоценного камня.
В алмазах обнаружены примеси азота, кислорода, натрия, магния, алюминия, кремния, железа, меди и других, обычно в тысячных долях процента.
Алмаз чрезвычайно стоек к кислотам и щелочам, не смачивается водой, но обладает способностью прилипать к некоторым жировым смесям.
Алмазы в природе встречаются как в виде хорошо выраженных отдельных кристаллов, так и поликристаллических агрегатов. Правильно образованные кристаллы имеют вид многогранников с плоскими гранями: октаэдр, ромбододекаэдр, куб и комбинации этих форм. Очень часто на гранях алмазов имеются многочисленные ступени роста и растворения; если они неразличимы глазом, грани кажутся искривленными, сферическими, в форме октаэдроида, гексаэдроида, кубоида и их комбинаций. Различная форма кристаллов обусловлена их внутренним строением, наличием и характером распределения дефектов, а также физико-химическим взаимодействием с окружающей кристалл средой.
Среди поликристаллических образований выделяются — баллас, карбонадо и борт.
Баллас — это сферолитовые образования с радиально-лучистым строением. Карбонадо — скрытокристаллические агрегаты с размером отдельных кристаллов 0,5-50 мкм. Борт — яснозернистые агрегаты. Балласы и особенно карбонадо имеют самую высокую твердость из всех видов алмазов.
Рис.1
Рис.2
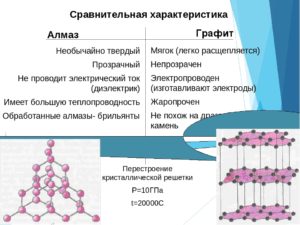
Отличия между графитом и алмазом
При сравнении основных характеристик обнаруживаются существенные различия. Некоторые качественные параметры прямо противоположные.
По десятибалльной шкале Мооса алмаз имеет твердость, равную 10, а графит – 1.
Свет может легко проходить сквозь кристалл самоцвета. Используя это свойство, самоцвет гранят особым образом и получают бриллиант. Отраженные от граней лучи играют всеми цветами радуги. Графит непрозрачный и поглощает свет.
Графит обладает магнитной восприимчивостью.
Теплопроводность алмаза – от 900 до 2300, а графита – не выше 350 Вт/(м·К). Первый является диэлектриком, а электропроводимость второго приближается к показателям металлов.
Интересно, что при нагреве алмаз сохраняется до 720 градусов по Цельсию, а графит – до 3700. При нагревании до 700 градусов по Кельвину графит сжимается, а при дальнейшем росте температуры – расширяется.
Физико-химические характеристики
Физические свойства графита довольно необычны и изменяются при воздействии внешних факторов. Минерал не является диэлектриком и проводит ток. Твердость по шкале Мооса составляет 1-2 единицы. Под действием высокой температуры становится твердым и хрупким. Плотность составляет 2,06-2,24 г/см3. Имеет темно-серый цвет. Блеск металлический. На ощупь жирный. При трении происходит расслоение на чешуйки, поэтому оставляет след.
Теплопроводность зависит от ряда факторов:
- марки графита;
- направления базисных плоскостей кристаллов;
- температуры.
Электропроводимость анизотропна. В параллельном направлении плоскости близка к проводимости металлов, в перпендикулярном направлении резко уменьшается до сотни раз, причем наименьшие значения проводимости достигаются при низких температурах. Максимум электрической проводимости наблюдается у рекристаллизованого графита. Электропроводность в 2,5 раза выше, чем у ртути.
Минерал сжимается при нагревании до 700 К. Предельная температура плавления лежит в диапазоне 3847-3891°C. При 4200° C графит начинает кипеть.
Обладает большой теплопроводностью, занимая место между платиной и палладием. Коэффициент теплопроводности в 5 раз больше, чем у кирпича.
Минерал считается немагнитным. Химически инертен, не растворяется в растворителях, кроме расплавленных металлов. Жирность и пластичность – важные свойства, которые широко применяются в промышленности. Чем жирнее графит, тем меньше коэффициент трения, поэтому графит используется в различных смазках.
Как обозначается графит в химии?
Графит – аллотропное вещество углерода, поэтому обладает схожими химическими свойствами с углеродом и обозначается латинской буквой С. В соединении с другими элементами в формуле добавляется базисное вещество.
Почему алмаз прозрачный, а графит черный, хотя оба из углерода?
Как мы уже знаем, эти минералы являются углеродом, но не всё так просто. Дело в том, что кристаллическая решетка у них отличается друг от друга. Атом углерода содержит 4 электрона, с помощью которых происходит до четырех соединений с другими атомами. В алмазе возникает 4 прочные связи, делая этот минерал самым прочным на Земле. Графит же формируется из 3 прочных связей электронов и 1 слабой, при этом имеет слоистую структуру, где эти три прочные связи формируют слой, а четвертая (слабая) скрепляет эти слои. Этим и объясняется мягкость графита, в отличие от алмаза, так как слои легко распадаются при механическом воздействии.
Непрозрачность графита объясняется поглощением света любой частоты свободными электронами. В алмазе, наоборот, электроны поглощают свет только на частотах возбуждения связей между атомами. Такие частоты света не входят в часть спектра, видимую глазом человека, поэтому для нас алмазы всегда прозрачны. Таким образом, прозрачность алмаза и непрозрачность графита объясняется различием их кристаллической решетки.
Получение алмаза из графита
Как таковое превращение графита в алмаз возможно. Это доказали еще ученые ХХ века. В 1955 г. был представлен отчет компании General Electric и синтезированы первые алмазы, правда, очень мелкие. Первым осуществил синтез исследователь компании Т. Холл. Для достижения таких успехов было применено оборудование, позволяющее создавать давление в 120 тыс. атмосфер и температуру в 1800°С.
Группой ученых из Allied Chemical Corporation было осуществлено прямое превращение графита в алмаз. Для этого были использованы более экстремальные условия по сравнению с предыдущими методами. Для создания на 1 микросекунду предельного давления в 300 тыс. атмосфер и температуры в 1200°С применялось взрывчатое вещество огромной мощности. В результате в образце графита обнаруживалось несколько мелких частичек алмаза. Данные о результате эксперимента были опубликованы в 1961 г.
Однако это были не все способы получения алмазов из графита. В 1967 г. Р. Уэнторф вырастил первый алмаз на затравке. Скорость роста оказалась достаточно низкой. Самый крупный алмаз Р. Уэнторфа, изготовленный данным методом, достиг размера в 6 мм и веса в 1 карат (примерно 0,2 г).
Прочность алмаза
Прочность алмаза связана с его кристаллической структурой. Каждый атом углерода в алмазе связан с другими атомами через ковалентные связи, которые очень крепки и устойчивы. В результате, весь кристалл образуется из множества взаимосвязанных атомов, создавая прочную сеть.
Этот материал известен своей высокой твёрдостью, благодаря которой его можно использовать для изготовления режущих инструментов и абразивов. Алмаз прекрасно справляется с обработкой других материалов, таких как металлы и камни.
Интересно то, что алмаз можно разрушить, если его ударить молотковым ударом, но этот процесс требует значительных усилий. В отличие от других материалов, алмаз не разрушается, когда на него воздействует патина или химические агенты, что делает его особенно прочным.

В отличие от алмаза, графит — материал с мягкой структурой. Атомы углерода в графите образуют слоистую структуру, в которой слои сильно связаны друг с другом ковалентными связями, но слои между собой слабо взаимодействуют. Поэтому графит легко оставляет следы на бумаге и используется в качестве пишущего инструмента.
Таким образом, прочность алмаза связана с его кристаллической структурой и ковалентными связями между атомами углерода. Благодаря этим свойствам, алмаз крепче графита и может использоваться для создания самых твёрдых и прочных материалов в наших художественных замыслах.
Свойства алмаза и графита
Коротко об аллотропном углероде и карбине. В периодической таблице Менделеева этот тип неметалла расположен под номером 6. Валентное состояние углерода коренным образом влияет на свойства вещества, в котором он присутствует.
Несмотря на то, что алмаз от графита отличается по всем характеристикам, оба минерала построены из свободного углерода.
Химические свойства
Структура кристалла алмаза пространственная. Алмаз и графит – это прочно связанные между собой тетраэдры, внутри которых атомы с ковалентной связью удалены друг от друга на равные расстояния. Доля углерода приближается к 99,8%. Незначительные примеси влияют на «чистоту» и оттенок самородка. Известно о химической стойкости к воздействию кислот и щелочей.
Важно помнить о том, что при высокой температуре сжигания от 800 до 1000 градусов на воздухе молекулы алмаза превращаются в кучку графита. Сущность кристаллической решетки графита состоит из слоев
Отдельные слои выглядят как связанные между собой шестиугольники, похожие на пчелиные соты. Расположение слоев относительно друг друга не структурированное и может различаться в самородках. Атомы связаны прочно только в пределах одного пласта. Соседние слои жестких связей между атомами не имеют. Содержат различные включения. Графит не растворяется в кислотах. При высокой температуре сгорает до аморфного газа, взаимодействуя с кислородом. Щелочные металлы и соли могут образовывать с ним «соединения включения»
Сущность кристаллической решетки графита состоит из слоев. Отдельные слои выглядят как связанные между собой шестиугольники, похожие на пчелиные соты. Расположение слоев относительно друг друга не структурированное и может различаться в самородках. Атомы связаны прочно только в пределах одного пласта. Соседние слои жестких связей между атомами не имеют. Содержат различные включения. Графит не растворяется в кислотах. При высокой температуре сгорает до аморфного газа, взаимодействуя с кислородом. Щелочные металлы и соли могут образовывать с ним «соединения включения».
Физические свойства
Различие в строении алмаза и графита обуславливает и разные физические свойства:
- Твердость. Алмаз – это самый твердый и плотный из созданных природой минералов. Он обладает минимальным коэффициентом сжатия. Графит имеет мягкую структуру, на ощупь жирный. Несмотря на разное значение плотности, оба они хрупкие и рассыпаются при падении или ударе.
- Прозрачность. Непрозрачный, серый или темно-серый графит поглощает свет. При трении отслаивается и оставляет темные следы на поверхности. Металлические включения дают самородку блеск. Строение кристаллов в алмазе дает прозрачность. Природные самоцветы не всегда абсолютно прозрачные и бесцветные. Некоторые имеют цветной оттенок. Мутные кристаллы ценятся ниже.
- Теплопроводность. Алмаз обладает самым высоким показателем, в сравнении с другими твердыми телами. Отличный полупроводник, способный работать при высоких температурах. У графита этот показатель теплопроводности крайне низкий.
- Электропроводность. Если замерять этот параметр вдоль слоев графита, результат окажется довольно высоким, приближенным к металлу. Поперек плоскостей он в сотни раз меньше, а самый высокий – у рекристаллизованного графита. Алмаз не проводит электричество, он – диэлектрик.
Применение
Применение как алмаза, так и графита намного шире, чем кажется. Для алмаза можно выделить несколько сфер использования.
В ювелирной промышленности алмазы используют только в огранке, как известно, они носят название бриллиантов. Всего 20 % всех добытых камней пригодны для украшений, а минералов высокого качества и куда меньше.
Бриллианты — самые дорогие в мире камни. По стоимости только некоторые экземпляры рубинов могут сравниться с ними. На стоимость минералов влияют огранка, цвет, оттенок и чистота. Обычно некоторые из этих характеристик невооруженным глазом являются незаметными, однако выявляются при экспертизе.
Использование бриллиантов в украшениях очень распространено. Часто они выступаю как единственный камень или дополняют высококачественные сапфиры, рубины, изумруды. Наиболее частое применение камней — кольца для помолвки.
В технической сфере обычно берут второсортное сырье, с дефектами или с различными оттенками. Технические алмазы разделяются на несколько подкатегорий.
- алмазы определенной формы, которая годится для изготовления подшипников, наконечников сверл и так далее;
- необработанные камни;
- камушки с дефектами, применяемые только для изготовления алмазной крошки и порошка.
Последние применяются либо в очень маленьких деталях, либо в качестве напыления для изготовления режущего и шлифовального инструмента.
В электронике применяются иглы, которые являют собой необработанные кристаллы, имеющие от природы острую вершину, или осколки с такой же вершиной. Буровые установки в промышленности также содержат алмазы. Прослойки из этого минерала используются в микросхемах, счетчиках и так далее, происходит это благодаря высокому коэффициенту теплопроводности и сопротивлению.
Около 60 % всех технических алмазов используется в инструментах. Остальные 40 % в равных количествах:
- при бурении скважин;
- переработке;
- в мелких деталях ювелирных изделий;
- в шлифовальных кругах.
В чистом виде графит не используется. Его, как правило, обрабатывают. Графит высочайшего качества применяется в виде стержня для карандаша. Наиболее широкое применение графит находит в литье. Здесь он применяется для обеспечения гладкой поверхности стали. Для этого он используется в необработанном виде.
В электроугольной промышленности используют не только природного происхождения минерал, но и созданный. Последний имеет высокую однородность по качеству и чистоте. Высокая проводимость тока делает его также широко используемым для изготовления электродов в приборах. Кроме того, он применяется в качестве щеток для двигателя. В металлургии графит используют как смазочный материал.
Графитовые стержни за свою способность замедлять нейтроны раньше широко использовались при создании атомных реакторов. В частности, именно боровые стержни с графитовыми наконечниками выступали в качестве стержней управления-защиты на Чернобыльской АЭС. Одна из проблем, которая после привела к аварии, была в том, что для гашения цепной реакции нужно было нейтроны поглощать, за что отвечал бор, а не замедлять. Поэтому в момент, когда стержни опустили в активную зону реактора, его энергия возросла скачком, что привело к перегреву. Но это была всего лишь одна из множества причин.
Таким образом, алмаз и графит — два разных минерала с одинаковым элементом в основе. Их структуры делают свойства разными, что и представляет интерес. Каждый из них по-своему красив и имеет очень широкое применение как в очень сложных конструкциях, так и в предметах повседневности.
Области применения
Алмаз является самым твердым из всех минералов. Он режет стекло, дерево, металл, предметы, изготовленные из веществ, уступающих алмазу по твердости. Подобная способность расширяет области применения алмазов, ранее ограничивающиеся исключительно ювелирным делом.
Графит – мягкий минерал, но именно это делает его незаменимым в промышленности, архитектуре и даже искусстве.
Алмаз
Вплоть до середины прошлого столетия алмазы использовались исключительно в качестве украшения. Камни подвергались обработке, использовались в качестве замены деньгам. Необходимо отметить, что первые попытки придать алмазу форму не имели успеха. Твердость минерала не позволяла использовать для его обработки предметы, изготовленные из металла, камня, дерева. В процессе исследований удалось выяснить, что огранку алмаза нужно проводить таким же прочным веществом, то есть самим алмазом. Такого рода открытие навело на мысль о возможности применения алмазов в других областях.
На сегодняшний день алмазам находят применение в:
Строительстве. Создание алмазных буров упростило работу с конструкциями из бетона и стали
Алмазы являются важной деталью сверл, инструментов для резки и демонтажа. Использование минералов исключает появление трещин, что особо важно при прокладке тоннелей, подведении труб, строительстве зданий
Алмазные сверла и пилы режут бетон, сталь, гранит, мрамор, перемалывает щебень. В этой области алмаз и графит не сравнимы, но опять же взаимосвязаны.
Приборостроении. Многие приборы содержат в себе частичку алмазной пыли либо цельные алмазы.
Машиностроительных областях. При обтачивании металлических инструментов чаще всего используются алмазы.
Космической области. Создание точных телескопов невозможно без использования алмазных деталей.
Хирургии. Основным инструментом хирурга является скальпель, толщина и острота которого во многом определяет успех операции. Алмазные скальпели как нельзя лучше справляются с этой задачей. Особого внимания заслуживают разрабатываемые лазеры на кристаллах, проводящим веществом которых выступает алмаз.
Телекоммуникациях и электронике. Чтобы сигналы разных частот могли проходить по одному кабелю, также используются алмазы. Применение их в этой области связано со способностью выдерживать большие температуры и скачки напряжения.
Науке. Минерал нейтрализует воздействие агрессивной среды, потому его используют как защитный элемент. Алмаз является составной частью опытов, проводимых в таких областях, как квантовая физика, оптика, создание лазеров.
Добыче полезных ископаемых. Приборы, основной деталью которых является алмаз, используются при бурении шахт, добыче нефти, угля и газа.
В промышленных целях используют алмазы, выращенные исключительно синтетическим образом. Настоящие камни используются крайне редко, несмотря на то, что графит и алмаз встречаются в природе.
Структура алмаза и графита
И алмаз, и графит – это разные формы одного и того же элемента – углерода. У мягкого, крошащегося графита и у самого твердого кристалла в мире одна и та же формула – С. Как такое возможно?
Физические и химические свойства
Алмаз не обладает электропроводностью, но тепло проводит. Хорошо преломляет и отражает свет. Прозрачен, имеет блеск. Плавится при 3700-4000 градусов. Лавуазье впервые сжег диамант в 18 веке.
Позже ученые выяснили, что в соединении с кислородом алмаз горит при 721-800 градусах, испаряясь углекислым газом. Без воздуха может перейти в графит при нагреве до 2001-3000 градусов. Химические свойства говорят об устойчивости к воздействию кислот.
Графит электро-и-теплопроводный, нерастворим кислотами и водой, теплостойкий. Температура плавления 2500 – 3000 градусов. Не горит до 250-300 градусов, но при сжигании с температурой выше 300 и до 1000 превращается в углекислый газ.
Основные физические и химические свойства графита
- Графит имеет мягкую и смазчивую текстуру. При соприкосновении с другими поверхностями он оставляет чёрную марку.
- Он обладает слоистой структурой, в которой атомы углерода расположены в виде шестиугольных плоскостей, называемых графеном.
- Графит является хорошим проводником электричества и тепла благодаря своей структуре и свободным электронам в слоях графена.
- Он обладает высокой температурной стабильностью и не сгорает при обычных условиях. Это делает его полезным материалом для применения в высокотемпературных процессах.
- Графит имеет низкую плотность, что делает его лёгким и удобным материалом для использования в различных отраслях промышленности.
- Он обладает хорошей химической инертностью, что означает, что графит обычно не подвергается химическому воздействию других веществ. Однако, некоторые хлорированные вещества и сильные окислители могут взаимодействовать с ним и вызывать разрушение структуры графита.
Основные физические и химические свойства графита делают его важным и широко используемым материалом в различных областях, включая производство карандашей, электродов, смазок, теплоотводящих материалов и многих других продуктов.
Использование графита
Работоспособность подшипников скольжения обеспечивается за счет использования графита
Что важно, темп износа графитовой опоры или обоймы постоянен во всем диапазоне рабочих температур подшипников, нередко насчитывающем сотни градусов.. Графит обладает не только смазывающими, но и абразивными способностями
Тончайшие полировочные пасты содержат в себе графит. Введенный в состав фрикционных материалов, минерал повышает устойчивость изделий к нагреву.
Графит обладает не только смазывающими, но и абразивными способностями. Тончайшие полировочные пасты содержат в себе графит. Введенный в состав фрикционных материалов, минерал повышает устойчивость изделий к нагреву.
Керамика, замешанная на графите, отличается особой огнеупорностью. Электропроводность и стойкость материала к эрозии дает возможность изготавливать из графита высоковольтные контакты, облицовку сопел и дюз.
Инертность графита делает его отличным защитным покрытием для всевозможных конструкций. Краски, созданные на основе графитовой взвеси в растворителе-пластификаторе, работают и на твердых (бетон, сталь), и на упругих (древесина, алюминий) поверхностях.
Алмаз, графит и уголь
– состоят из однородных атомов графита, но имеют различные кристаллические решетки.