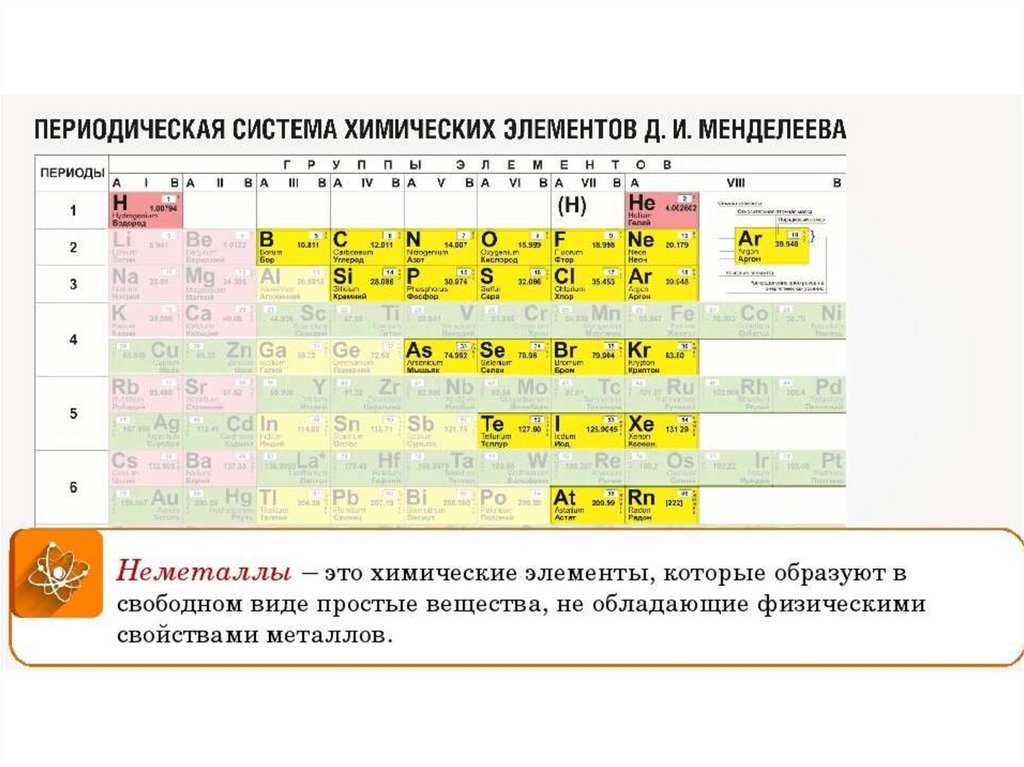
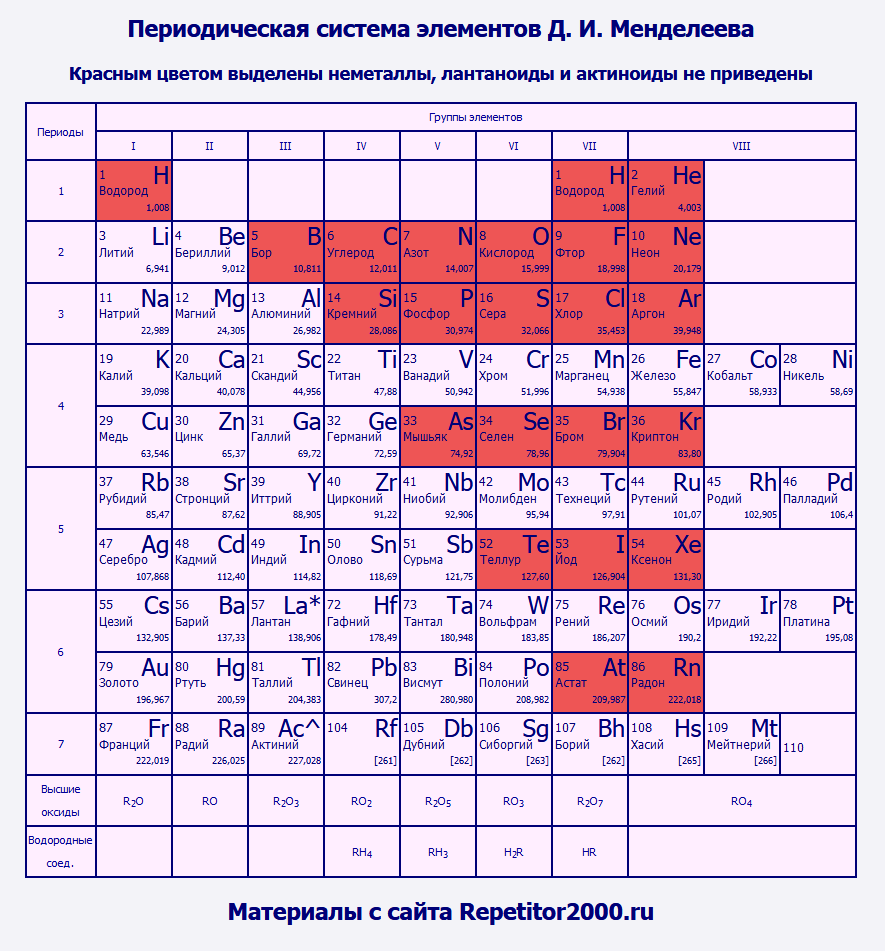
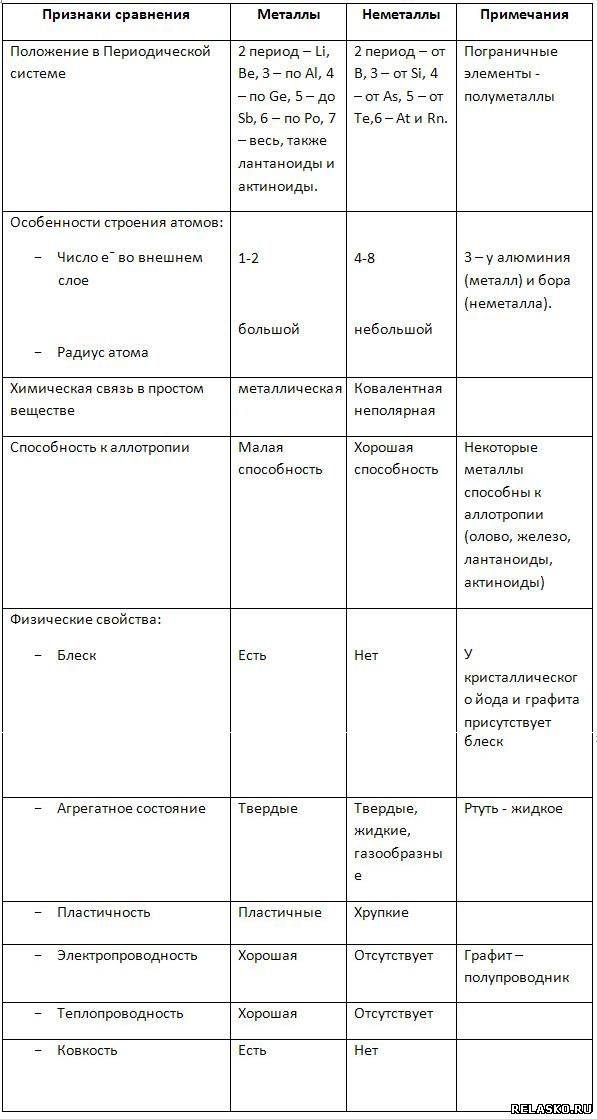
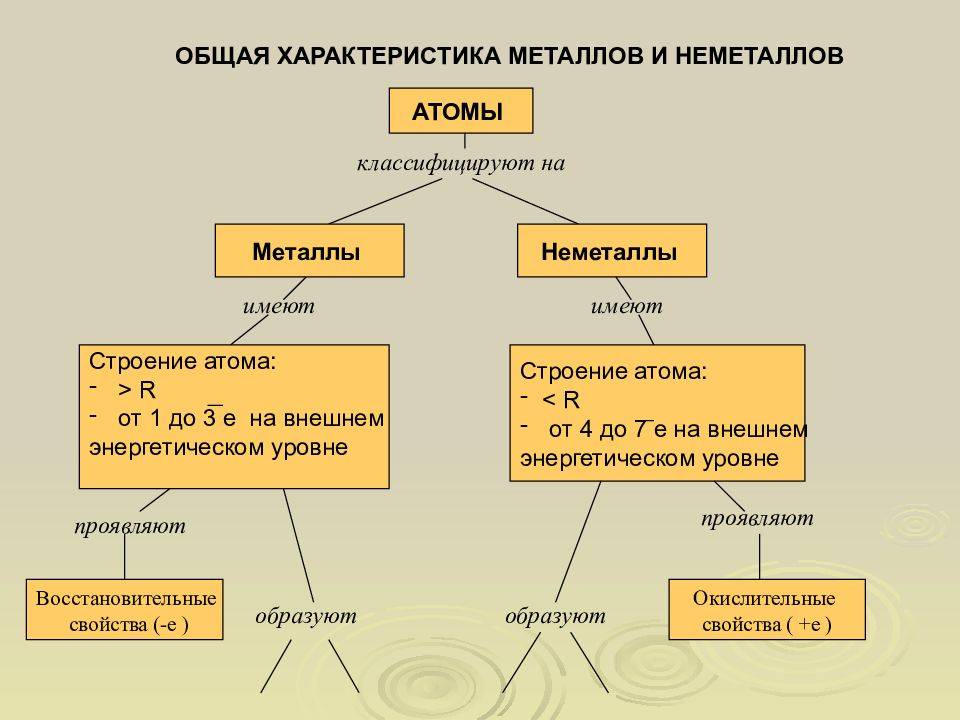
Общие физические свойства
Существуют общие физические свойства металлов. К ним относятся:
- Пластичность.
- Характерный блеск.
- Электропроводность.
- Высокая теплопроводность.
- Все, кроме ртути, находятся в твердом состоянии.
Следует понимать, что свойства металлов очень различаются относительно их химической или физической сути. Некоторые из них мало похожи на металлы в обыденном понимании этого термина. Например, ртуть занимает особенное положение. Она при обычных условиях находится в жидком состоянии, не имеет кристаллической решетки, наличию которой обязаны своими свойствами другие металлы. Свойства последних в этом случае условны, с ними ртуть роднят в большей степени химические характеристики.
Интересно! Элементы первой группы, щелочные металлы, в чистом виде не встречаются, находясь в составе различных соединений.
Самый мягкий металл, существующий в природе — цезий — относится к этой группе. Он, как и другие щелочные подобные вещества, мало общего имеет с более типичными металлами. Некоторые источники утверждают, что на самом деле, самый мягкий металл калий, что сложно оспорить или подтвердить, поскольку ни тот, ни другой элемент не существует сам по себе — будучи выделенным в результате химической реакци они быстро окисляются или вступают в реакцию.
Вторая группа металлов — щелочноземельные — намного ближе к основным группам. Название «щелочноземельные» происходит из древних времен, когда окислы назывались «землями», поскольку они имеют рыхлую рассыпчатую структуру. Более-менее привычными (в обиходном смысле) свойствами обладают металлы начиная с 3 группы. С увеличением номера группы количество металлов убывает
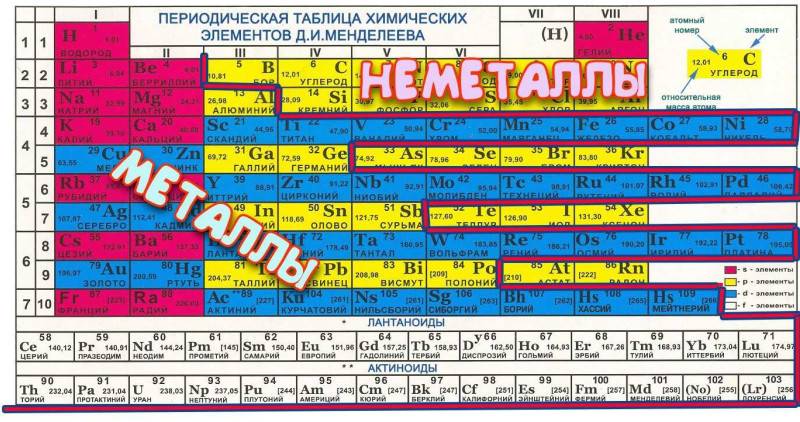
Дмитрий Менделеев смог создать уникальную таблицу химических элементов, главным достоинством которой была периодичность. Металлы и неметаллы в таблице Менделеева располагаются так, что их свойства изменяются периодическим образом.
Периодическая система была составлена Дмитрием Менделеевым во второй половине 19 века. Открытие не только позволило упростить работу химиков, она смогла объединить в себе как в единой системе все открытые химические вещества, а также предсказать будущие открытия.
Создание данной структурированной системы бесценно для науки и для человечества в целом. Именно это открытие дало толчок развитию всей химии на долгие годы.
В интервью одному журналисту ученый объяснил, что работал над ней 25 лет и то, что она ему снилась – вполне естественно, но это не значит, что во сне пришли все ответы.
Созданная Менделеевым система делится на две части:
- периоды – столбики по горизонтали в одну или две строки (ряды);
- группы – вертикальные строчки, в один ряд.
Всего в системе 7 периодов, каждый следующий элемент отличен от предыдущего большим количеством электронов в ядре, т.е. заряд ядра каждого правого показателя больше левого на единицу. Каждый период начинается с металла, а заканчивается инертным газом – именно это и есть периодичность таблицы, ведь свойства соединений меняются внутри одного периода и повторяются в следующем
. При этом, следует помнить, что 1-3 периоды неполные или малые, в них всего 2, 8 и 8 представителей. В полном периоде (т.е. оставшихся четырех) по 18 химических представителей.
 В группе располагаются химические соединения с одинаковой высшей , т.е. у них одинаковое электронное строение. Всего в системе представлено 18 групп (полная версия), каждая из которых начинается щелочью и заканчивается инертным газом. Все, представленные в системе субстанции, можно разделить на две основные группы – металл или неметалл.
В группе располагаются химические соединения с одинаковой высшей , т.е. у них одинаковое электронное строение. Всего в системе представлено 18 групп (полная версия), каждая из которых начинается щелочью и заканчивается инертным газом. Все, представленные в системе субстанции, можно разделить на две основные группы – металл или неметалл.
Для облегчения поиска группы имеют свое название, а металлические свойства субстанций усиливаются с каждой нижней строчкой, т.е. чем ниже соединение, тем больше у него будет атомных орбит и тем слабее электронные связи. Также меняется и кристаллическая решетка – она становится ярко выраженной у элементов с большим количеством атомных орбит.
В химии используют три вида таблиц:
- Короткая – актиноиды и лантаноиды вынесены за границы основного поля, а 4 и все последующие периоды занимают по 2 строчки.
- Длинная – в ней актиноиды и лантаноиды вынесены за границу основного поля.
- Сверхдлинная – каждый период занимает ровно 1 строку.
Главной считается та таблица Менделеева, которая была принята и подтверждена официально, но для удобства чаще используют короткую версию. Металлы и неметаллы в таблице Менделеева располагаются согласно строгим правилам, которые облегчают работу с ней.
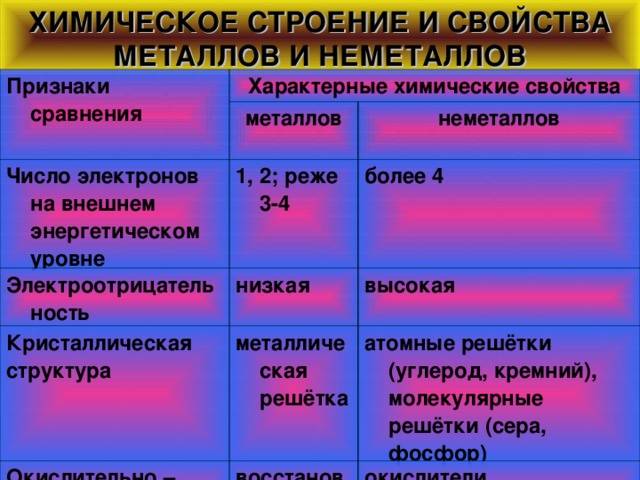
Физические свойства металлов и неметаллов
Чтобы продолжить сравнительную характеристику металлов и неметаллов, остановимся более подробно на описании важных физических особенностей веществ из обеих групп:
- Температура плавления. Неметаллы плавятся (т.е. переходят из твердого в жидкое состояние) при очень низких минусовых температурах (несколько сот градусов ниже нуля). Исключением является бром, жидкий уже при -7. Металлы же (кроме ртути) необходимо нагреть, чтобы перевести в жидкость. Температуры плавления различаются от нескольких десятков до нескольких тысяч градусов выше нуля.
- Пластичность. Атомные решетки большинства металлов устроены так, что их слои легко сдвигаются относительно друг друга без разрушения связи. Неметаллические решетки гораздо более жесткие и статичные. Поэтому проволоку или металлический лист можно согнуть, а, например, грифель карандаша – нет.
- Электро- и теплопроводность. Эти свойства зависят от наличия на внешних орбитах атомов свободных электронов, которые имеют слабую связь с ядром и друг с другом, и потому легко перемещаются к соседним атомам. В металлах таких электронов много, и они способны создать мощный тепловой или электрический поток. В неметаллах электроны внешнего слоя более связаны, их перемещение между атомами очень затруднено, поэтому такие вещества почти не проводят тепло и особенно электричество.
- Цвет. Неметаллы могут быть очень разных цветов и оттенков, их поверхность обычно матовая или тусклая. Большинство металлов – светло-серые с отливом разных оттенков, золото и цезий – желтые, медь красная, осмий – голубой. Отличаются блестящей глянцевой поверхностью (за счет колеблющихся свободных электронов).
В чем разница между металлами и неметаллами?
И металлы, и неметаллы имеют разные химические и физические свойства.
Металлы являются отличными проводниками электричества и тепла, и когда они подвергаются химическим изменениям, они теряют электроны и становятся катионами. Кроме того, металлы твердые при комнатной температуре, гибкие и растяжимые. Обычно они бывают одного или двух цветов, в основном серебристого оттенка.
Неметаллы, с другой стороны, не являются их проводниками и приобретают электроны и превращаются в анионы, когда претерпевают химические изменения. Кроме того, неметаллы могут быть твердыми, жидкими или газообразными и иметь разные цвета. Они хрупкие, не растягиваются или негибкие, если находятся в твердой форме.
Вкратце:Металлы против неметаллов• Химические элементы классифицируются как металлы и неметаллы или металлоиды на основе их физических и химических свойств. • Металлы являются хорошими проводниками электричества и тепла, а неметаллы – плохими проводниками. • Металлы гибкие и пластичные, а неметаллы – нет. • Металлы обычно бывают твердыми, а неметаллы – твердыми, жидкими или газообразными. • Металлы имеют определенный блеск или блеск, в то время как неметаллы тусклые; однако неметаллы бывают разных цветов. • Металлы обычно образуют основные оксиды, тогда как неметаллы являются хорошими окислителями. • Металлы, подвергаясь химическим изменениям, теряют электроны, в то время как неметаллы получают электроны и превращаются в анионы. • Температура плавления и кипения неметаллов значительно ниже по сравнению с металлами, за исключением углерода. • Неметаллы – это углерод, водород, азот, фосфор, кислород, сера, селен, галогены и благородные газы. |
Авторство изображения: Periodic_table.svg: Создано производным от Cepheus произведением: TheSmuel (Periodic_table.svg) , через Wikimedia Commons
Химические свойства: основные признаки взаимодействия
Химические свойства веществ определяются их способностью взаимодействовать с другими веществами. Одним из основных признаков взаимодействия является способность вещества образовывать химические соединения. Металлы, как правило, обладают активной реакционностью и легко вступают в химические реакции.
Один из основных признаков взаимодействия вещества с другими веществами — способность образовывать соединения с кислотами. Металлы, такие как натрий и калий, реагируют с кислородом воды и образуют соединения — гидроксиды, которые можно обнаружить по характерному запаху ищи стеклу.
Другим признаком взаимодействия вещества является способность образовывать соли. Например, медь и серебро могут реагировать с кислотой хлороводородной и образовывать хлориды — соли, которые имеют характерные свойства и могут использоваться в различных отраслях промышленности.
Некоторые вещества могут образовывать кислоты или основания, в зависимости от условий. Так, некоторые металлы образуют основания, которые могут использоваться в качестве омылителей и очистителей. В то же время, некоторые неметаллы могут образовывать кислоты, которые играют важную роль в процессах пищеварения и обмена веществ.
Свойства
Строение кристаллической решётки определяет основные физические и химические свойства металлов. Металлы блестят, плавятся, проводят тепло и электричество. Промышленность и металлургия нашли применение физическим свойствам металлов в изготовлении деталей, фольги, корпусов машин, зеркал, бытовой и промышленной химии. Особенности металлов и их использование представлены в таблице физических свойств металлов.
Свойства | Особенности | Примеры | Применение |
Металлический блеск | Способность отражать солнечный свет | Наиболее блестящими металлами являются Hg, Ag, Pd | Изготовление зеркал |
Плотность | Лёгкие – имеют плотность меньше 5 г/см3 | Na, K, Ba, Mg, Al. Самый лёгкий металл – литий с плотностью 0,533 г/см3 | Изготовление облицовки, деталей самолётов |
Тяжёлые – имеют плотность больше 5 г/см3 | Sn, Fe, Zn, Au, Pb, Hg. Самый тяжёлый – осмий с плотностью 22,5 г/см3 | Использование в сплавах | |
Пластичность | Способность изменять форму без разрушений (можно раскатать в тонкую фольгу) | Наиболее пластичные – Au, Cu, Ag. Хрупкие – Zn, Sn, Bi, Mn | Формовка, сгибание труб, изготовление проволоки |
Твёрдость | Мягкие – режутся ножом | Na, K, In | Изготовление мыла, стекла, удобрений |
Твёрдые – сравнимы по твёрдости с алмазом | Самый твёрдый – хром, режет стекло | Изготовление несущих конструкций | |
Температура плавления | Легкоплавкие – температура плавления ниже 1000°С | Hg (38,9°С), Ga (29,78°С), Cs (28,5°С), Zn (419,5°C) | Производство радиотехники, жести |
Тугоплавкие – температура плавления выше 1000°С | Cr (1890°С), Mo (2620°С), V (1900°С). Наиболее тугоплавкий – вольфрам (3420°С) | Изготовление ламп накаливания | |
Теплопроводность | Способность передавать тепло другим телам | Лучше всего проводят ток и тепло Ag, Cu, Au, Al | Приготовление пищи в металлической посуде |
Электропроводность | Способность проводить электрический ток за счёт свободных электронов | Передача электричества по проводам |
Рис. 3. Примеры применения металлов.
Что мы узнали?
Из урока 9 класса узнали о физических свойствах металлов. Кратко рассмотрели положение металлов в периодической таблице и особенности строения кристаллической решётки. Благодаря строению металлы обладают пластичностью, твёрдостью, способностью плавиться, проводить электрический ток и тепло. Свойства металлов неоднородны. Различают лёгкие и тяжёлые металлы, лёгкоплавкие и тугоплавкие, мягкие и твёрдые. Физические свойства используются для изготовления сплавов, электрических проводов, посуды, мыла, стекла, конструкций различной формы.
/10
Вопрос 1 из 10
Какие группы периодической таблицы занимают металлы?
- I-II, главные подгруппы III-VIII групп
- I-II, побочные подгруппы III-VIII групп
- Главные подгруппы I-II групп, III-VIII
- Побочные подгруппы I-II групп, III-VIII
Коррозия металлов
Коррозия — самопроизвольный процесс окисления металла под действием факторов окружающей среды.
В природе практически не встречается металлов в свободном виде. Исключение составляют только «благородные», самые неактивные металлы, например золото, платина. Все остальные активно окисляются под действием кислорода, воды, кислот и др. Например, ржавчина образуется на любом незащищённом железном изделии именно в присутствии кислорода или воды. При этом окисляется железо:
а восстанавливаются компоненты атмосферной влаги:
В результате образуется гидроксид железа (II), который, окисляясь, превращается в ржавчину:
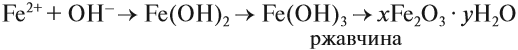
Подвергаться коррозии могут и другие металлы, правда, ржавчина на их поверхности не образуется. Так, нет на Земле металла алюминия — самого распространённого металла на планете. Но зато основу многих горных пород и почвы составляет глинозём Al2O3. Дело в том, что алюминий мгновенно окисляется на воздухе. Коррозия металлов наносит колоссальный ущерб, разрушая различные металлические конструкции.
Чтобы уменьшить потери от коррозии, следует устранить причины, которые её вызывают. В первую очередь, металлические предметы следует изолировать от влаги. Это можно сделать разными способами, например, хранить изделие в сухом месте, что далеко не всегда возможно. Кроме того, можно поверхность предмета покрасить, смазать водоотталкивающим составом, создать искусственную оксидную плёнку. В последнем случае в состав сплава вводят хром, который «любезно» распространяет собственную оксидную плёнку на поверхность всего металла. Сталь становится нержавеющей.
Изделия из нержавеющей стали дороги. Поэтому для защиты от коррозии используют тот факт, что менее активный металл не изменяется, т. е. не участвует в процессе. Поэтому если к сохраняемому изделию приварить более активный металл, то, пока он не разрушится, изделие корродировать не будет. Этот способ защиты называется протекторной защитой.

Химические свойства металлов
Металлы легко отдают электроны, т. е. являются восстановителями. Поэтому они легко реагируют с окислителями.
Вопросы
- Какие атомы являются окислителями?
- Как называются простые вещества, состоящие из атомов, которые способны принимать электроны?
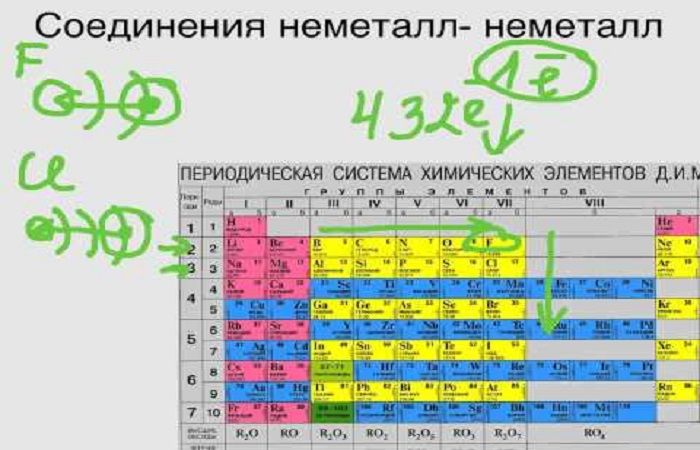
Таким образом, металлы реагируют с неметаллами. В таких реакциях неметаллы, принимая электроны, приобретают обычно НИЗШУЮ степень окисления.
Рассмотрим пример. Пусть алюминий реагирует с серой:
Вопрос. Какой из этих химических элементов способен только отдавать электроны? Сколько электронов?
Алюминий — металл, имеющий на внешнем уровне 3 электрона (III группа!), поэтому он отдаёт 3 электрона:
Поскольку атом алюминия отдает электроны, атом серы принимает их.
Вопрос. Сколько электронов может принять атом серы до завершения внешнего уровня? Почему?
У атома серы на внешнем уровне 6 электронов (VI группа!), следовательно, этот атом принимает 2 электрона:
Таким образом, полученное соединение имеет состав:
В результате получаем уравнение реакции:
Задание 8.5. Составьте, рассуждая аналогично, уравнения реакций:
- кальций + хлор (Cl2);
- магний + азот (N2).
Составляя уравнения реакций, помните, что атом металла отдаёт все внешние электроны, а атом неметалла принимает столько электронов, сколько их не хватает до восьми.
Названия полученных в таких реакциях соединений всегда содержат суффикс ИД:
Корень слова в названии происходит от латинского названия неметалла (см. урок 2.4).
Металлы реагируют с растворами кислот (см. урок 2.2). При составлении уравнений подобных реакций и при определении возможности такой реакции следует пользоваться рядом напряжений (рядом активности) металлов:
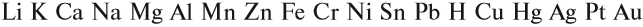
Металлы, стоящие в этом ряду до водорода, способны вытеснять водород из растворов кислот:
Задание 8.6. Составьте уравнения возможных реакций:
- магний + серная кислота;
- никель + соляная кислота;
- ртуть + соляная кислота.
Все эти металлы в полученных соединениях двухвалентны.
Реакция металла с кислотой возможна, если в результате её получается растворимая соль. Например, магний практически не реагирует с фосфорной кислотой, поскольку его поверхность быстро покрывается слоем нерастворимого фосфата:
Металлы, стоящие после водорода, могут реагировать с некоторыми кислотами, но водород в этих реакциях не выделяется:
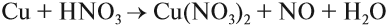
Задание 8.7. Какой из металлов — Ва, Mg, Fе, Рb, Сu — может реагировать с раствором серной кислоты? Почему? Составьте уравнения возможных реакций.
Металлы реагируют с водой, если они активнее железа (железо также может реагировать с водой). При этом очень активные металлы (Li – Al) реагируют с водой при нормальных условиях или при небольшом нагревании по схеме:
где х — валентность металла.
Задание 8.8. Составьте уравнения реакций по этой схеме для К, Nа, Са. Какие ещё металлы могут реагировать с водой подобным образом?
Возникает вопрос: почему алюминий практически не реагирует с водой? Действительно, мы кипятим воду в алюминиевой посуде, — и… ничего! Дело, в том, что поверхность алюминия защищена оксидной пленкой (условно — Al2O3). Если её разрушить, то начнётся реакция алюминия с водой, причём довольно активная. Полезно знать, что эту плёнку разрушают ионы хлора Cl–. А поскольку ионы алюминия небезопасны для здоровья, следует выполнять правило: в алюминиевой посуде нельзя хранить сильно солёные продукты!
Вопрос. Можно ли хранить в алюминиевой посуде кислые щи, компот?
Менее активные металлы, которые стоят в ряду напряжений после алюминия, реагируют с водой в сильно измельчённом состоянии и при сильном нагревании (выше 100 °C) по схеме:
Металлы, менее активные, чем железо, с водой не реагируют!
Металлы реагируют с растворами солей. При этом более активные металлы вытесняют менее активный металл из раствора его соли:

Задание 8.9. Какие из следующих реакций возможны и почему:
- серебро + нитрат меди II;
- никель + нитрат свинца II;
- медь + нитрат ртути II;
- цинк + нитрат никеля II.
Составьте уравнения возможных реакций. Для невозможных поясните, почему они невозможны.
Следует отметить (!), что очень активные металлы, которые при нормальных условиях реагируют с водой, не вытесняют другие металлы из растворов их солей, поскольку они реагируют с водой, а не с солью:
А затем полученная щёлочь реагирует с солью:
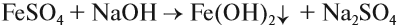
Поэтому реакция между сульфатом железа и натрием НЕ сопровождается вытеснением менее активного металла:
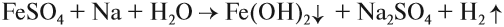
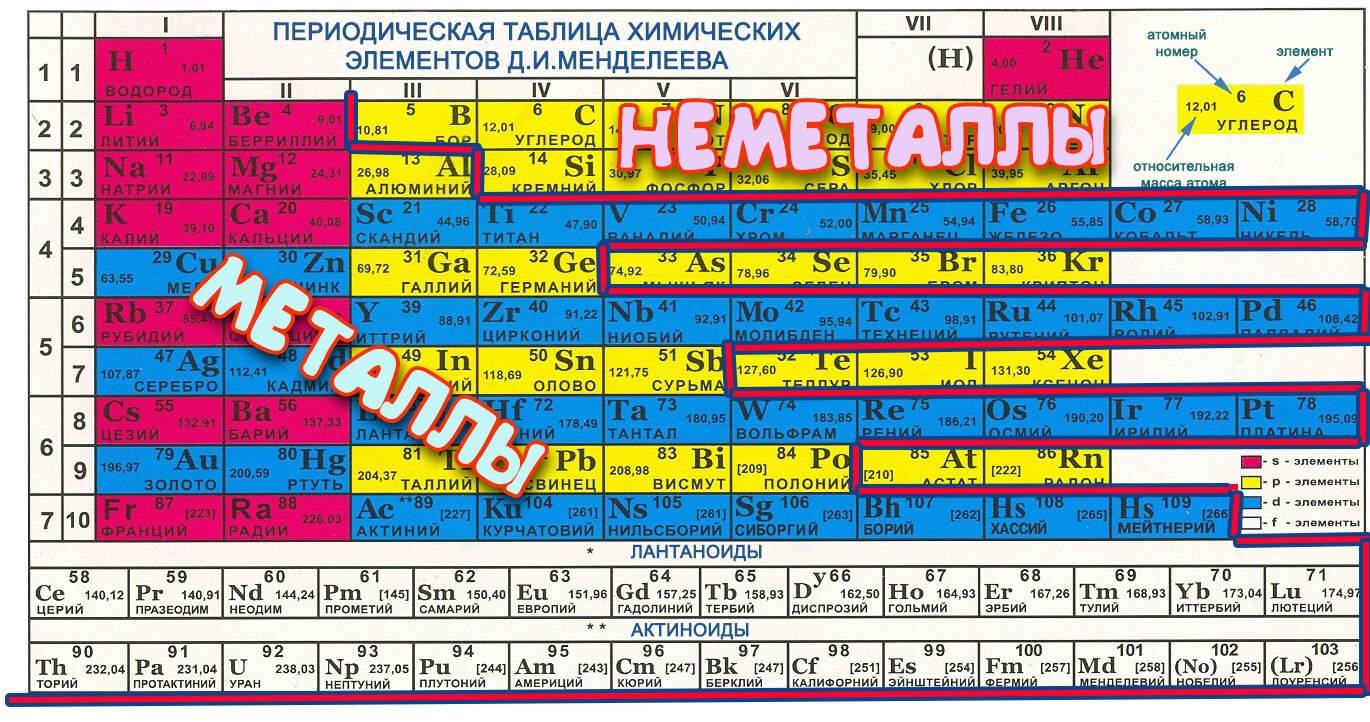
Элементы таблицы Менделеева
Существует также класс «металлоподобных» полупроводников с неопределенным состоянием. Благородные газы, не вступающие в реакции, находятся отдельно.
Часть элементов с номерами больше 100 были обнаружены сравнительно недавно, их принадлежность к какой-либо группе является лишь предположением.
Щелочные и щелочноземельные элементы
Представители групп 1 (IA) и 2 (IIA) таблицы Менделеева — металлы с плохой стабильностью и высокой степенью растворимости.
Щелочные металлы имеют серебристый блеск и легко ломаются и режут. Из всех помещенных на столе металлов они активнее других реагируют с молекулами других веществ, отдавая единственный свободный электрон. При контакте с водой образуются гидроксиды – щелочи:
2Na + 2H2O = 2NaOH + H2
Щелочноземельные металлы более твердые и тугоплавкие, с бледно-серым оттенком.
Большинство из них способны создавать щелочь, но их не так легко отделить от двух незанятых электронов. Они заменяют другие металлы, но бессильны против щелочных металлов и вытесняются ими из молекул.
Галогены и благородные газы
Галогены и благородные газы сгруппированы в группы 17 и 18 периодической таблицы. Галогены — неметаллические элементы, все они имеют семь электронов на внешней оболочке. В благородных газах все электроны находятся на внешней оболочке, поэтому практически не участвуют в образовании соединений. Эти газы называются «благородными», потому что они редко реагируют с другими элементами; то есть относится к членам благородной касты, которые традиционно избегали других людей в обществе.
| Галогены | Благородные газы |
| Фтор F 9 | Гелий он 2 |
| Хлор Cl 17 | Неон Неон 10 |
| Бром Бр 35 | Аргон Ар 18 |
| Йод I 53 | Криптон Кр 36 |
| Астатин в 85 лет | Ксенон Хе 54 |
| — | Радоновый р-н 86 |
Лантаниды (редкоземельные элементы) и актиниды
Лантаниды представляют собой группу элементов, изначально обнаруженных в редких минералах; отсюда и название «редкоземельные элементы». Впоследствии оказалось, что эти элементы не так редки, как считалось сначала, и поэтому редкоземельным элементам было дано название лантаноиды. Лантаниды и актиноиды занимают два блока, которые расположены ниже основной таблицы элементов. Обе группы включают металлы; все лантаноиды (кроме прометия) не радиоактивны; актиниды, с другой стороны, радиоактивны.
| Лантаноиды | Актиниды |
| Лантан Ла 57 | Актиний Ac 89 |
| Церий Се 58 | Торий Th 90 |
| Празеодим Пр 59 | Протактиний Па 91 |
| Неодим Nd 60 | Уран U 92 |
| Прометий Pm 61 | Нептуний Np 93 |
| Самарий См 62 | Плутоний Pu 94 |
| Европий Eu 63 | Америций Ам 95 |
| Гадолиний Бог 64 | Кюриум см 96 |
| Тербий Тб 65 | Берклиум Бк 97 |
| Диспрозий Dy 66 | Калифорния cf 98 |
| Гольмий Хо 67 | Эйнштейний 99 |
| Эрбий Er 68 | Ферми FM 100 |
| Тулий Тм 69 | Менделевий Мд 101 |
| Иттербий Yb 70 | Нобелий № 102 |
Неметаллы
Из всех элементов, отнесенных к неметаллам, водород принадлежит к первой группе таблицы Менделеева, а остальные к группам 13-18. Неметаллы не являются хорошими проводниками тепла и электричества. Обычно они находятся в газообразном (водород или кислород) или твердом (углерод) состоянии при комнатной температуре).
| Нет металлов |
| Водород H1 |
| C6 углерод |
| Азот №7 |
| Кислород О8 |
| Фосфор Р 15 |
| Сера S16 |
| Селен Se 34 |
| Флеровиум Фл 114 |
| Унунсептиус Уус 117 |
Металлоиды
Металлоиды занимают 13-16 группы периодической таблицы. Металлоиды, такие как бор, германий и кремний, являются полупроводниками и используются для изготовления компьютерных микросхем и печатных плат.
| Металлоиды |
| Бор B5 |
| Кремний Да 14 |
| Германий Ge 32 |
| Мышьяк As 33 |
| Сурьма Sb 51 |
| Теллур Те 52 |
| Полоний Ро 84 |
Переходные металлы
Переходные металлы занимают группы 3-12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (через которые они соединяются с другими элементами) находятся в нескольких электронных оболочках.
| Переходные металлы |
| Скандий Sc 21 |
| Титан Ти 22 |
| Ванадий V 23 |
| Хром Cr 24 |
| Марганец марганец 25 |
| Железо Fe 26 |
| Кобальт Co27 |
| Никель Ni 28 |
| Медь Cu29 |
| Цинк Zn 30 |
| Иттрий Y 39 |
| Цирконий Zr40 |
| Ниобий Nb 41 |
| Молибден Мо 42 |
| Технеций Tc 43 |
| Рутений Ru 44 |
| Родий Rh45 |
| Палладий Pd 46 |
| Серебро Ag 47 |
| Кадмий Cd 48 |
| Лютеций Лу 71 |
| Гафний Hf 72 |
| Тантал Та 73 |
| Вольфрам W74 |
| Рений Ре 75 |
| Осмий Ос 76 |
| Иридий Ир 77 |
| Платина, часть 78 |
| Au 79 Золото |
| Меркурий ртутного столба 80 |
| Лоуренсио Lr 103 |
| Резерфордий Rf 104 |
| Дубний Дб 105 |
| Сиборгиум Sg 106 |
| Бори Бх 107 |
| Хассиум Hs 108 |
| Мейтнериум гора 109 |
| Дармштадт Дс 110 |
| Рентген Рг 111 |
| Коперник Cn 112 |
Постпереходные металлы
Они тоже «легкие». Отличаются от переходных аналогов меньшей твердостью и весом. У них разные температуры плавления и кипения. Для соединений электроны отдаются только с внешней оболочки. По степени восстановления они превосходят полуметаллы. Легкий металл выглядит как вещество с матовым покрытием, а не блестящим.
Характеристика металлов, неметаллов и металлоидов
Периодическая таблица элементов разделена на эти три большие группы элементов в соответствии с их физическими и химическими свойствами и в зависимости от взаимодействия каждого элемента с природой..
Наиболее выдающиеся характеристики каждого из этих элементов описаны ниже:
Характеристики металлов
Наиболее важной характеристикой металлических элементов, без сомнения, является их важная способность проводить тепло и электричество. Наиболее важными электрическими проводниками являются золото, медь и алюминий
С физической точки зрения металлы также обладают способностью отражать свет, поэтому они обычно имеют яркий внешний вид..
Они имеют высокую температуру плавления (выше 600 ° С), поэтому при нормальных условиях окружающей среды они обычно являются твердыми. За исключением ртути, состояние которой при комнатной температуре является жидким.
Кроме того, подавляющее большинство металлов податливы, то есть они способны формировать тонкие листы под действием сил сжатия.
С другой стороны, металлы обычно пластичны. Это означает, что они могут быть отлиты в виде тонких проволок или проволок при растяжении с растягивающими напряжениями.
Характеристики неметаллов
В основном то, что отличает эти элементы от металлов, это неспособность проводить через них тепло и / или электричество..
Кроме того, температуры плавления неметаллов значительно ниже по сравнению с температурой плавления металлов..
Следовательно, неметаллы – это слабые элементы, которые легко ломаются, что означает, что они не являются пластичными или податливыми..
Неметаллы присутствуют в природе в трех состояниях материи. В обычных условиях окружающей среды возможно оценить газы (водород или кислород), жидкости (бром) и твердые вещества (сера или фосфор).
Неметаллы имеют очень разнообразный внешний вид и, как правило, представляют собой элементы низкой плотности с очень низкой яркостью..
Характеристика металлоидов
Эти элементы имеют смешанные свойства металлов и неметаллов. Например, они имеют среднюю тепло- и электропроводность, а также могут быть как яркими, так и непрозрачными..
Как правило, металлоиды являются полупроводниками, то есть повышение температуры также увеличивает их электропроводность.
Благодаря этой последней характеристике они часто используются в области электроники. Примером этого является кремний.
Металлоиды также различаются по плотности, температуре плавления, цвету и форме..
Типы кристаллических решеток
Все металлы в твердом состоянии представляют собой кристаллы. Кристалл – это совокупность атомов, расположенных в пространстве не хаотично, а в геометрически правильной последовательности. Пространственное расположение атомов и образует кристаллическую решетку.
В узлах пространственной кристаллической решетки металла правильно расположены положительно заряженные ионы, а между ними перемещаются свободные электроны – электронный газ. Переходя от одного катиона к другому, они осуществляют связь между ионами и превращают кристалл металла в единое целое. Эта связь, называемая металлической, возникает между атомами металлов за счет перекрывания электронных облаков внешних электронов. Металлическая связь отличается от неполярной ковалентной связи своей ненаправленностью. В кристалле металлического типа электроны не закреплены между двумя атомами, а принадлежат всем атомам данного кристалла, т. е. делокализованы. К особенности структуры металлических кристаллов относятся большие координационные числа – 8÷12, которым соответствует высокая плотность упаковки.
Кристаллическая решетка каждого металла состоит из положительно заряженных ионов одинакового размера, расположенных в кристалле по принципу наиболее плотной упаковки шаров одинакового диаметра.
Различают три основных типа упаковки, или кристаллической решетки.
1. Объемноцентрированная кубическая решетка с координационным числом, равным 8 (натрий, калий, барий). Атомы металла расположены в вершинах куба, а один – в центре объема. Плотность упаковки шарообразными ионами в этом случае составляет 68 %.
2. Гранецентрированная кубическая решетка с координационным числом, равным 12 (алюминий, медь, серебро). Атомы металла расположены в вершинах куба и в центре каждой грани. Плотность упаковки – 74 %.
3. Гексагональная решетка с координационным числом 12 (магний, цинк, кадмий). Атомы металла расположены в вершинах и центре шестигранных оснований призмы, а еще три – в ее средней плоскости. Плотность упаковки – 74 %.
Из-за неодинаковой плотности атомов в различных направлениях кристалла наблюдаются разные свойства. Это явление, получившее название анизотропия, характерно для одиночных кристаллов – монокристаллов. Однако большинство металлов в обычных условиях имеют поликристаллическое строение, т. е. состоят из значительного числа кристаллов, или зерен, каждое из которых анизотропно. Разная ориентировка отдельных зерен приводит к усреднению свойств поликристаллического металла.
Особенности кристаллических решеток обусловливают характерные физические свойства металлов.
Металлы и их свойства
Определение 1
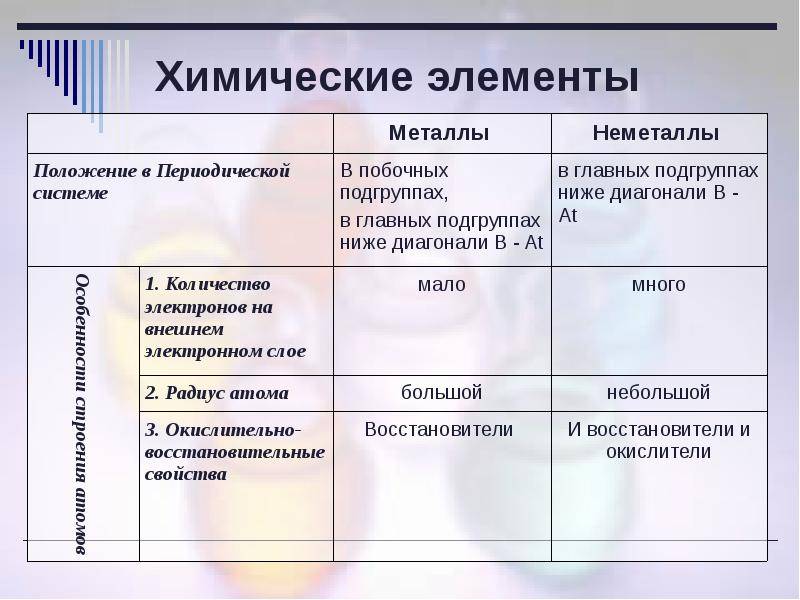
Металлами называют те элементы, которые отдают электроны с внешнего энергетического уровня.
 Рисунок 1. Расположение металлов в Периодической таблице Д. И. Менделеева. Автор24 — интернет-биржа студенческих работ
Рисунок 1. Расположение металлов в Периодической таблице Д. И. Менделеева. Автор24 — интернет-биржа студенческих работ
Металлы имеют небольшое количество электронов на внешнем уровне (от 1 до 3), поэтому им легче отдать данные электроны, чем заполнить до конца внешний энергетический уровень.
Получи помощь с рефератом от ИИ-шки
ИИ ответит за 2 минуты
Способность металлов отдавать электроны зависит от размера атомного радиуса, а также от электроотрицательности. Чем больше атомный радиус (расстояние от центра ядра), тем легче атому отдавать электроны. С увеличением электроотрицательности (способности атома оттягивать на себя электроны от другого атома) уменьшаются металлические (восстановительные, основные) свойства.
Замечание 1
В группе атомный радиус увеличивается, электроотрицательность уменьшается, в периоде – наоборот.
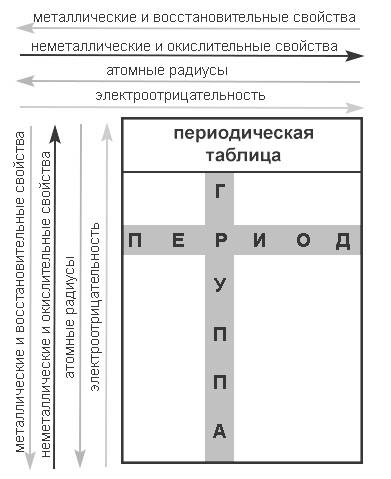 Рисунок 2. Свойства металлов. Автор24 — интернет-биржа студенческих работ
Рисунок 2. Свойства металлов. Автор24 — интернет-биржа студенческих работ
Для металлов характерны следующие свойства:
- твердые (исключение – ртуть, при нормальных условиях является жидкостью);
- образованы металлической связью;
- имеют металлический блеск;
- обладают высокой электро- и теплопроводимостью;
- ковкие, пластичные, тягучие.
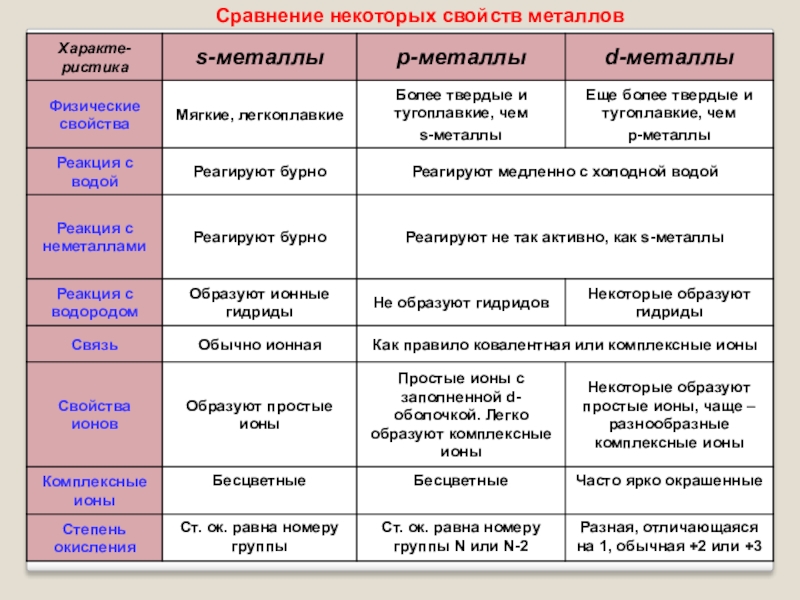
Существует классификация металлов. Выделяют: щелочные металлы (металлы IA группы – Li, Na, K, Rb, Cs, Fr), щелочноземельные (Be, Mg, Ca, Sr, Ba, Ra), переходные (представлены ниже), постпереходные металлы (Al, Ga, In, Sn, TI, Pb, Bi).
 Рисунок 3. Переходные металлы. Автор24 — интернет-биржа студенческих работ
Рисунок 3. Переходные металлы. Автор24 — интернет-биржа студенческих работ
Химические свойства металлов представлены в виде таблицы.
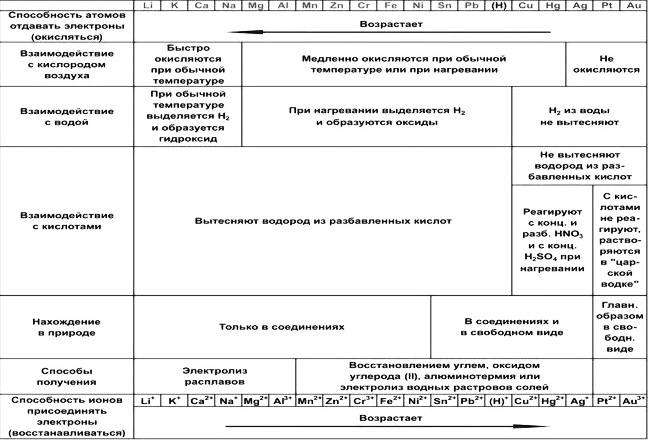 Рисунок 4. Химические свойства металлов. Автор24 — интернет-биржа студенческих работ
Рисунок 4. Химические свойства металлов. Автор24 — интернет-биржа студенческих работ
Применение металлов и неметаллов в промышленности и быту
Металлы и неметаллы широко применяются в промышленности и быту благодаря своим уникальным свойствам и характеристикам.
Металлы, такие как железо, алюминий и медь, являются важными материалами в строительстве и производстве механизмов. Они отличаются высокой прочностью, термостойкостью и электропроводностью. Железо используется для создания строительных конструкций, автомобилей, железнодорожных путей и других инфраструктурных объектов. Алюминий широко применяется в авиации, производстве упаковки и бытовой технике благодаря своей легкости и высокой коррозионной стойкости. Медь используется в электротехнике, в частности для создания проводов, из-за своей высокой электропроводности.
Неметаллы, такие как углерод, кремний и сера, также имеют широкий спектр применений. Углерод используется в производстве стали, пластмасс, резины и других материалов. Его применение обусловлено способностью образовывать жесткую и прочную структуру. Кремний используется в производстве полупроводников, стекла и керамики из-за своих полупроводниковых свойств. Он является ключевым элементом в электронике и солнечных батареях. Сера применяется в производстве противоракетных ракет, резиновых изделий и косметических товаров.
В быту металлы и неметаллы находят применение в различных предметах и изделиях. Металлические посуда, столовые приборы, мебель, дверные ручки и лампы часто изготавливаются из алюминия, стали или латуни. Некоторые неметаллические материалы, такие как стекло, пластик и резина, используются для изготовления посуды, упаковки и гигиенических товаров.
| Применение металлов | Применение неметаллов |
|---|---|
| Строительство | Производство пластмасс |
| Автомобильная промышленность | Производство стекла |
| Авиация | Производство резины |
| Электротехника | Производство керамики |
| Мебельное производство | Производство полупроводников |
Применение металлов и неметаллов в промышленности и быту является неотъемлемой частью современного общества. Благодаря их уникальным свойствам, мы можем создавать и использовать различные материалы и изделия, которые улучшают нашу жизнь и облегчают нашу работу.