Чем металлы отличаются от неметаллов по химическим свойствам?
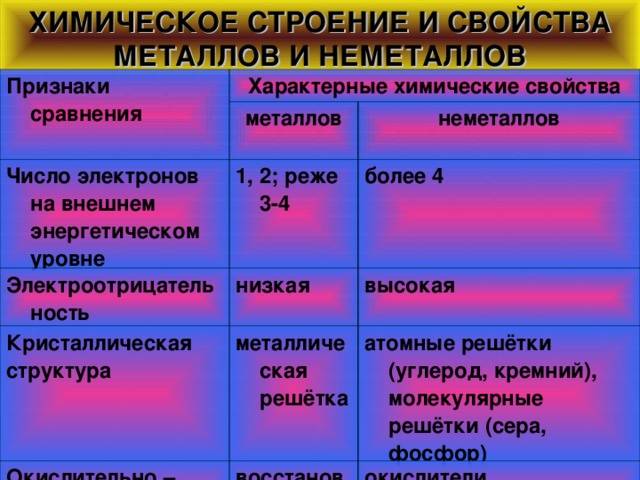
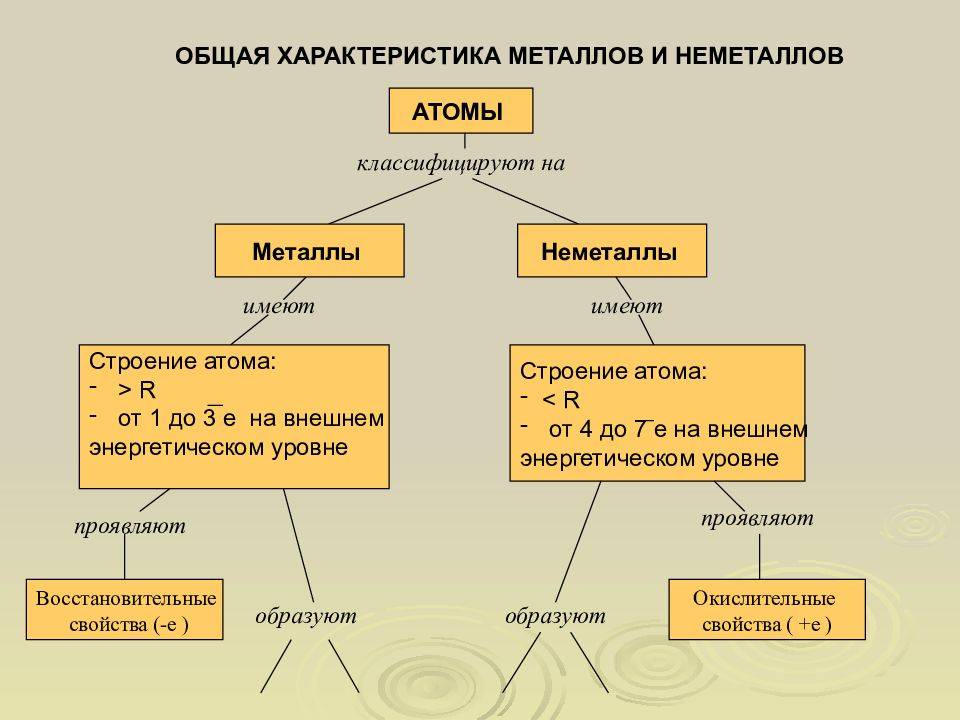
У элементов, представляющих разные группы, атомы вещества устроены по-разному. Металлы отличаются от неметаллов свойствами, основанными именно на этих различиях.
Внешняя орбита атома может нести до восемнадцати электронов. У металлов на ней обычно вращаются всего лишь от одной до трех (в редких случаях – четырех) частиц. Поэтому металлы легко окисляются и подвергаются коррозии.
Кроме того, их электроны могут легко оторваться от своего ядра и перейти в другие атомы. В химических реакциях металлы чаще всего проявляют восстановительные свойства, отдавая электроны соседним элементам.
У неметаллов внешние орбиты заполнены гораздо плотнее, поэтому они могут быть как восстановителями, так и окислителями. При вступлении в реакцию вещество, у которого электроны связаны сильнее (окислитель), забирает частицы у вещества с более слабой связью электронов (восстановитель).
Оксиды и гидроксиды типичных металлов представляют собой щелочи (основания). Исключение – амфотерные (переходные) металлы вроде алюминия, цинка, германия и др., соединения которых могут также обладать кислотными свойствами. Неметаллы же способны образовывать множество газообразных и жидких соединений (в основном, кислотных по свойствам).
Отличия металлов от неметаллов
Металлы обладают низкой электроотрицательностью, что делает их способными отдавать электроны и образовывать положительно заряженные ионы. Они обычно являются ковкими, тугоплавкими и хорошо проводящими тепло и электричество. Как правило, металлы имеют блестящую поверхность и образуют положительные ионы при образовании химических связей. Некоторые известные металлы включают железо, алюминий, медь и олово.
Неметаллы имеют высокую электроотрицательность и обычно принимают электроны, образуя отрицательно заряженные ионы. Они обычно хрупкие, непроводящие тепло и электричество и имеют меньшую плотность по сравнению с металлами. В отличие от металлов, неметаллы могут быть газообразными, жидкими или твердыми при комнатной температуре. К неметаллам относятся кислород, углерод, нитроген и хлор.
Важно отметить, что существуют элементы, которые обладают промежуточными свойствами между металлами и неметаллами, и называются полуметаллами или металлоидами. Они имеют свойства и характеристики как металлов, так и неметаллов
Проводимость электричества и тепла
Проводимость электричества у металлов основана на свободных электронах, которые могут передвигаться по кристаллической решетке металла. Это позволяет электронам свободно двигаться и нести электрический заряд. Неметаллы обычно не имеют подобной свободной электронной структуры, поэтому они не могут эффективно проводить электричество.
Теплопроводность в металлах также основана на свободных электронах. При повышении температуры электроны получают дополнительную энергию и начинают более активно двигаться. Это позволяет энергии быстро передаваться от одного электрона к другому, что способствует высокой теплопроводности металлов. В неметаллах теплопроводность обычно ниже, так как электроны могут быть связаны с атомами и иметь более ограниченные пути передвижения.
Наличие высокой проводимости электричества и тепла делает металлы важными материалами для различных технических применений, включая провода, электрические контакты и радиаторы. Неметаллы, обладающие низкой проводимостью, также находят свое применение в других отраслях, например, в изоляционных материалах и теплоизоляции.
Электроотрицательность
Металлы характеризуются низкой электроотрицательностью, что означает, что они имеют слабую способность притягивать электроны. Это объясняется строением электронной оболочки металлов, которая имеет малое количество электронов валентной оболочки и большое количество электронов внутренних оболочек. Из-за этого металлы легко отдают электроны и образуют положительные ионы.
Неметаллы, напротив, обладают высокой электроотрицательностью. У них большее количество электронов валентной оболочки и меньшее количество электронов внутренних оболочек. Неметаллы имеют сильную способность притягивать электроны, что позволяет им образовывать отрицательные ионы.
Электроотрицательность характеризуется числовыми значениями, которые указывают на относительную способность атома притягивать электроны. Существует шкала электроотрицательности, разработанная Линусом Полингом, где каждому элементу химического периодического стола присваивается определенное значение. Наиболее электроотрицательным элементом является флуор (F), а наименее электроотрицательным — франций (Fr).
Электроотрицательность важна для определения типа химической связи, образующейся между атомами. Если разность электроотрицательностей атомов превышает определенное значение, то образуется несимметричная химическая связь, называемая полярной ковалентной связью. В случае, когда разность электроотрицательностей невелика или отсутствует, связь называется неполярной ковалентной связью.
| Группа | Металлы | Неметаллы |
|---|---|---|
| 1 | Литий (Li) | Водород (H) |
| 2 | Бериллий (Be) | Бор (B) |
| 3 | Натрий (Na) | Углерод (C) |
| 4 | Магний (Mg) | Азот (N) |
| 5 | Алюминий (Al) | Кислород (O) |
| 6 | Цинк (Zn) | Фтор (F) |
| 7 | Железо (Fe) | Хлор (Cl) |
Элементы таблицы Менделеева
Существует также класс «металлоподобных» полупроводников с неопределенным состоянием. Благородные газы, не вступающие в реакции, находятся отдельно.
Часть элементов с номерами больше 100 были обнаружены сравнительно недавно, их принадлежность к какой-либо группе является лишь предположением.
Щелочные и щелочноземельные элементы
Представители групп 1 (IA) и 2 (IIA) таблицы Менделеева — металлы с плохой стабильностью и высокой степенью растворимости.
Щелочные металлы имеют серебристый блеск и легко ломаются и режут. Из всех помещенных на столе металлов они активнее других реагируют с молекулами других веществ, отдавая единственный свободный электрон. При контакте с водой образуются гидроксиды – щелочи:
2Na + 2H2O = 2NaOH + H2
Щелочноземельные металлы более твердые и тугоплавкие, с бледно-серым оттенком.
Большинство из них способны создавать щелочь, но их не так легко отделить от двух незанятых электронов. Они заменяют другие металлы, но бессильны против щелочных металлов и вытесняются ими из молекул.
Галогены и благородные газы
Галогены и благородные газы сгруппированы в группы 17 и 18 периодической таблицы. Галогены — неметаллические элементы, все они имеют семь электронов на внешней оболочке. В благородных газах все электроны находятся на внешней оболочке, поэтому практически не участвуют в образовании соединений. Эти газы называются «благородными», потому что они редко реагируют с другими элементами; то есть относится к членам благородной касты, которые традиционно избегали других людей в обществе.
| Галогены | Благородные газы |
| Фтор F 9 | Гелий он 2 |
| Хлор Cl 17 | Неон Неон 10 |
| Бром Бр 35 | Аргон Ар 18 |
| Йод I 53 | Криптон Кр 36 |
| Астатин в 85 лет | Ксенон Хе 54 |
| — | Радоновый р-н 86 |
Лантаниды (редкоземельные элементы) и актиниды
Лантаниды представляют собой группу элементов, изначально обнаруженных в редких минералах; отсюда и название «редкоземельные элементы». Впоследствии оказалось, что эти элементы не так редки, как считалось сначала, и поэтому редкоземельным элементам было дано название лантаноиды. Лантаниды и актиноиды занимают два блока, которые расположены ниже основной таблицы элементов. Обе группы включают металлы; все лантаноиды (кроме прометия) не радиоактивны; актиниды, с другой стороны, радиоактивны.
| Лантаноиды | Актиниды |
| Лантан Ла 57 | Актиний Ac 89 |
| Церий Се 58 | Торий Th 90 |
| Празеодим Пр 59 | Протактиний Па 91 |
| Неодим Nd 60 | Уран U 92 |
| Прометий Pm 61 | Нептуний Np 93 |
| Самарий См 62 | Плутоний Pu 94 |
| Европий Eu 63 | Америций Ам 95 |
| Гадолиний Бог 64 | Кюриум см 96 |
| Тербий Тб 65 | Берклиум Бк 97 |
| Диспрозий Dy 66 | Калифорния cf 98 |
| Гольмий Хо 67 | Эйнштейний 99 |
| Эрбий Er 68 | Ферми FM 100 |
| Тулий Тм 69 | Менделевий Мд 101 |
| Иттербий Yb 70 | Нобелий № 102 |
Неметаллы
Из всех элементов, отнесенных к неметаллам, водород принадлежит к первой группе таблицы Менделеева, а остальные к группам 13-18. Неметаллы не являются хорошими проводниками тепла и электричества. Обычно они находятся в газообразном (водород или кислород) или твердом (углерод) состоянии при комнатной температуре).
| Нет металлов |
| Водород H1 |
| C6 углерод |
| Азот №7 |
| Кислород О8 |
| Фосфор Р 15 |
| Сера S16 |
| Селен Se 34 |
| Флеровиум Фл 114 |
| Унунсептиус Уус 117 |
Металлоиды
Металлоиды занимают 13-16 группы периодической таблицы. Металлоиды, такие как бор, германий и кремний, являются полупроводниками и используются для изготовления компьютерных микросхем и печатных плат.
| Металлоиды |
| Бор B5 |
| Кремний Да 14 |
| Германий Ge 32 |
| Мышьяк As 33 |
| Сурьма Sb 51 |
| Теллур Те 52 |
| Полоний Ро 84 |
Переходные металлы
Переходные металлы занимают группы 3-12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (через которые они соединяются с другими элементами) находятся в нескольких электронных оболочках.
| Переходные металлы |
| Скандий Sc 21 |
| Титан Ти 22 |
| Ванадий V 23 |
| Хром Cr 24 |
| Марганец марганец 25 |
| Железо Fe 26 |
| Кобальт Co27 |
| Никель Ni 28 |
| Медь Cu29 |
| Цинк Zn 30 |
| Иттрий Y 39 |
| Цирконий Zr40 |
| Ниобий Nb 41 |
| Молибден Мо 42 |
| Технеций Tc 43 |
| Рутений Ru 44 |
| Родий Rh45 |
| Палладий Pd 46 |
| Серебро Ag 47 |
| Кадмий Cd 48 |
| Лютеций Лу 71 |
| Гафний Hf 72 |
| Тантал Та 73 |
| Вольфрам W74 |
| Рений Ре 75 |
| Осмий Ос 76 |
| Иридий Ир 77 |
| Платина, часть 78 |
| Au 79 Золото |
| Меркурий ртутного столба 80 |
| Лоуренсио Lr 103 |
| Резерфордий Rf 104 |
| Дубний Дб 105 |
| Сиборгиум Sg 106 |
| Бори Бх 107 |
| Хассиум Hs 108 |
| Мейтнериум гора 109 |
| Дармштадт Дс 110 |
| Рентген Рг 111 |
| Коперник Cn 112 |
Постпереходные металлы
Они тоже «легкие». Отличаются от переходных аналогов меньшей твердостью и весом. У них разные температуры плавления и кипения. Для соединений электроны отдаются только с внешней оболочки. По степени восстановления они превосходят полуметаллы. Легкий металл выглядит как вещество с матовым покрытием, а не блестящим.
Разница между металлами, неметаллами и металлоидами
Определение
Металлы: Металлы – это элементы с наивысшей степенью металлических свойств.
Неметаллы: Неметаллы – это элементы с меньшими металлическими свойствами или без них.
Металлоиды: Металлоиды – это элементы с низкой степенью металлического поведения.
Положение в Периодической таблице
Металлы: Металлы находятся в левой части периодической таблицы.
Неметаллы: Неметаллы находятся в правой части таблицы Менделеева.
Металлоиды: Металлоиды находятся в середине периодической таблицы.
Блок в периодической таблице
Металлы: Металлы расположены в блоках s, p, d и f.
Неметаллы: Неметаллы находятся в блоках s и p.
Металлоиды: Металлоиды находятся в блоке p.
Появление
Металлы: Металлы имеют блестящий вид.
Неметаллы: Неметаллы имеют тусклый вид.
Металлоиды: Металлоиды имеют тусклый или блестящий вид.
Пластичность и пластичность
Металлы: Металлы обладают пластичностью и пластичностью.
Неметаллы: Неметаллы не проявляют пластичности и пластичности.
Металлоиды: Металлоиды не проявляют пластичности и пластичности.
Тепловая и электрическая проводимость
Металлы: Тепловая и электрическая проводимость металлов очень высока.
Неметаллы: Тепловая и электрическая проводимость неметаллов очень низкая.
Металлоиды: У металлоидов хорошая теплопроводность и электрическая проводимость, но меньше, чем у металлов.
Электроотрицательность
Металлы: Металлы обладают очень низкой электроотрицательностью.
Неметаллы: Неметаллы обладают очень высокой электроотрицательностью.
Металлоиды: Металлоиды имеют промежуточное значение электроотрицательности.
Заключение
Металлы, неметаллы и металлоиды – это элементы, которые встречаются в земле. Большинство этих элементов используются в различных приложениях. Основное различие между металлами-неметаллами и металлоидами заключается в том, что металлы демонстрируют наивысшую степень металлического поведения, а неметаллы не проявляют металлического поведения, тогда как металлоиды показывают некоторую степень металлического поведения.
Использованная литература:
1. Гельменстин, доктор философии. Анна Мария. «Металлы, неметаллы и металлоиды – Таблица Менделеева». ThoughtCo. N.p., n.d. Интернет. Доступна здесь. 26 июня 2017. 2. Либретексты. «Металлы, неметаллы и металлоиды». Химия LibreTexts. Libretexts, 25 октября 2016 г. Web. Доступна здесь. 26 июня 2017 г. 3. Будро, Кевин А. «Металлы, неметаллы и металлоиды». Части Периодической таблицы. N.p., n.d. Интернет. Доступна здесь. 26 июня 2017.
Изображение предоставлено:
1. «2267674 ″ (общественное достояние) через Pixabay2. «Синтетический алмаз Аполлона» Стива Юрветсона – (CC BY 2.0) через Commons Wikimedia3. «National Semiconductor 8250A» Никсдорф – собственная работа (CC BY-SA 3.0) через Commons Wikimedia4. «Metalli, semimetalli, nonmetalli» Риккардо Ровинетти – собственная работа (CC BY-SA 3.0) через Commons Wikimedia
Свойства неметаллов
У них почти все наоборот:
- Ковать нельзя, потому что они хрупкие.
- Не обладают металлическим блеском.
- Не проводят электрический ток (за редким исключением – кремний и графит могут быть проводниками).
- Очень плохо проводят тепло.
- Есть твердые, газообразные, жидкие.
Неметаллов на данный момент 22.
Это первая статья по химии на нашем сайте. Напишите, что не так, что нравится и не нравится. Я буду думать, как сделать материал лучше.
И еще – есть идея записывать видеоролики с объяснениями. Лично вам удобнее разбираться в чем-то, читая текст, или просматривая видео?
Буду рад каждому вашему отзыву и комментарию.
Металлы в таблице Менделеева
В системе Менделеева сплавы имеют преобладающее число и список их весьма велик – они начинаются с Бора (В) и заканчиваются полонием (Po) (исключением являются германий (Ge) и сурьма (Sb)). У этой группы есть характерные признаки, они разделены на группы, но их свойства при этом неоднородны. Характерные их признаки:
- пластичность,
- электропроводимость,
- блеск,
- легкая отдача электронов,
- ковкость,
- теплопроводность,
- твердость (кроме ртути).
Из-за различной химической и физической сути свойства могут существенно отличаться у двух представителей этой группы, не все они похожи на типичные природные сплавы, к примеру, ртуть – это жидкая субстанция, но относится к данной группе.
В обычном своем состоянии она жидкая и без кристаллической решетки, которая играет ключевую роль в сплавах. Только химические характеристики роднят ртуть с данной группой элементов, несмотря на условность свойств этих органических соединений. То же самое касается и цезия – самого мягкого сплава, но он не может в природе существовать в чистом виде.
Некоторые элементы такого типа могут существовать только доли секунды, а некоторые не встречаются в природе совсем – их создали в искусственных условиях лаборатории. У каждой из групп металлов в системе есть свое название и признаки, которые отличают их от других групп.
При этом отличия у них весьма существенные. В периодической системе все металлы располагаются по количеству электронов в ядре, т.е. по увеличению атомной массы. При этом для них характерно периодическое изменение характерных свойств. Из-за этого в таблице они не размещаются аккуратно, а могут стоять неправильно.
В первой группе щелочей нет веществ, которые бы встречались в чистом виде в природе – они могут пребывать только в составе различных соединений.
Как отличить металл от неметалла?
Как определить металл в соединении? Существует простой способ определения, но для этого необходимо иметь линейку и таблицу Менделеева. Для определения надо:
- Провести условную линию по местам соединения элементов от Бора до Полония (можно до Астата).
- Все материалы, которые будут слева линии и в побочных подгруппах – металл.
- Вещества справа – другого типа.
Однако у способа есть изъян – он не включает в группу Германий и Сурьму и работает только в длинной таблице. Метод можно использовать в качестве шпаргалки, но чтобы точно определить вещество, следует запомнить список всех неметаллов. Сколько их всего? Мало – всего 22 вещества.
В любом случае, для определения природы вещества необходимо рассматривать его в отдельности. Легко будет элементы, если знать их свойства
Важно запомнить, что все металлы:
- При комнатной температуре – твердые, за исключением ртути. При этом они блестят и хорошо проводят электрический ток.
- У них на внешнем уровне ядра меньшее количество атомов.
- Состоят из кристаллической решетки (кроме ртути), а все другие элементы имеют молекулярную или ионную структуру.
- В периодической системе все неметаллы – красного цвета, металлы – черного и зеленого.
- Если двигаться слева направо в периоде, то заряд ядра вещества будет увеличиваться.
- У некоторых веществ свойства выражены слабо, но они все равно имеют характерные признаки. Такие элементы относятся к полуметаллам, например Полоний или Сурьма, они обычно располагаются на границе двух групп.
Важно запомнить, что при перемещении в таблице сверху вниз становятся сильнее неметаллические свойства веществ, поскольку там располагаются элементы, которые имеют отдаленные внешние оболочки. Их ядро отделено от электронов и поэтому они притягиваются слабее
Неметаллы
Неметаллы, за исключением водорода, расположены в правой части таблицы Менделеева. Неметаллическими элементами являются водород, углерод, азот, фосфор, кислород, сера, селен, все галогены и благородные газы.
Неметаллические физические свойства:
- Не блестящий (унылый вид)
- Плохие проводники тепла и электричества
- Твердые частицы
- Хрупкие твердые частицы
- Может быть твердым веществом, жидкостью или газом при комнатной температуре
- Прозрачный как тонкий лист
- Неметаллы не звучны
Неметаллические химические свойства:
- Обычно имеют 4-8 электронов в своей внешней оболочке
- Легко получить или поделиться валентных электронов
- Образуют кислые оксиды
- Имеют более высокую электроотрицательность
- Хорошие окислители
Как металлы, так и неметаллы принимают разные формы (аллотропы), которые отличаются друг от друга по внешнему виду и свойствам. Например, графит и алмаз являются двумя аллотропами неметаллического углерода, а феррит и аустенит – двумя аллотропами железа. Хотя неметаллы могут иметь аллотроп, который выглядит металлическим, все аллотропы металлов выглядят так, как мы думаем, как металл (блестящий, блестящий).
Различия в поведении металлов и неметаллов
Первое отличие заключается в их физических свойствах. Металлы отличаются высокой тепло- и электропроводностью, а также обладают глянцевым металлическим блеском. Неметаллы, напротив, являются плохими проводниками тепла и электричества, и обычно имеют матовую поверхность.
Также металлы и неметаллы проявляют разные химические свойства. Металлы обычно легко окисляются, т.е. вступают в реакцию с кислородом, влагой или другими веществами, формируя твердые оксиды. В то же время, неметаллы большинство не окисляются, и часто формируют газообразные оксиды. Они также активно вступают в реакции с металлами, образуя ионные соединения.
Еще одним отличием является степень металлической природы элемента. Металлы имеют характерные металлические свойства, такие как пластичность, тугоплавкость и эталонную кондуктивность, которые обусловлены их структурой. Неметаллы, напротив, обычно не обладают этими свойствами, хотя некоторые из них, например графит, могут проявлять некоторые металлические свойства в определенных условиях.
Кроме того, металлы и неметаллы имеют разное химическое поведение в реакциях. Металлы обычно образуют основания, ионы металлов обладают положительным зарядом. Неметаллы же, наоборот, образуют кислоты, и ионы неметаллов имеют отрицательный заряд.
В целом, различия в поведении металлов и неметаллов обусловлены их химическими и физическими свойствами, что делает их уникальными и несводимыми друг к другу. Эти различия обусловливают широкий спектр применения металлов и неметаллов в различных областях, от строительства и электротехники, до медицины и химической промышленности.
Реакция на воздействие тепла и электричества
Металлы имеют хорошую электропроводность и теплопроводность, что позволяет им эффективно справляться с воздействием тепла и электричества. Под воздействием высоких температур металлы обычно расширяются, а при низких температурах сжимаются. Это свойство металлов используется во многих технических приложениях, таких как производство двигателей, трубопроводов и котельного оборудования.
У неметаллов обычно намного худшая электропроводность и теплоизоляция. Неметаллы могут быть хрупкими и не выносить воздействие высоких температур, что делает их не подходящими для использования в высокотемпературных процессах. Однако некоторые неметаллы, такие как сера и фосфор, могут иметь различную структуру и свойства при разных температурах, что позволяет им использоваться в разных областях науки и промышленности.
При воздействии электрического тока металлы демонстрируют свойство проводить электричество. Это позволяет металлам использоваться в проводах и электрических цепях. Некоторые металлы, такие как алюминий и медь, обладают особыми свойствами, которые делают их идеальными для использования в электротехнике.
В отличие от металлов, неметаллы обычно не проводят электричество. Они обладают свойством изоляции, что делает их незаменимыми для использования в изоляционных материалах, например, в кабелях и проводах. Это свойство неметаллов также позволяет им использоваться в конденсаторах и полупроводниковых устройствах.
Устойчивость к коррозии и окислению
С другой стороны, неметаллы обычно не подвержены коррозии. Они могут быть стойкими к окислению и другим химическим реакциям благодаря сильным ковалентным связям и низкой реактивности. Некоторые неметаллы, такие как бор и фосфор, могут образовывать оксиды, но они обычно не обладают высокой степенью коррозии.
Таким образом, устойчивость к коррозии и окислению является важным свойством, которое разделяет металлы и неметаллы. Это свойство имеет большое значение при выборе материала для конкретного применения, такого как строительство, авиация или производство химических реактивов.
Металлоиды
Различие между металлами и неметаллами несколько размыто. Элементы, обладающие свойствами как металлов, так и неметаллов, называются полуметаллами или металлоидами. Ступенчатая линия грубо отделяет металлы от неметаллов в периодической таблице. Но химики признают, что называть один элемент «металлом», а другой рядом с ним «металлоидом» — это суждение. На самом деле большинство металлов проявляют свойства неметаллов при определенных условиях, а неметаллы в некоторых ситуациях ведут себя как металлы.
Водород — хороший пример элемента, который иногда действует как неметалл, а иногда как металл. При нормальных условиях водород представляет собой газ. Таким образом, он действует как неметалл. Но под высоким давлением он становится твердым металлом. Даже в виде газа водород часто образует катион +1 (свойство металла). Тем не менее, иногда он образует анион -1 (свойство неметалла).
Химические свойства металлов
Все металлы проявляют восстановительные свойства. Легкость в отдачи внешнего электрона применяется в фотоэлементах. Степень активности определяется рядом активности. У самых активных на внешнем уровне располагается по одному электрону.
Общие химические свойства металлов выражаются в реакциях со следующими соединениями.
С неметаллами
4 Li + O2→ 2 LiO2
3 Mg + N2 → Mg3N2
Активные металлы реагируют с галогенами и кислородом. С азотом взаимодействуют только литий, кальций и магний. Большинство металлов при взаимодействии с кислородом образуют оксиды, а наиболее активные металлы – пероксиды (N2O2).
С оксидами металлов
2 Ca + MnO2 → 2 CaO + Mn(нагревание)
С кислотами
Mg + H2SO4(разб)→MgSO4 + H2
Водород в кислотах вытесняют только те металлы, которые в ряду напряжений стоят до водорода.
С растворами солей
Fe + CuSO4→ Cu + FeSO4
Cu + 2 AgNO3→ 2 Ag + Cu(NO3)2
Более активные металлы вытесняют из соединений менее активные.
Химические свойства щелочных и щелочно-земельных металлов (реакции с водой)
2 Na + 2 H2O → 2 NaOH + H2
Ca + 2 H2O →Ca(OH)2 + H2
Периодическая таблица элементов
Периодическая таблица состоит из горизонтальных строк, называемых периодами, и вертикальных столбцов, называемых группами или семействами. Каждый элемент представлен своим символом, который является сокращением его латинского или английского названия. Атомный номер каждого элемента указывает на количество протонов в его ядре и определяет его положение в таблице.
Периодическая таблица разделяется на несколько блоков в зависимости от положения элементов. Самый большой блок – блок s – находится слева и включает группы 1 и 2, а также гелий в верхней части таблицы. Блок p находится справа от блока s и состоит из групп 13–18.
Блоки d и f находятся в середине таблицы. Блок d, также известный как блок переходных металлов, находится между блоками s и p и включает группы 3–12. Блок f, известный как блок лантаноидов и актиноидов, расположен ниже группы 3 и включает элементы из серии лантаноидов и актиноидов.
Периодическая таблица также включает разделение элементов на металлы, неметаллы и полуметаллы. Металлы обычно находятся слева от таблицы, неметаллы – справа, а полуметаллы занимают промежуточное положение между ними. Металлы обладают отличными электропроводными и теплопроводными свойствами, а неметаллы имеют скорее противоположные характеристики. Полуметаллы обладают свойствами, объединяющими как металлы, так и неметаллы. Носят также название металлоиды.
Периодическая таблица элементов является ключевым инструментом для понимания химической структуры и свойств различных соединений. Она позволяет легко анализировать и устанавливать закономерности в поведении различных элементов, а также предсказывать их реактивность и взаимодействия в химических реакциях.
Сокращения групп элементов в периодической таблице
Сокращение группы
Значение
S
Блок s – металлы щелочных и щелочноземельных металлов, а также гелий
P
Блок p – металлы неметаллов и инертные газы
D
Блок d – переходные металлы
F
Блок f – лантаноиды и актиноиды