Применение радиоактивных изотопов
Изотопы химических элементов представляют собой элементы периодической таблицы Менделеева, обладающие нестабильными ядрами и свойством подвергаться различного ядерному распаду. В научной терминологии подобные атомы называют также радионуклидами. Радиоактивные изотопы применяются в различных сферах человеческой деятельности.
В сельском хозяйстве использования радиоизотопов необходимо для изучения особенностей роста, развития и функционирования корневых систем растений (такой способ изучения получил название – метод меченных атомов).
В авиастроительстве радионуклиды применяют для испытания авиационных конструкций на предмет износостойкости.
В сфере градостроительстве радиоактивные изотопы нашли свое применение как универсальные измерители плотности почвы.
В области коммунального хозяйства видоизмененные химические элементы, обладающие радиоактивной способностью, применяют в целях стерилизации постельного белья.
В текстильной промышленности радионуклиды используются для удаления электрических зарядов с поверхности одежды.
В машиностроительной отрасли радионуклиды используются для определения толщины металлического покрытия.
Особое место в этом списке занимает использование радиоактивных изотопов в химической промышленности и в сфере медицинских услуг. Так, получение различных полимерных соединений, которые составляют основу большинства современных предметов обихода, письменных принадлежностей, резиновых изделий того или иногда вида использования происходит при помощи взаимодействия y-излучения с различными химическими соединениями органической природы. В медицине радиоизотопы применяются в лечебных целях в рамках радиационной терапии (процедура, при которой под воздействием радионуклидов происходит разрушение любого типа живой ткани). Радиотерапия нашла свое применения в области лечения онкологических заболеваний (на данный момент, по эффективности радиотерапия уступает только химиотерапии, но зачастую данные способы лечения составляют две стадии одного процесса).
Что такое изобары?
Изобары – это элементы, имеющие одинаковое количество атомных масс, но не имеющие одинакового количества протонов. Изобары имеют одинаковую структуру атома. Изобары не имеют одинаковое количество электронов. Они также имеют другую позицию в периодической таблице. У них разные периоды полураспада. Изобары имеют некоторые сходные свойства, такие как физические свойства. Но изобары имеют некоторые свойства, которые не являются такими же химическими свойствами. Изобары могут быть разделены через химические свойства. Изобары также имеют другую электронную конфигурацию в периодической таблице. Они также имеют разные скорости химических реакций. Изобары могут иметь или не иметь одинаковое число нейтронов. Количество электронов и нейтронов в изобарах различно. Изобары имеют элементы одного типа. Они имеют разные химические свойства, потому что химические свойства зависят от числа электронов, и мы знаем, что число электронов в изобарах различно. Физические свойства в изобарах одинаковы, поскольку физические свойства зависят от числа нуклонов и числа нейтронов, и мы знаем, что число нуклонов в изобарах одинаково. Таким образом, уникальное свойство различных химических свойств очень полезно при разделении изобар. Поскольку изотопы идентифицируются по массовому числу, те же изобары идентифицируются по числу протонов. Изобары также в природе и могут быть изготовлены искусственно. Поскольку они представляют собой различные виды химических элементов, они имеют различное положение в периодической таблице.
Применение изотопов
В детекторах дыма применяют нестабильные изотопы 241Am или 238Pu, которые характеризуются медленным распадом в сочетании с излучением. При появлении дыма происходит блокировка излучения, которое перестает достигать детектора, что вызывает тревогу. Благодаря способности излучения распада некоторых элементов к уничтожению микроорганизмов изотопы, в том числе 60Co, можно применять для консервирования пищевых продуктов. В медицинской диагностике некоторые ядра используют для обнаружения изменений в обследуемых органах, например в почках или сердце. Такой изотоп соединяется с биологически неактивным веществом известным путем в организме и вводит его в кровоток. Это позволяет отслеживать путь излучения и наблюдать его накопление в тканях и органах. Лучевая терапия, основанная на излучении нестабильных изотопов, таких как 226Ra и 60Co, также применяется при лечении опухолей. Целью такой терапии является уничтожение опухолевых клеток. Один из изотопов углерода, 14С, применяют для определения возраста материалов органического происхождения. Это нестабильное ядро медленно распадается, и в случае гибели организма, когда прекращается процесс ассимиляции углерода, концентрация в нем углерода-14 с течением лет пропорционально уменьшается. Некоторые изотопы, например 239Pu и 235U, применяют на атомных электростанциях. При распаде этих нестабильных ядер вырабатывается энергия, которая, в свою очередь, может быть преобразована в электричество.
Распад изотопов
Поскольку изотопы – это нестойкие образования, можно предположить, что они по прошествии времени всегда распадаются на более постоянные ядра химических элементов. Это утверждение верно, поскольку ученым не удалось обнаружить в природе огромного количества радиоактивных изотопов. Да и большинство из тех, которые были добыты в лабораториях, просуществовали от пары минут до нескольких дней, а потом снова превратились в обычные химические элементы.
Но есть в природе и такие изотопы, которые оказываются очень устойчивыми к распаду. Они могут существовать миллиарды лет. Образовались такие элементы в те далекие времена, когда земля еще формировалась, а на ее поверхности не было даже твердой коры.
Радиоактивные изотопы распадаются и вновь образуются очень быстро. Поэтому с той целью, чтобы облегчить оценку стойкости изотопа, учеными было принято решение рассматривать категорию периода его полураспада.
TheDifference.ru определил, что отличие изотопов друг от друга заключается в следующем:
Они обладают разным числом нейтронов.
Изотопы имеют разную массу атомов.
Значение массы атомов ионов влияет на их полную энергию и свойства.
Изотопы
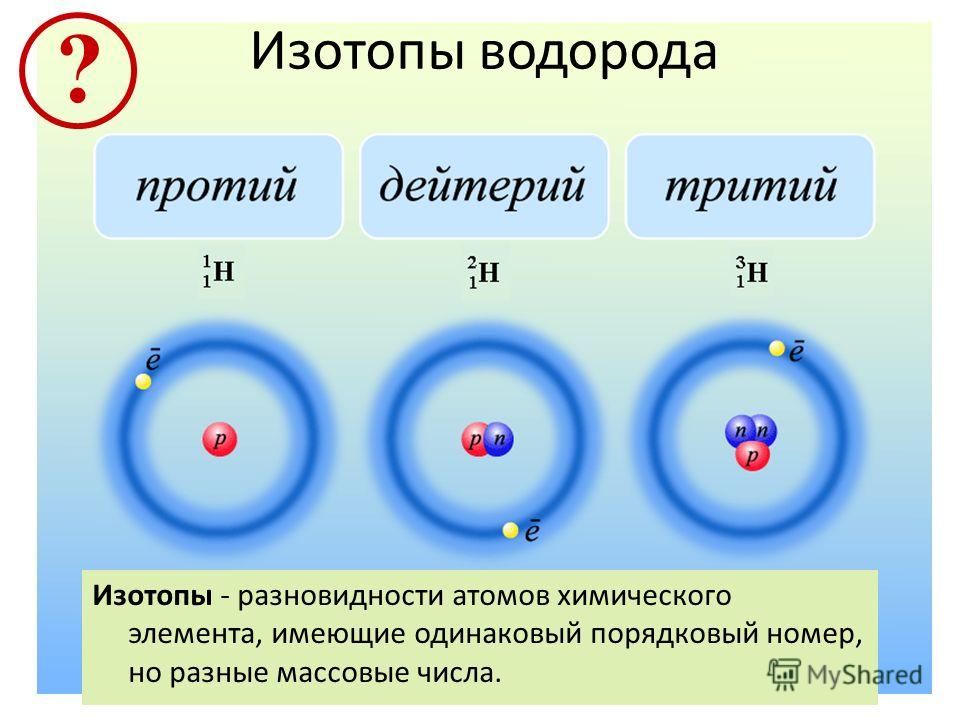
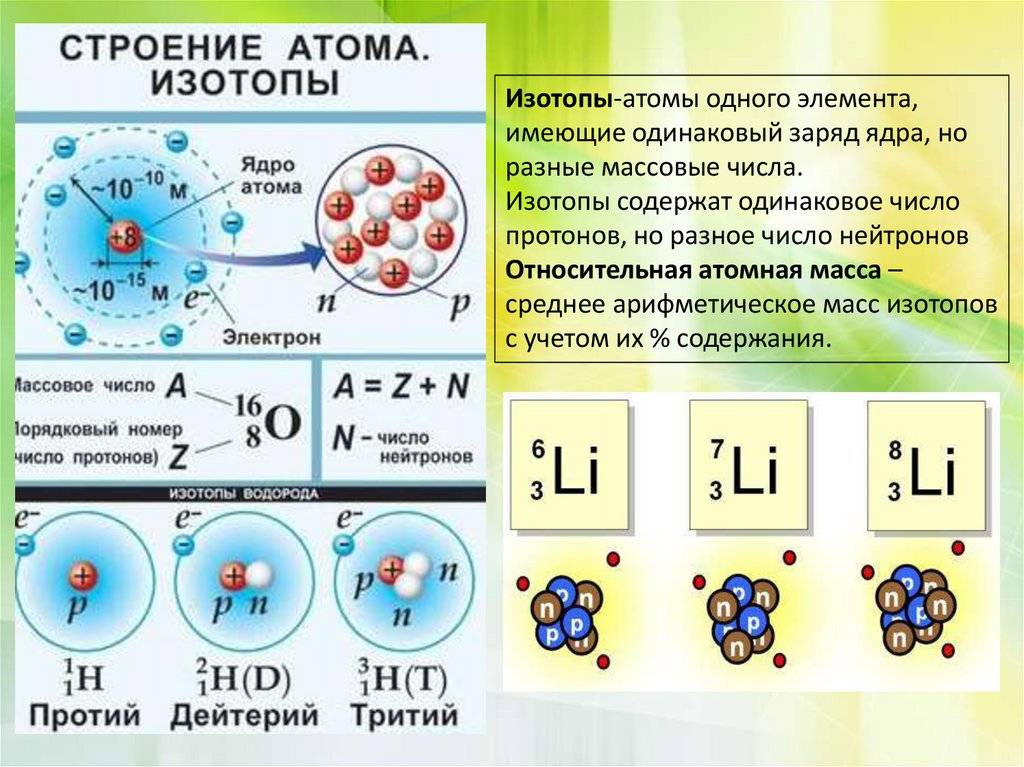
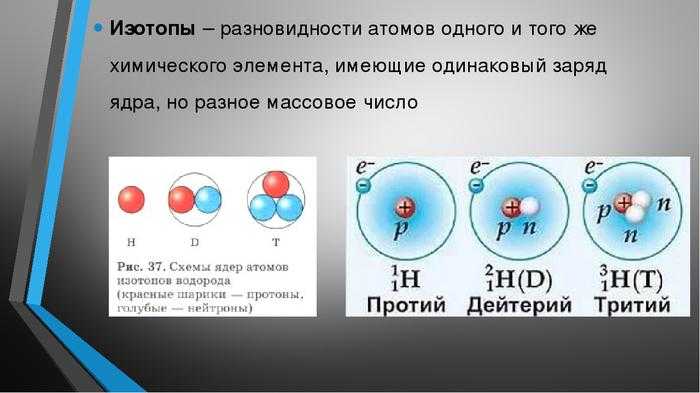
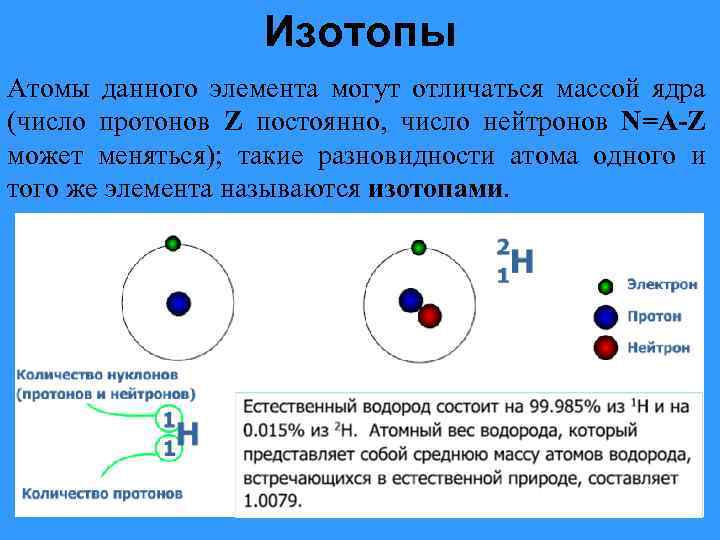
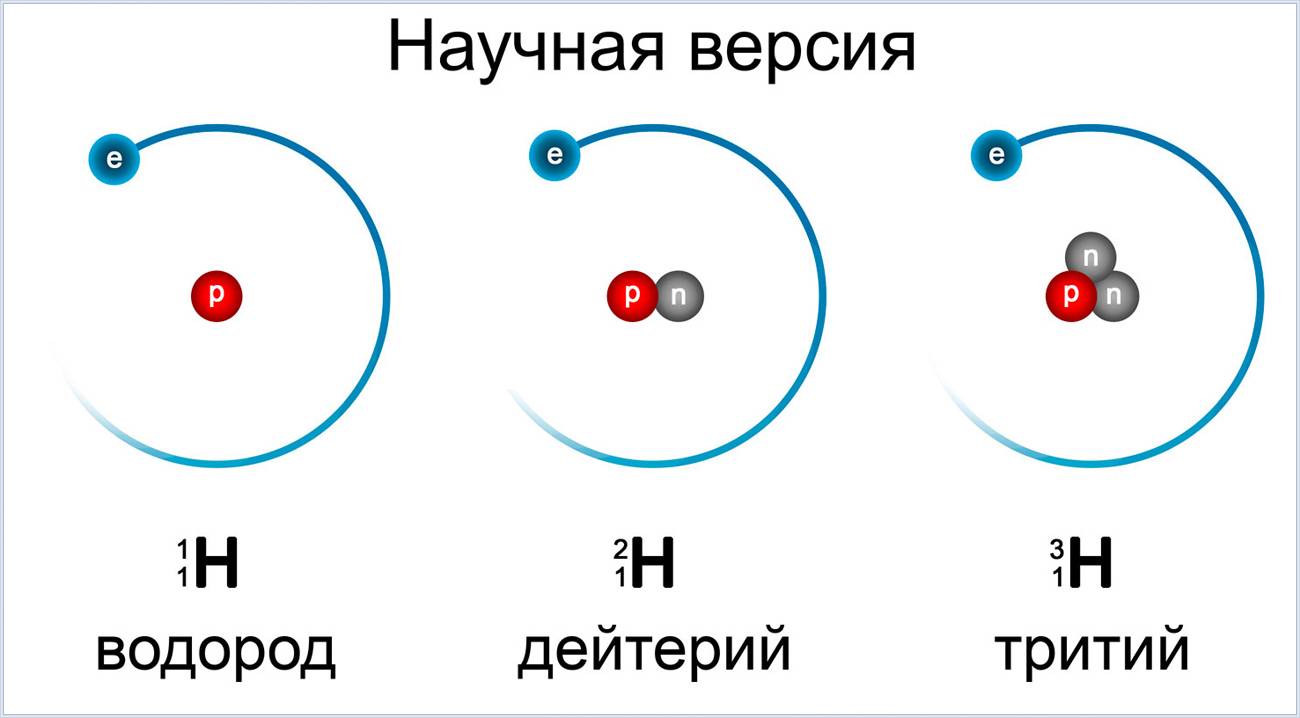
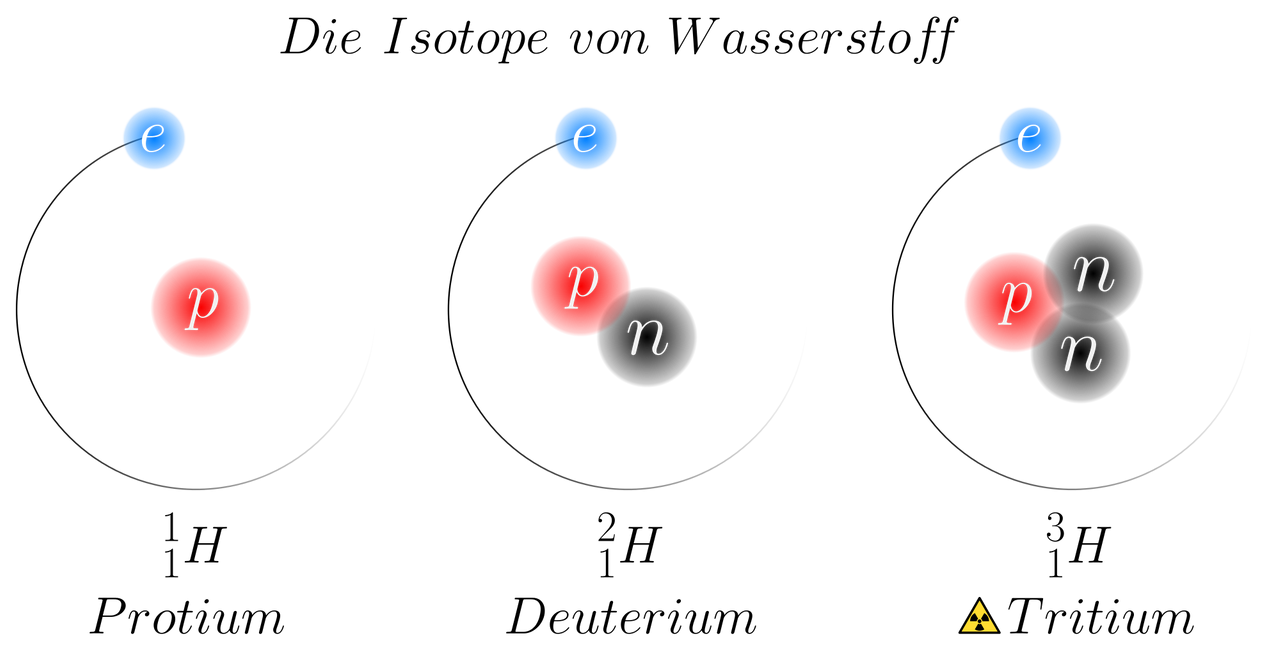
Атомы одного элемента, которые имеют разные массовые числа, называются изотопами. Атомы изотопов одного элемента имеют одинаковое число протонов (Z) и отличаются друг от друга числом нейтронов (N).
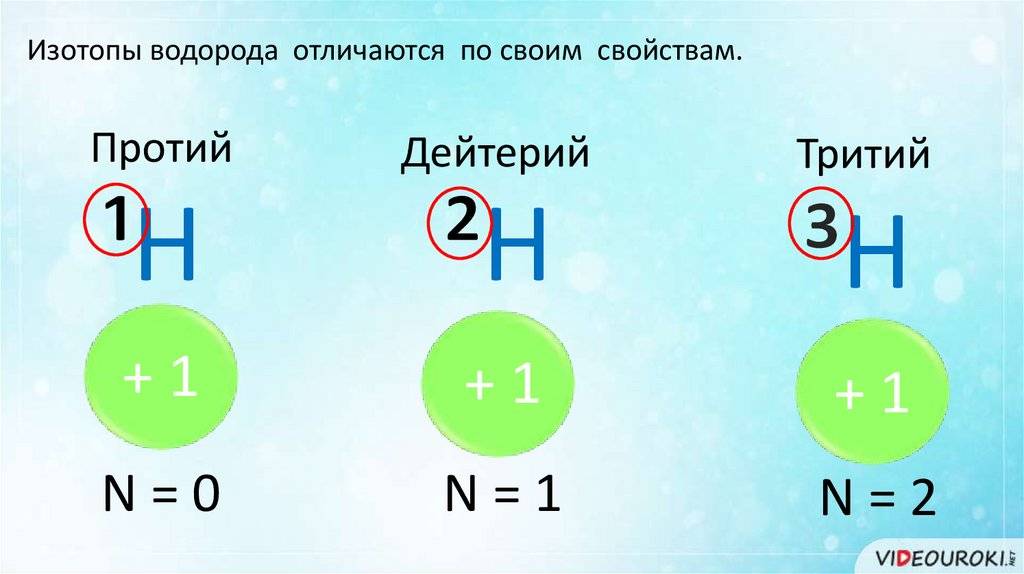
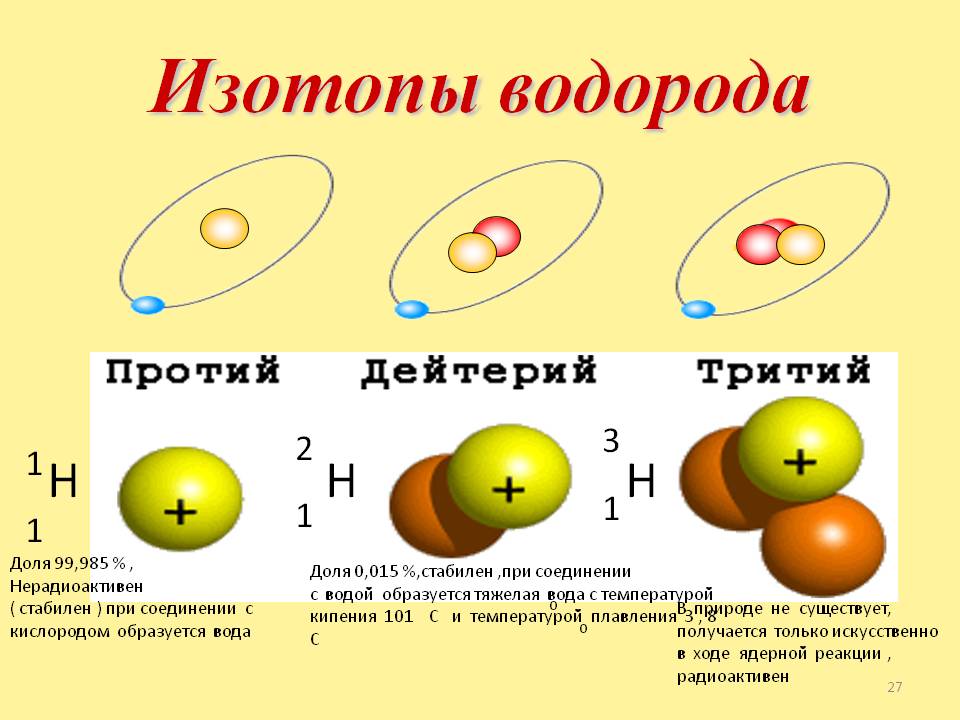
Изотопы различных элементов не имеют собственных названий, а повторяют название элемента; при этом атомная масса данного изотопа – его единственное отличие от других изотопов этого же элемента – отражается с помощью верхнего индекса в химической формуле элемента: например, для изотопов урана – 235 U, 238 U. Единственным исключением из правил номенклатуры изотопов является элемент № 1 – водород. Все три известных на настоящий момент изотопа водорода имеют не только собственные специальные химические символы, но и собственное название: 1 Н – протий, 2 D – дейтерий, 3 Т – тритий; при этом ядро протия – это просто один протон, ядро дейтерия содержит один протон и один нейтрон, ядро трития – один протон и два нейтрона. С названиями изотопов водорода так исторически сложилось потому, что относительное различие масс изотопов водорода, вызванное добавлением одного нейтрона, является максимальным среди всех химических элементов.
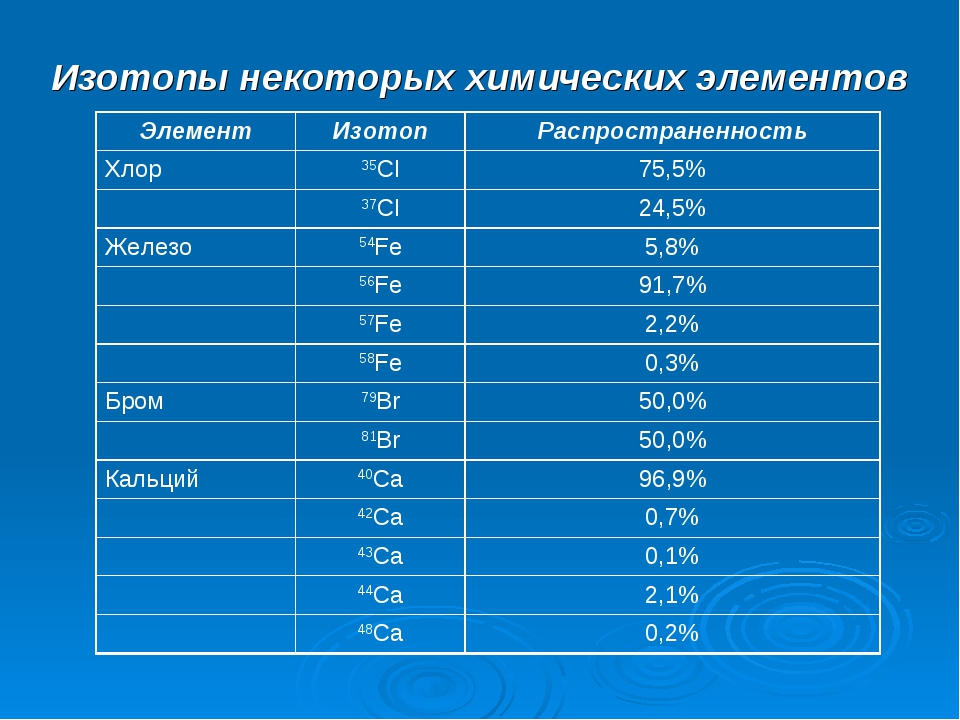
Все изотопы можно подразделить на стабильные (устойчивые), то есть не подверженные самопроизвольному распаду ядер атомов на части (распад в таком случае называется радиоактивным), и нестабильные (неустойчивые) – радиоактивные, то есть подверженные радиоактивному распаду. Большинство широко распространенных в природе элементов состоит из смеси двух или большего числа стабильных изотопов: например, 16 О, 12 С. Из всех элементов наибольшее число стабильных изотопов имеет олово (10 изотопов), а, например, алюминий существует в природе в виде только одного стабильного изотопа – остальные его известные изотопы неустойчивы. Ядра нестабильных изотопов самопроизвольно распадаются, выделяя при этом б-частицы и в-частицы (электроны) до тех пор, пока не образуется стабильный изотоп другого элемента: например, распад 238 U (радиоактивного урана) завершается образованием 206 Pb (стабильного изотопа свинца). При изучении изотопов установлено, что они не различаются по химическим свойствам, которые, как нам известно, определяются зарядом их ядер и не зависят от массы ядер.
Электронные оболочки
Электронная оболочка атома – область пространства вероятного местонахождения электронов, характеризующихся одинаковым значением главного квантового числа n и, как следствие, располагающихся на близких энергетических уровнях. Каждая электронная оболочка может иметь определенное максимальное число электронов.
Начиная со значения главного квантового числа n = 1, энергетические уровни (слои) обозначаются К, L, М и N. Они подразделяются на подуровни (подслои), отличающиеся друг от друга энергией связи с ядром. Число подуровней равно значению главного квантового числа, но не превышает четырех: 1-й уровень имеет один подуровень, 2-й – два, 3-й – три, 4-й – четыре подуровня. Подуровни, в свою очередь, состоят из орбиталей. Принято подуровни обозначать латинскими буквами, s – первый, ближайший к ядру подуровень каждого энергетического уровня; он состоит из одной s-орбитали, р – второй подуровень, состоит из трех р-орбиталей; d – третий подуровень, он состоит из пяти d-орбиталей; f – четвертый подуровень, содержит семь f-орбиталей. Таким образом, для каждого значения n имеется n 2 орбиталей. В каждой орбитали может находиться не более двух электронов – принцип Паули. Если в орбитали находится один электрон, то он называется неспаренным, если два – то это спаренные электроны. Принцип Паули поясняет формулу N=2n 2 . Если на первом уровне K(n=1) содержится 1 2 = 1 орбиталь, а в каждой орбитали по 2 электрона, то максимальное число электронов составит 2*1 2 =2; L (n = 2) =8; M (n = 3) =18; N (n = 4) =32.
Установлено, что каждый химический элемент, находящийся в природе – это смесь изотопов (отсюда у них дробные атомные массы). Чтобы понять, чем отличаются изотопы один от другого, необходимо детально рассмотреть строение атома. Атом образует ядро и электронное облако. На массу атома влияют электроны, движущиеся с ошеломительной скоростью по орбиталям в электронном облаке, нейтроны и протоны, входящие в состав ядра.
Сравнение атома и молекулы
В чем же разница между атомом и молекулой?
Атом является элементарной частицей вещества. Он имеет свою массу и размер и отвечает за свойства этого вещества, как химического элемента. Атом состоит из ядра и электронов, которые движутся по своим орбитам вокруг ядра. Именно строением атома обуславливаются химические свойства вещества. Атомы не встречаются в свободном состоянии. Они связываются друг с другом и образуют молекулы, благодаря электрическим зарядам частиц, из которых они состоят.
Молекула – это то, из чего состоит вещество. В состав молекул могут входить два и более атомов, которые между собой связаны межатомными связями. Более точно можно сказать так, что молекула состоит из атомных ядер и внутренних электронов, которые движутся по своим орбитам, а также внешних валентных электронов. В разных молекулах находится разное количество атомов определенного вида и разного количества. Молекула имеет сложную архитектурную постройку, где у каждого атома свое место и свои вполне определенные соседи. Свойства молекулы определяется тем, сколько в ней атомов. На эти свойства влияет порядок и конфигурация соединения атомов. Атомная постройка, которая образует молекулу, может быть жесткой, но не во всех случаях. Каждый атом находится в непрерывном движении, он колеблется около своего положения равновесия. При этом свободная молекула в процессе ее теплового движения имеет различные конфигурации. Молекула электрически является нейтральной частицей. Она является наименьшей частицей вещества, которая обладает его химическими свойствами. В случае одноатомных молекул таких, как инертные газы, свойства молекулы и атома совпадают. Атомы в молекуле объединены химическими связями. Такая связь может создаваться одной или несколькими парами электронов, которыми сообща владеют два атома. Молекула может существовать самостоятельно.
Чем атом отличается от молекулы
Атомы образуют молекулу. В состав атома входят ядро и электроны, которые движутся по своим орбитам вокруг ядра.
Молекулы состоят из атомов.
Атом имеет электрический заряд, а молекула нейтральна.
Только молекула может существовать самостоятельно.
Установлено, что каждый химический элемент, находящийся в природе – это смесь изотопов (отсюда у них дробные атомные массы). Чтобы понять, чем отличаются изотопы один от другого, необходимо детально рассмотреть строение атома. Атом образует ядро и электронное облако. На массу атома влияют электроны, движущиеся с ошеломительной скоростью по орбиталям в электронном облаке, нейтроны и протоны, входящие в состав ядра.
Что такое изотопы
Изотопы
– это разновидность атомов какого-либо химического элемента. Электронов и протонов в любом атоме всегда равное количество.
Поскольку они обладают противоположными зарядами (электроны – отрицательным, а протоны – положительным), атом всегда нейтрален (эта элементарная частица не несет заряда, он равен у нее нулю). При потере или захвате электрона атом теряет нейтральность, становясь либо отрицательным, либо положительным ионом.
Нейтроны не имеют заряда, зато их количество в атомном ядре одного и того же элемента может быть разным. Это никак не сказывается на нейтральности атома, однако влияет на его массу и свойства.
Например, в любом изотопе атома водорода есть по одному электрону и протону. А количество нейтронов разное. В протии имеется всего лишь 1 нейтрон, в дейтерии – 2 нейтрона и в тритии – 3 нейтрона. Эти три изотопа заметно отличаются друг от друга по свойствам.
Атомы различных элементов
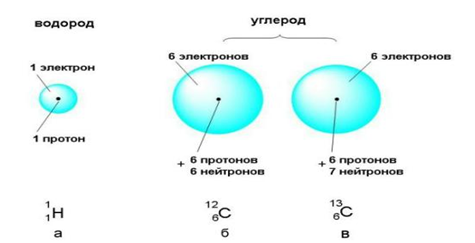
Атомы различных элементов отличаются друг от друга количеством протонов в ядре. Количество электронов может меняться, а протонов – никогда. Сколько протонов содержится в ядре, можно узнать по порядковому номеру элемента в периодической системе Менделеева. У водорода (№1) в состоянии покоя 1 электрон и 1 протон, у лития (№3) – 3 электрона и 3 протона, у углерода (№6) – 6 электронов и 6 протонов.
Поскольку количество протонов у различных атомов разное, массы у них тоже отличаются. Масса элемента в основном формируется протонами и нейтронами, ведь вес электронов ничтожно мал. Но даже у атомов одного и того же элемента вес может отличаться из-за разного количества нейтронов в ядре. Атомы, у которых количество нейтронов отличается от количества протонов, называют изотопами. Например, в природе существуют атомы углерода С12 (6 протонов и 6 нейтронов), С13 (6 протонов и 7 нейтронов) и другие разновидности с содержанием нейтронов от 2 до 16.
Чем отличаются понятия “атом” и “молекула”? и получил лучший ответ
Ответ от Sunriseатом меньше, в одной молекуле может быть несколько атомов (пример – 2 атома водорода и один атом кислорода= молекула воды)
Ответ от Диана Мамина
Молекула состоит из атомов.
Ответ от НЕТ
Кроме общих мест, ещё и родом.
Ответ от Воздушная
атом, это электронейтральная система взаимодействубщих элементов, состоящая из ядра и электронов. , а молекула – это соединение, состоящее из 2х или более атомов
Ответ от Durchlaucht Furst
А́том (др. -греч. ἄτομος – неделимый) – наименьшая часть химического элемента, являющаяся носителем его свойств. Атом состоит из атомного ядра и окружающего его электронного облака. Ядро атома состоит из положительно заряженных протонов и электрически нейтральных нейтронов, а окружающее его облако состоит из отрицательно заряженных электронов. Если число протонов в ядре совпадает с числом электронов, то атом в целом оказывается электрически нейтральным. В противном случае он обладает некоторым положительным или отрицательным зарядом и называется ионом. Атомы классифицируются по количеству протонов и нейтронов в ядре: количество протонов определяет принадлежность атома некоторому химическому элементу, а число нейтронов – изотопу этого элемента.Атомы различного вида в различных количествах, связанные межатомными связями, образуют молекулы.Понятие об атоме как о наименьшей неделимой части материи было впервые сформулировано древнеиндийскими и древнегреческими философами (см. : атомизм). В XVII и XVIII веках химикам удалось экспериментально подтвердить эту идею, показав, что некоторые вещества не могут быть подвергнуты дальнейшему расщеплению на составляющие элементы с помощью химических методов. Однако в конце XIX – начале XX века физиками были открыты субатомные частицы и составная структура атома, и стало ясно, что атом в действительности не является «неделимым».Моле́кула (новолатинское molecula, уменьшительное от лат. moles – масса) – наименьшая частица вещества, несущая его химические свойства.Молекула состоит из двух или более атомов, характеризуется количеством входящих в неё атомных ядер и электронов, а также определённой структурой.Обычно подразумевается, что молекулы нейтральны (не несут электрических зарядов) и не несут неспаренных электронов (все валентности насыщены) ; заряженные молекулы называют ионами, молекулы с мультиплетностью, отличной от единицы (т. е. с неспаренными электронами и ненасыщенными валентностями) – радикалами.Молекулы, образованные сотнями или тысячами атомов, называются макромолекулами. Особенности строения молекул определяют физические свойства вещества, состоящего из этих молекул.
Ответ от Мариям Абдулла
еще у атомов электрический заряд, тогда как молекула нейтральна
Ответ от Мурват Казымов
атом это то из чего состоит молекула
Атом и ион – элементарные частицы химических элементов. Эти частицы являются носителями свойств элементов. Отличаются они зарядами: атом нейтрален, а ион бывает положительно или отрицательно заряженным.
Дефект массы и энергия связи ядра

Затронув тему изотопов, нельзя пройти мимо феномена дефект массы ядра. Когда из отдельных нуклонов образуется атомное ядро, часть их массы превращается в энергию. Другими словами, вот взяли вы щепотку протонов и нейтронов, хорошенько их смяли вместе, и получили ядро, но его масса будет меньше массы исходных компонентов. Это и есть дефект масс. Формула для расчета дефекта массы ядра:
∆m=(Zmp+Nmn)-Mя
где Mя– масса ядра, Z – число протонов в ядре, N – число нейтронов в ядре, mp– масса протона, mn– масса нейтрона.
Если к атому подвести энергию (которая эквивалентна дефекту масс), то можно разделить его ядро обратно на нуклоны. Эта энергия носит название энергия связи ядра. Формула для расчета энергии связи ядра:
∆Eсв=∆mc2
где с — скорость света, ∆m — дефект массы ядра
Проверьте себя, как вы усвоили понятия дефект массы и энергия связи ядра, самостоятельно решив задачу пользуясь формулами выше.
Пример 2. Если образовать атом углерода-12 из субатомных частиц, какое значение будет иметь дефект масс?
Показать
Ответ: 0,0990 а.е.м.
Теперь нам известно, что каждый изотоп элемента характеризуется порядковым номером (суммарным числом протонов), массовым числом (суммарным числом протонов и нейтронов) и атомной массой (массой атома, выраженной в атомных единицах массы). Поскольку дефект массы при образовании атома очень мал, массовое число обычно совпадает с атомной массой изотопа, округленной до ближайшего целого числа. (Например, атомная масса хлора-37 равна 36,966, что после округления дает 37.) Если в природе встречается несколько изотопов одного элемента, то экспериментально наблюдаемая атомная масса (естественная атомная масса) равна средневзвешенному значению атомных масс отдельных изотопов. Это средневзвешенное значение определяется соответственно относительному содержанию изотопов в природе. Хлор существует в природе в виде смеси из 75,53% хлора-35 (атомная масса 34,97 а.е.м.) и 24,47% хлора-37 (36,97 а.е.м.), поэтому средневзвешенное значение масс этих изотопов равно
(0,7553·34,97 а.е.м.) + (0,2447·36,97 а.е.м.) = 35,46 а.е.м.
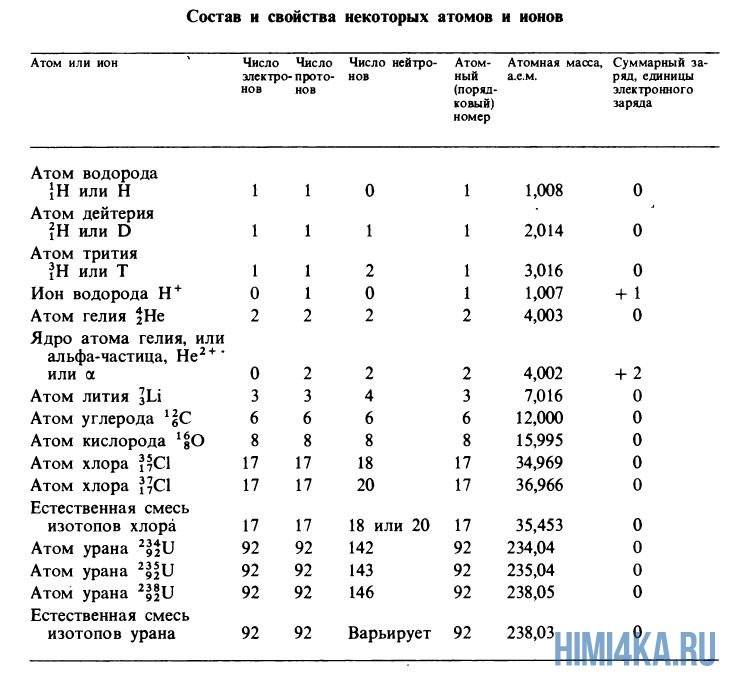
Атомные массы, указанные в таблице Менделеева представляют собой во всех случаях средневзвешенные значения атомных масс изотопов, встречающихся в природе, и именно этими значениями мы будем пользоваться в дальнейшем, за исключением тех случаев, когда будет обсуждаться какой-нибудь конкретный изотоп. Все изотопы одного элемента в химическом отношении ведут себя практически одинаково. На рисунке ниже изображены состав и свойства некоторые атомов, ионов и изотопов элементов.
Пример 3. Магний (Mg) в основном состоит из трех естественных изотопов: 78,70% всех атомов магния имеют атомную массу 23,985 а.е.м., 10,13% — 24,986 а.е.м. и 11,17% — 25,983 а.е.м. Сколько протонов и нейтронов содержится в каждом из этих трех изотопов? Чему равно средневзвешенное значение их атомных масс?
Решение: Все изотопы магния содержат по 12 протонов. Изотоп с атомной массой 23,985 а.е.м. имеет массовое число 24 (суммарное число протонов и нейтронов), следовательно, он имеет 24 — 12 = 12 нейтронов. Символ этого изотопа 24Mg. Аналогично находим, что изотоп с атомным весом 24,986 а.е.м. имеет массовое число 25, содержит 13 нейтронов и имеет символ 25Mg. Третий изотоп (25,983 а.е.м.) имеет массовое число 26, содержит 14 нейтронов и имеет символ 26Mg. Средняя атомная масса магния находится следующим образом:
(0,7870·23,985 а.е.м.) + (0,1013·24,986 а.е.м.) + (0,1117·25,983 а.е.м.) = 24,31 а.е.м.
Надеюсь урок 2 «Изотопы элементов» помог вам понять что из себя представляют изотопы. Если у вас возникли вопросы, пишите их в комментарии.
Атомы различных элементов
Атомы различных элементов отличаются друг от друга количеством протонов в ядре. Количество электронов может меняться, а протонов – никогда. Сколько протонов содержится в ядре, можно узнать по порядковому номеру элемента в периодической системе Менделеева. У водорода (№1) в состоянии покоя 1 электрон и 1 протон, у лития (№3) – 3 электрона и 3 протона, у углерода (№6) – 6 электронов и 6 протонов.
Поскольку количество протонов у различных атомов разное, массы у них тоже отличаются. Масса элемента в основном формируется протонами и нейтронами, ведь вес электронов ничтожно мал. Но даже у атомов одного и того же элемента вес может отличаться из-за разного количества нейтронов в ядре. Атомы, у которых количество нейтронов отличается от количества протонов, называют изотопами. Например, в природе существуют атомы углерода С12 (6 протонов и 6 нейтронов), С13 (6 протонов и 7 нейтронов) и другие разновидности с содержанием нейтронов от 2 до 16.
Еще много веков назад люди догадывались, что любое вещество на земле состоит из микроскопических частиц. Прошло какое-то время, и ученые доказали, что эти частицы действительно существуют. Их назвали атомами. Обычно атомы не могут существовать отдельно и объединяются в группы. Эти группы и называются молекулами.
Само название “молекула” происходит от латинского слова moles, означающего тяжесть, глыбу, громаду, и уменьшительного суффикса – cula. Раньше вместо этого термина употреблялось слово «корпускула», дословно означающее «маленькое тело». Для того чтобы выяснить, что такое молекула, обратимся к толковым словарям. В словаре Ушакова говорится, что это мельчайшая частица, которая может существовать автономно и обладает всеми свойствами вещества, к которому она относится. Молекулы и атомы окружают нас повсюду, и хоть их нельзя пощупать, все, что мы видим, на самом деле – это их гигантские скопления.
Пример с водой
Лучше всего объяснить, что такое молекула, можно на примере стакана с водой. Если отлить из него половину, то вкус, цвет и состав оставшейся воды не изменится. Было бы странно ожидать чего-то другого. Если снова отлить половину, количество уменьшится, но свойства опять останутся теми же. Продолжая в том же духе, мы в итоге получим маленькую капельку. Ее еще можно поделить пипеткой, но до бесконечности продолжать этот процесс не получится.
В конечном счете получится мельчайшая частица, остаток от деления которой водой уже не будет. Для того чтобы представить себе, что такое молекула и насколько она мала, попробуйте угадать, сколько молекул находится в одной капельке воды. Как вы думаете? Миллиард? Сто миллиардов? На самом деле их там примерно сто секстильонов. Это число, у которого после единицы идет двадцать три нуля. Такую величину сложно себе представить, поэтому воспользуемся сравнением: размер одной меньше крупного яблока во столько раз, во сколько само яблоко меньше Поэтому ее нельзя увидеть даже в самый мощный оптический микроскоп.
и атомов
Как мы уже знаем, все микроскопические частицы в свою очередь состоят из атомов. В зависимости от их количества, орбит центральных атомов и типа связей геометрическая форма молекул может быть различной. К примеру, человеческая ДНК закручена в форме спирали, а мельчайшая частица обычной поваренной соли имеет вид Если у молекулы каким-то образом забрать несколько атомов, произойдет ее разрушение. При этом последние никуда не денутся, а войдут в состав другой микрочастицы.
После того как мы разобрались, что такое молекула, перейдем к атому. Его структура очень напоминает планетарную систему: в центре находится ядро с нейтронами и положительно заряженными протонами, а вокруг на разных орбитах вращаются электроны. В целом атом электронейтрален. Другими словами, число электронов равно числу протонов.
Надеемся, наша статья оказалась полезной, и теперь у вас больше нет вопросов о том, что такое молекула и атом, как они устроены и чем отличаются.
Вывод
Атомы состоят из отрицательно заряженных электронов, окружающих ядра во всем веществе. Протоны и нейтроны создают ядро, а электромагнитные силы связывают электроны вместе. Слово ион относится к атому, который заряжен либо отрицательно, либо положительно, в то время как изотопы элемента представляют собой различные варианты его атомов. Несмотря на то, что они связаны с атомами внутри элемента, ионы и изотопы сильно различаются во многих отношениях.
Слово «ион» относится к атому, который заряжен либо отрицательно, либо положительно, и это слово произошло от греческого слова «iov», означающего «идущий». Избыточное или недостаточное количество электронов заставляет ядро испускать электрический заряд, поскольку общее количество протонов в атоме не равно общему количеству электронов. Обычно они встречаются в природе и находятся в твердом, жидком и газообразном состоянии.
Слово изотоп элемента относится к различным вариантам атомов, и это слово произошло от греческих слов «isos» и «topos», означающих «в одном месте». Число протонов во всех атомах конкретного элемента одинаково, но количество нейтронов может отличаться. Из-за этого у элемента есть несколько изотопов, которые имеют схожие химические свойства и поведение.
Основное различие между ионами и изотопами состоит в том, что они относятся к разным категориям.