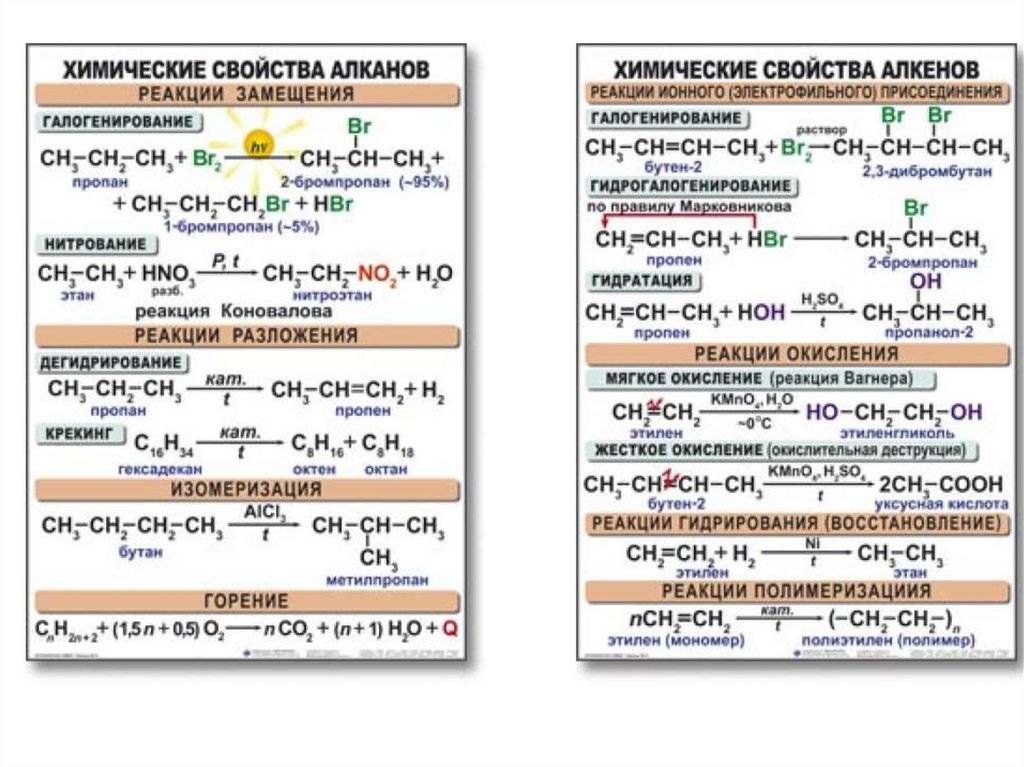
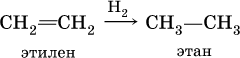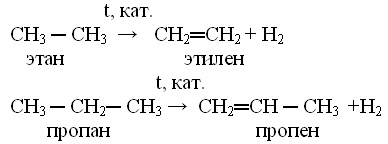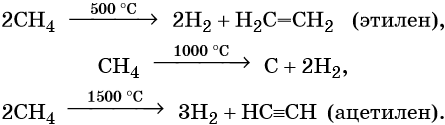Метод 2: Реакция с бромной водой
Итак, чтобы выполнить реакцию с бромной водой, нужно просто добавить немного этана или этилена к раствору бромной воды. Если реакция происходит, то бром добавляется к молекуле углеводорода. Однако, есть небольшое отличие в реакции между этиленом и этаном.
Для этана реакция с бромной водой не происходит, поэтому раствор остается без изменений. В то же время, этилен быстро реагирует со бромом, что приводит к образованию бромэтилена. Окрашивание раствора в желтый или красно-коричневый цвет указывает на наличие этена.
Таким образом, проведение реакции с бромной водой дает нам возможность легко различить этилен от этана.
Этилен и этан: отличие и характерные свойства
Этилен (C2H4) — это газ, состоящий из двух атомов углерода и четырех атомов водорода. Он является простым алкеном и обладает двойной связью между атомами углерода.
Этилен является безцветным газом с характерным запахом. Он легче воздуха и поддерживает горение. Этилен используется в различных промышленных процессах, включая производство пластиков, резиновых изделий и синтетических волокон.
Характерные свойства этилена:
- Газообразное состояние при обычных условиях
- Низкая плотность
- Легко воспламеняется
- Растворим в некоторых органических растворителях
- Используется в качестве высокоактивного реагента
Этан (C2H6) — это газ, состоящий из двух атомов углерода и шести атомов водорода. Он является простым алканом и не имеет двойных связей между атомами углерода.
Этан является безцветным газом без запаха. Он тяжелее воздуха и не поддерживает горение. Этан широко используется в качестве источника энергии, особенно в газовом виде.
Характерные свойства этана:
- Газообразное или сжиженное состояние при обычных условиях
- Высокая плотность
- Не воспламеняется при обычных условиях
- Не растворим в воде
- Используется в качестве источника тепла и энергии
Этилен и этан различаются молекулярной структурой, физическими свойствами и применением. Понимание этих различий позволяет правильно использовать эти вещества в различных отраслях промышленности и науки.
Использование в промышленности
Для отличия этилена от этана в промышленности существует несколько способов, включающих использование различных процессов и инструментов.
Один из таких способов — масс-спектрометрия, она позволяет определить различительность между этаном и этиленом. При данном анализе осуществляется разделение компонентов газа при помощи магнитного поля. Создавая специфический спектр масс на основе их молекулярной массы, можно определить, присутствует ли среди данных компонентов этан или этилен.
Также для определения наличия этилена или этана применяется газохроматография. В данной процедуре газовая смесь разделяется на ее составляющие посредством прохождения через столбец с различными материалами. Затем компоненты анализируются, основываясь на их уникальном спектре поглощения. Этот метод физического разделения и определения служит эффективным способом различения этана и этилена.
Еще одним способом определения различия между этаном и этиленом является хроматографическое окисление. Данный метод основан на разделении компонентов смеси, проходящих через столбец, и использовании окислительных свойств этана и этилена. Окисление этилена приводит к образованию этанилкарбоновой кислоты, тогда как этан не окисляется до этого состояния. Изменение сигнала после окисления используется для определения наличия и количества этилена или этана в газовой смеси.
Производство пластмасс
Одним из основных способов производства пластмасс является полимеризация мономеров. Окисление этилена является одним из способов получения мономеров для производства пластмасс. В процессе окисления этилена происходит разрушение двойной связи между атомами углерода, образуя атомы углерода с одинарными связями. Этот процесс приводит к образованию мономеров, таких как этиленокислота, которые далее используются для полимеризации и получения пластмасс.
Для отличия этилена от этана в процессе производства пластмасс используются различные методы анализа. Один из таких методов — масс-спектрометрия. Масс-спектрометрия позволяет определить молекулярную массу вещества, что позволяет установить различительность этилена и этана.
Еще одним методом анализа является газохроматография, которая основана на разделении различных компонентов смеси по их различным свойствам и окисляемости. Этот метод позволяет определить содержание этилена и этана в образце.
Также можно использовать спектральный анализ, основанный на изучении спектров этилена и этана. В процессе колебаний атомов углерода могут происходить специфические изменения, которые можно обнаружить и использовать для определения этилена и этана.
| Метод анализа | Описание |
|---|---|
| Масс-спектрометрия | Определение молекулярной массы вещества |
| Газохроматография | Разделение компонентов смеси по их свойствам |
| Спектральный анализ | Изучение спектров вещества |
В результате использования данных методов анализа можно точно отличить этилен от этана в процессе производства пластмасс и гарантировать качество производимой продукции.
Производство этилена для полимеров
Один из таких методов — газохроматография. При этом процессе смесь этилена и этана разделяется на отдельные компоненты с помощью хроматографического разделения. Различительность этилена и этана определяется по их газохроматографическим колебаниям.
Другим способом отличить этилен от этана является окисление. При оксидации этилен образует этиленоксид, а этан не образует такого соединения. Таким образом, наличие этиленокисида указывает на присутствие этилена.
Также можно провести анализ спектра, который будет показывать характерные пики для этилена и этана. Спектральный анализ позволяет определить наличие и концентрацию этилена в смеси.
Различия в горении этилена и этана
Этан (C2H6) горит полностью без пламени, при этом выделяется большое количество тепла. Его горение называется полным, так как в результате образуется только углекислый газ (СО2) и вода (Н2O). Этан более предпочтителен для использования как источник энергии.
Этилен (C2H4), напротив, горит с ярким пламенем и неполным сгоранием. В процессе его горения могут образовываться продукты сгорания, такие как угарный газ, окись углерода и другие опасные вещества. Поэтому этилен часто используется в качестве горючего материала при сварке и резке металлов.
Таким образом, различия в горении этилена и этана заключаются в их способности гореть полностью или неполно, а также в характере образующихся продуктов сгорания.
Физические свойства этилена и этана
Этилен
- Молярная масса: 28.05 г/моль
- Температура кипения: -103.7°C
- Температура плавления: -169°C
- Плотность: 0.985 г/мл (при 25°C)
- Растворимость: нерастворим в воде, но растворим в органических растворителях, таких как этиловый спирт и хлороформ
- Агрегатное состояние: газообразное при комнатной температуре и давлении
Этан
- Молярная масса: 30.07 г/моль
- Температура кипения: -88.6°C
- Температура плавления: -182.8°C
- Плотность: 0.617 г/мл (при 25°C)
- Растворимость: нерастворим в воде, но растворим в органических растворителях, таких как бензол и этер
- Агрегатное состояние: газообразное при комнатной температуре и давлении
Из вышеуказанных характеристик можно сделать вывод о схожести физических свойств двух соединений. Однако, наблюдаются различия в значениях температуры плавления и кипения, а также в плотности. Этильовый спирт можно различить от этана по его мольной массе и плотности. Это важные физические свойства, которые играют важную роль в различии между этаном и этеном.
Методы различения этана и этилена
Один из методов различения основан на различии в физических свойствах этилена и этана. Этилен является газом при комнатной температуре и давлении, в то время как этан является жидкостью. Это позволяет легко различить два соединения по их агрегатному состоянию.
Другим методом различения является проведение химической реакции между этаном и этиленом с хлором. Этан не реагирует с хлором, в то время как этилен образует основной продукт реакции – 1,2-дихлорэтан. Это позволяет определить наличие этилена в пробе.
Использование специальных индикаторов является еще одним методом различения этана и этилена. Например, в присутствии брома, этилен окрашивается в ярко-желтый цвет, в то время как этан остается без изменений. Это позволяет наглядно отличить этилен от этана.
Газохроматография – это метод анализа, который используется для определения содержания различных компонентов смеси. Он также может быть использован для различения этана и этилена. Газохроматографический анализ позволяет определить различия в подвижности этилена и этана в газовой фазе, что делает возможным определить наличие и концентрацию каждого из этих соединений.
| Метод | Преимущества | Недостатки |
|---|---|---|
| Физические свойства | Простота проведения | Не всегда точный результат |
| Химическая реакция с хлором | Наглядное отличие | Ограниченная специфичность |
| Использование специальных индикаторов | Простота визуального анализа | Низкая точность |
| Газохроматография | Высокая точность и чувствительность | Требует специального оборудования |
Полученные данные могут быть использованы для дальнейшего анализа и исследования свойств и реакционной способности этана и этилена. Они могут также быть полезны при определении наличия и концентрации этилена в промышленных и жизненных ситуациях.
Использование специальных индикаторов
Этилен провоцирует выделение газового брома из бромной воды, образуя бесцветное соединение и выделяя вследствие этого желтоватый цвет. В случае с этаном нет никакой реакции. Используя этот метод, можно с легкостью определить наличие этилена в различных смесях газов.
Также существует другой специальный индикатор — маркированный газ. Для этого метода применяют газ с добавкой химического вещества, которое образует видимое пятно или облако при контакте с этиленом. В случае с этаном определенной реакции не происходит. Таким образом, можно легко различить этилени и этан, используя маркированный газ.
Использование специальных индиакторов может быть полезным инструментом в лаборатории или в промышленной сфере для точного определения наличия этилена и этана в различных смесях газов.
Газохроматография
Применительно к отличению этилена от элана, газохроматография может быть очень полезным инструментом. Этот метод основан на разделении компонентов смеси на основе их различной аффинности к стационарной фазе или капилляру.
Процесс анализа начинается с введения смеси в газохроматографическую систему через инжектор. Затем газовая смесь проходит через колонку, которая содержит стационарную фазу. Колонка может быть заполненной или капиллярной.
Компоненты смеси взаимодействуют с стационарной фазой и мигрируют по колонке с различными скоростями. По мере прохождения через колонку, компоненты смеси регистрируются детектором, который создает электрический сигнал. Этот сигнал анализируется, и на основе времени удержания или других характеристик, можно определить наличие или отсутствие определенного компонента в смеси.
Газохроматография обычно реализуется с использованием специализированного оборудования, такого как газовый хроматограф. Преимуществами этого метода являются его высокая точность, повторяемость и возможность анализировать очень малые количества вещества в смеси.
В отличие от других методов определения, газохроматография позволяет проводить анализ в реальном времени, что делает ее очень полезным инструментом для многих областей, включая диагностику, научные исследования и процессы производства.
Таким образом, газохроматография является эффективным и точным методом определения различий между этаном и этиленом, что позволяет устанавливать состав смесей и проводить качественный анализ химических соединений.
Видео:Получение и изучение свойств этилена. Опыт 2Скачать

Химические реакции этилена и этана
Этилен, также известный как этилен (С2Н4), обладает двойной связью между атомами углерода. Эта двойная связь делает его нестабильным и вместе с тем предоставляет много возможностей для химической реактивности. Некоторые характерные реакции этилена включают:
- Полимеризация: этилен может претерпевать полимеризацию, образуя полиэтилен.
- Горение: этилен горит без дыма и с относительно чистым пламенем.
- Гидрирование: этилен может быть гидрирован в этилэтилен или другие продукты.
- Гидрохлорирование: экспонирование этилена к газообразному хлору приводит к образованию винилхлорида.
Этан, с другой стороны, обладает одинарной связью между атомами углерода. Несмотря на то, что этан более стабилен, у него все же есть свои характерные химические реакции:
- Горение: этан горит, образуя воду и углекислый газ.
- Галогенизация: этан может реагировать с галогенами (хлор, бром, йод), образуя соответствующие галогениды.
- Гидрирование: в присутствии катализатора этан может быть гидрирован, образуя этанол или другие продукты с высокой добавкой водорода.
Это лишь некоторые из химических реакций, которые происходят с этиленом и этаном. С их помощью можно различить эти два углеводорода и определить, с каким из них имеется дело.
Горение
Горение осуществляется в определенных условиях, таких как наличие кислорода, достаточная температура и наличие источника зажигания. Когда эти условия соблюдаются, горючее вещество начинает окисляться и происходит цепная реакция, в результате которой вещество сгорает.
Главными компонентами горения являются топливо, кислород и источник зажигания. Топливо может быть различным — это может быть газ, жидкость или твердое вещество. Например, в качестве топлива для горения в машинах используется бензин или дизельное топливо, которые смешиваются с кислородом из воздуха, и искра от свечи зажигания дает начало процессу горения.
Горение — это процесс, который мы встречаем ежедневно в нашей жизни. Например, когда мы зажигаем свечу, горит костер или газовая плита, это все примеры горения. Горение также используется для производства энергии, например, в электростанциях, где топливо сжигается для привода турбины, которая вращает генератор и производит электричество.
Горение является важным процессом, который способствует преобразованию энергии и обеспечивает нашу повседневную жизнь. Без горения мы бы не имели доступа к таким удобствам, как свет, тепло и транспортное средство.
Презентация на тему: ” Этилен и его гомологи Непредельные углеводороды. Этилен – этен В чем отличие молекулы этилена от молекулы этана? Каким образом можно получить из этана.” — Транскрипт:
1
Этилен и его гомологи Непредельные углеводороды

2
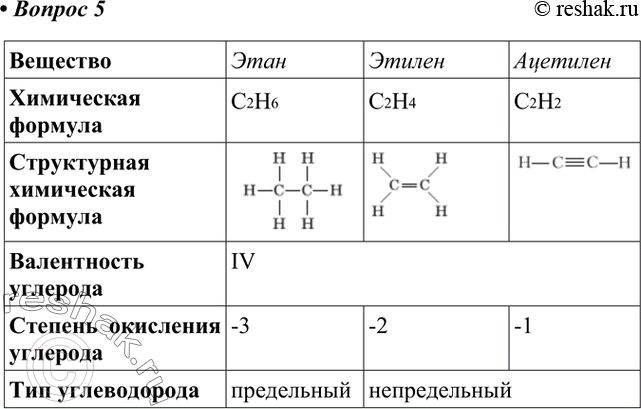
Этилен – этен В чем отличие молекулы этилена от молекулы этана? Каким образом можно получить из этана этилен и наоборот ? С 2 Н 6 этан С 2 Н 4 этилен

3
Реакция дегидрирования – это реакции отщепления атомов водорода от молекул органических веществ. Составьте уравнение дегидрирования этана

4
Этилен – этен Составьте структурную формулу этилена. Почему этот углеводород называют непредельным? Какой гомологический ряд органических веществ будет начинать этилен? Выведите общую формулу этого ряда углеводородов.

5
Непредельные углеводороды – это органические вещества, молекулы которых содержат двойные или тройные связи и не насыщены до предела атомами водорода.

6
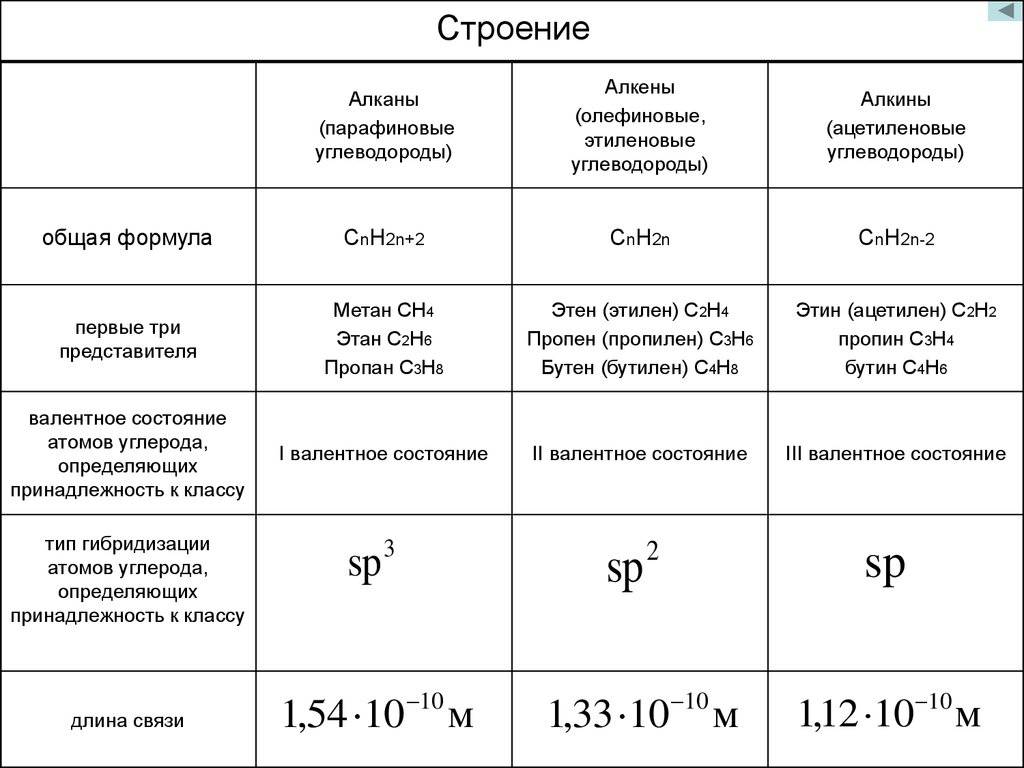
Алкены Это непредельные углеводороды, молекулы которых содержат одну двойную связь, с общей формулой C n H 2n

7
Алкены Составьте и назовите структурные формулы гомологов этилена с 3 и 4 атомами углерода. Найдите формулы алкенов в 3 на стр.143 печатной тетради

8
Получение этилена в лаборатории Чем молекула спирта отличается от молекулы этилена? Составьте уравнение реакции получения этилена из этилового спирта С 2 Н 5 ОН этиловый спирт

9
Реакция дегидратации – это реакция отщепления воды от молекул веществ. Какую реакцию называют гидратацией? Гидратация – это присоединение молекул воды к молекулам непредельных веществ

10
Химические свойства этилена Запомните! Для непредельных углеводородов характерны реакции присоединения (насыщения связей), с разрывом двойных связей и образовании одинарных связей.

11
Химические свойства этилена Запомните! Присоединяться могут : 1. молекулы водорода (гидрирование); 2. молекулы воды (гидратация); 3. молекулы галогенов (брома и хлора); 4. соединение в огромную молекулу – полимеризация.

12
Химические свойства этилена Запомните! Качественными реакциями на определение в молекулах двойных связей является обесцвечивание растворов марганцовки и бромной воды (раствора брома в воде).

13
Применение этилена Почему реакцию горения этилена экономически не выгодно использовать для получения энергии? Этилен в больших количествах используют как химическое сырье для производства полиэтилена и других ценных органических веществ

14
Химические свойства этилена Выполните упражнение 6 на стр. 145 в печатной тетради с помощью текста учебника. Найдите в учебнике и запишите определения в 7 на стр.145 в печатной тетради

15
Задание на дом Параграф 33, 1-3 всем, 4-5 на «4» и «5». Выучить все определения!

Тренировочные задания
1. Для метана верны следующие утверждения:
1) его молекула образована атомом углерода в sp-гибридном состоянии 2) это низкокипящая жидкость, хорошо растворимая в воде 3) это низкокипящий газ, плохо растворимый в воде 4) является основным компонентом природного газа 5) легко реагирует с разбавленной серной кислотой
2. Для метана верны следующие утверждения:
1) его молекула образована атомом углерода в состоянии sp2-гибридизации 2) метан реагирует с парами разбавленной азотной кислоты 3) метан обладает характерным неприятным запахом 4) сгорает на воздухе с образованием угарного газа и воды 5) сгорает на воздухе с образованием углекислого газа и воды.
3. Для этана верны следующие утверждения:
1) это бесцветный газ, немного легче воздуха 2) это бесцветный газ, немного тяжелее воздуха 3) при его взаимодействии с водой образуется этиловый спирт 4) при его дегидрировании образуется этилен 5) все атомы углерода в нём — третичные
4. Для этана верны следующие утверждения:
1) оба атома углерода в его молекуле являются первичными 2) не реагирует с гидроксидом натрия 3) реагирует с серной кислотой 4) реагирует с метаном 5) обладает резким неприятным запахом
5. Для этилена верны следующие утверждения:
1) оба атома углерода в его молекуле находятся в состоянии sp2-гибридизации 2) плотность паров этилена равна плотности паров азота 3) не реагирует с водой 4) не сгорает в кислороде 5) не присоединяет хлор
6. Для этилена верны следующие утверждения:
1) при нормальных условиях это легкокипящая жидкость, хорошо растворимая в воде 2) оба атома углерода в его молекуле находятся в состоянии sp3-гибридизации 3) взаимодействует с водой с образованием уксусной кислоты 4) взаимодействует с бромной водой с образованием 1,2-дибромэтана 5) взаимодействует с водой с образованием этилового спирта
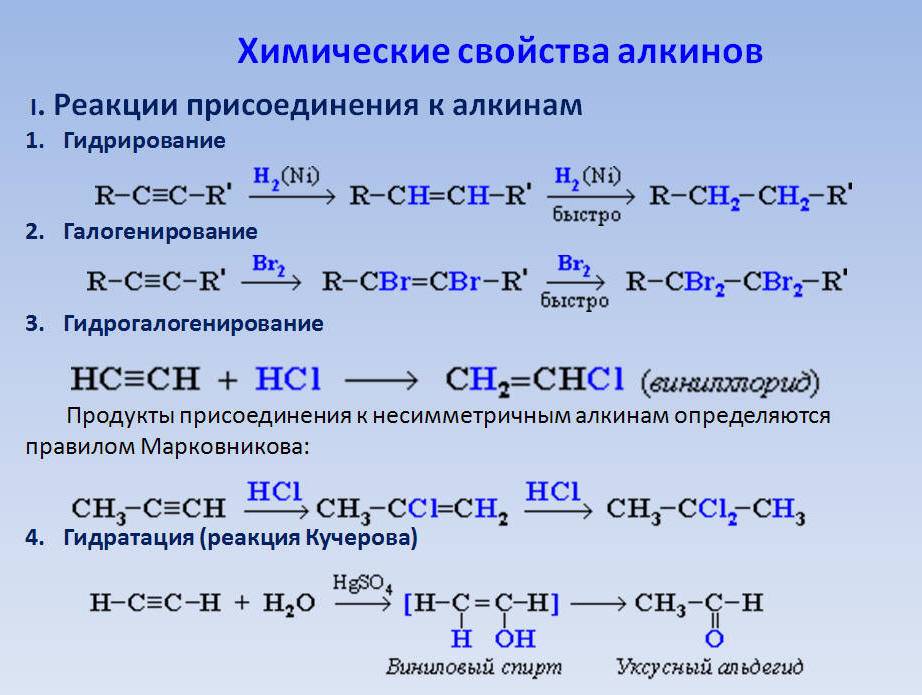
7. Для ацетилена верны следующие утверждения:
1) при нормальных условиях это газ, пары которого легче воздуха 2) при нормальных условиях это газ, пары которого тяжелее воздуха 3) не реагирует с бромом 4) реагирует с водой с образованием этанола 5) реагирует с водой с образованием уксусного альдегида
8. Для ацетилена верны следующие утверждения:
1) атомы углерода в его молекуле находятся в состоянии sp2-гибридизации и соединены двойной связью 2) атомы углерода в его молекуле соединены тройной связью и находятся в состоянии sp-гибридизации 3) при его сгорании в кислороде образуется угарный газ и вода 4) при его сгорании в кислороде образуется углекислый газ и вода 5) реагирует с азотом
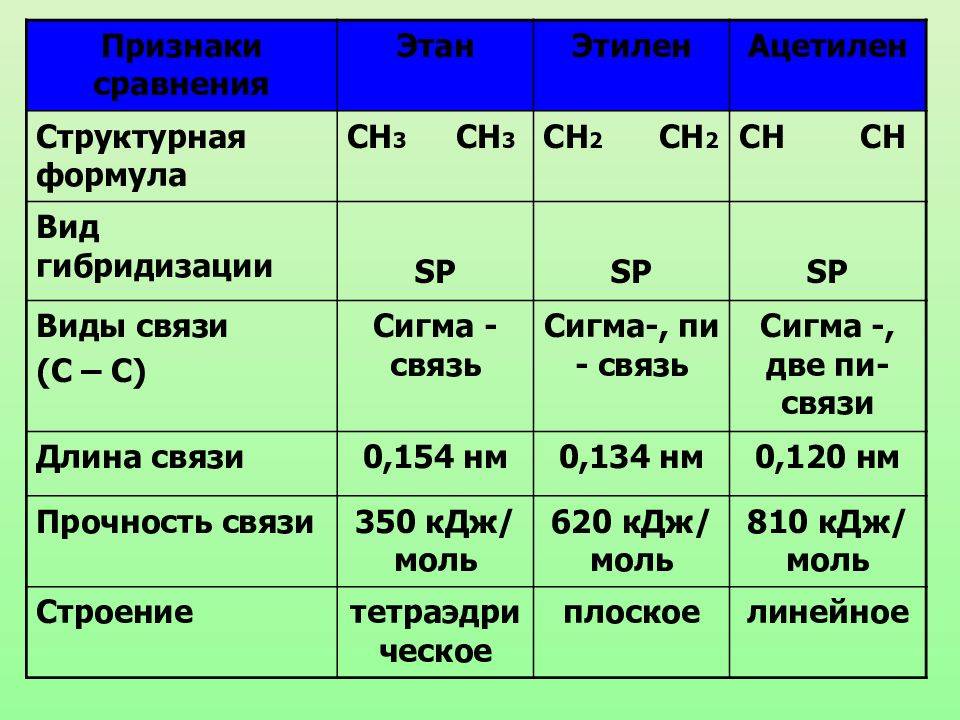
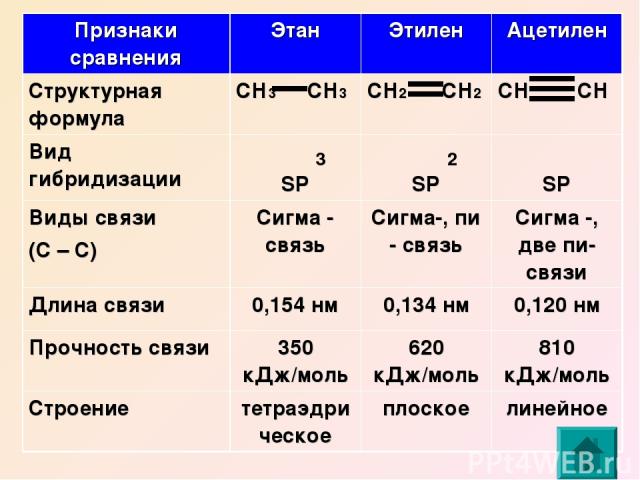
Физические свойства основных углеводородов
Одним из самых простых и наиболее распространенных углеводородов является метан (CH4), который имеет всего один атом углерода. Метан — газ, который при нормальных условиях образует безцветную и беззапаховую субстанцию. Он обладает низкой плотностью и может гореть в воздухе.
Другой известный углеводород — этан (C2H6), который состоит из двух атомов углерода. Этан также является газообразным веществом при нормальных условиях. Он обладает более высокой плотностью по сравнению с метаном и может использоваться в качестве сжиженного газа.
Более сложные углеводороды, такие как пропан (C3H8) и бутан (C4H10), также являются газообразными при нормальных условиях. У них выше плотность по сравнению с метаном и этаном, и они могут быть использованы в качестве сжиженного газа.
С увеличением количества атомов углерода углеводороды становятся более тяжелыми и имеют более высокую температуру кипения. Например, пентан (C5H12) является жидкостью при нормальных условиях и имеет температуру кипения около 36 °C.
Более длинные углеводородные цепи, такие как гексан (C6H14) и октан (C8H18), являются жидкими при нормальных условиях и имеют более высокие температуры кипения.
Для углеводородов с еще большим количеством углеродных атомов, таких как декан (C10H22) и эйкозан (C20H42), температуры кипения выше 100 °C, и они являются плавкими твердыми веществами при нормальных условиях.
- Метан — газ, безцветный и беззапаховый;
- Этан — газ, применяется в качестве сжиженного газа;
- Пропан — газ, применяется в качестве сжиженного газа;
- Бутан — газ, применяется в качестве сжиженного газа;
- Пентан — жидкость, температура кипения около 36 °C;
- Гексан — жидкость, температура кипения выше пентана;
- Октан — жидкость, температура кипения выше гексана;
- Декан — твердое вещество, температура кипения выше 100 °C;
- Эйкозан — твердое вещество, температура кипения выше 100 °C.
📸 Видео
Этилен и ацетилен, как представители ненасыщенных углеводородов. Химия 9 классСкачать

Нефтехимия в деталях. Пиролиз и полимеризацияСкачать

Практическая работа “Получение этилена и опыты с ним” 10 классСкачать

Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

Получение этилена и его горениеСкачать

Видео №3. Как составить изомерыСкачать

Получение этилена из этилового спиртаСкачать

Получение этилена и изучение его свойств. | Практическая работа № 1.Скачать

Как производят полиэтилен?Скачать

Взаимодействие этилена с бромной водойСкачать

Пиролиз газа (этан, пропан, бутан), назначение пиролиза, сырье и продукты пиролиза на НПЗСкачать

10 класс – Химия – Алкины. Ацетилен. Состав и строение. ПолучениеСкачать

Химия 10 класс (Урок№3 – Непредельные углеводороды – алкены.)Скачать

Химия с нуля — Химические свойства АлкеновСкачать

Получение этиленаСкачать

1.2. Алканы: Способы получения. Подготовка к ЕГЭ по химииСкачать

Определение присутствия этилена и этана в смеси газов
Для проведения анализа необходимо создать газовую смесь, содержащую этилен и этан, и подать ее на хроматографическую установку. Хроматограф разделяет компоненты смеси на основе различий в их аффинности к стационарной фазе и мобильной фазе.
| Этилен | Этан | |
|---|---|---|
| Молекулярная формула | C2H4 | C2H6 |
| Физическое состояние при комнатной температуре | Газ | Газ |
| Реакционная способность | Способен претерпевать полимеризацию | Не обладает реакционной способностью |
| Присутствие двойной связи | Содержит две двойные связи | Не содержит двойной связи |
После проведения газовой хроматографии можно получить график, на котором отраженны пики для каждого из компонентов смеси. Определяя время удерживания каждого пика, возможно определить соотношение этилена и этана в газовой смеси.
Таким образом, используя методику газовой хроматографии, можно определить присутствие и соотношение этилена и этана в смеси газов, что позволяет установить их концентрацию и провести нужные аналитические исследования.
Окислительные свойства
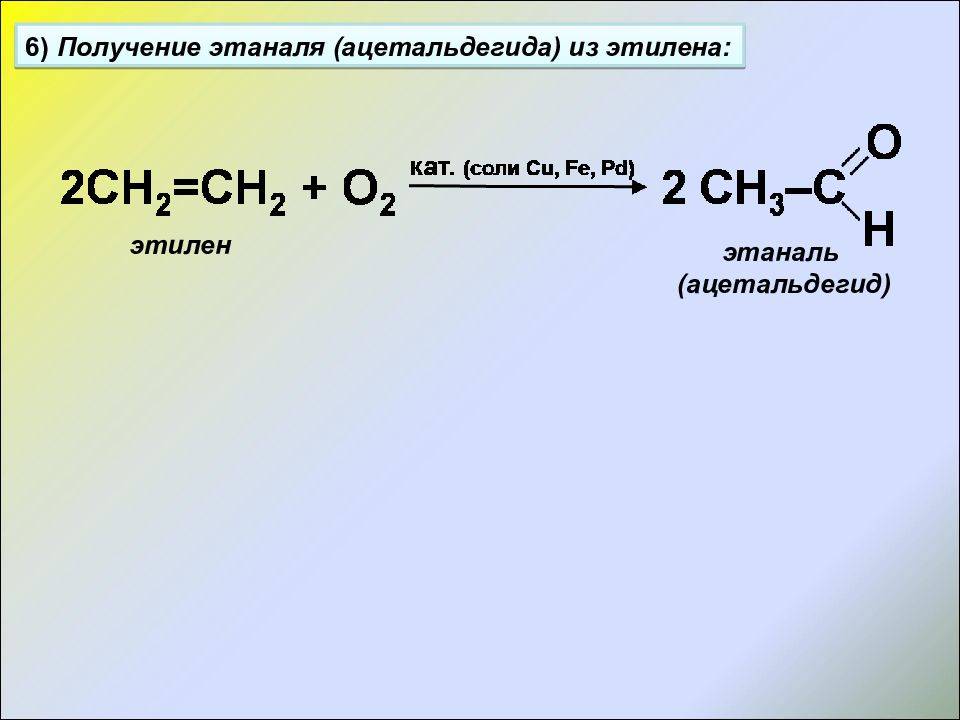
Этилен является самым простым представителем алкенов и обладает более выраженными окислительными свойствами по сравнению с этаном.
При окислении этилен образует этиленоксид, который является важным промышленным промежуточным продуктом.
В отличие от этана, этилен может образовывать множество оксидов, если использовать различные окислители.
Например, при действии хлора на этилен образуется хлорэтилен (сухой хлорэтилен) или хлорэтиленовая смесь (в присутствии воды).
Окислительные свойства этилена позволяют использовать его в различных химических процессах, включая производство пластмасс, резин и других полимерных материалов.
Топ вопросов за вчера в категории образование
Образование 11.10.2023 21:09 1372 Ситникова Евгения.
Какое проверочное слово к слову ПРЕДПОЛАГАТЬ?
Ответов: 1
Образование 26.08.2023 14:06 2166 Пинчук Никита.
Какие фрукты начинаются на букву “Р”?
Ответов: 1
Образование 09.09.2023 09:10 1941 Дианочка Диана.
Какие фрукты начинаются на букву “Ф”?
Ответов: 1
Образование 28.10.2023 10:34 1948 Угланова Яна.
Как решить: Для перевозки груза потребовалось 24 машины грузоподъём. 7,5 т?
Ответов: 1
Образование 02.09.2023 05:24 1260 Салымгереев Акылбек.
Как правильно: по получении или по получению?
Ответов: 1
Образование 01.09.2023 05:01 2040 Зонова Виктория.
Какие фрукты начинаются на букву “Д”?
Ответов: 1
Образование 06.10.2023 16:43 812 Романов Ярослав.
Как правильно гулять” по лесу” или в” лесу”?
Ответов: 1
Образование 16.09.2023 23:41 2064 Ткачёв Витя.
Какое проверочное слово к слову ОГОРОД?
Ответов: 1
Образование 31.08.2023 01:19 603 Романенкова Маша.
“Со своей стороны” выделяется запятыми или нет?
Ответов: 1
Образование 26.09.2023 09:48 1346 Сапроненков Евгений.
Какое проверочное слово к слову “облегчить” (облегчение)?
Ответов: 1
Применение этилена и этана в промышленности
Применение этилена:
- Производство полиэтилена — одного из самых распространенных пластиков в мире. Полиэтилен используется для изготовления плёнки, труб, контейнеров и других изделий.
- Производство этилового спирта — вещества, применяемого в качестве растворителя, антисептика, а также для производства медицинских препаратов и других продуктов.
- Производство этиленгликоля — используется в качестве противозамерзающего, вещества, увлажняющего кожу, а также в производстве полимеров и других химических веществ.
- Производство пропиленоксида — основного компонента при изготовлении полиуретанов и других полимеров, используемых в различных отраслях промышленности.
- Производство этиленоксида — используется для производства этиленгликоля, пенообразователей, антисептиков и других продуктов.
Применение этана:
- Производство этилена — этан является основным источником этилена, который используется во многих отраслях промышленности.
- Производство синтетического газа — этан может быть использован для производства синтез-газа, который затем используется для получения различных химических веществ и топлива.
- Производство пластмасс — этан является одним из основных сырьевых материалов для производства полиэтилена, полипропилена и других пластиков.
- Производство газового топлива — этан может быть использован в качестве компонента газового топлива, а также для получения бензина.
Использование этилена и этана в промышленности позволяет производить большое количество различных продуктов, которые мы ежедневно используем в нашей жизни
Стабильное и эффективное производство этих углеводородов является важной задачей для развития химической промышленности
Рекомендации при работе с этиленом и этаном
Работа с химическими веществами, такими как этилен и этан, требует особой осторожности и знания применяемых правил безопасности. Вот несколько полезных рекомендаций при работе с этими веществами:. 1
Хранение:
1. Хранение:
Храните этилен и этан в хорошо вентилируемых и изолированных от источников огня помещениях. Обеспечьте соответствующие условия температуры и влажности для предотвращения возникновения аварийных ситуаций.
2. Передвижение:
Перед перемещением контейнеров с этиленом или этаном убедитесь, что они надежно закрыты и правильно маркированы. Используйте соответствующие средства и технику для безопасного перемещения.
3. Использование защитных средств:
При работе с этиленом и этаном необходимо использовать защитные средства, такие как защитные очки, перчатки, халаты и маски, чтобы предотвратить контакт с кожей, глазами или дыхательной системой. Ознакомьтесь с инструкциями по использованию и обслуживанию средств индивидуальной защиты перед началом работы.
4. Вентиляция:
Обеспечьте эффективную вентиляцию рабочих помещений, чтобы избежать скопления паров этилена или этана. Тщательно изучите инструкции по установке и обслуживанию систем вентиляции и убедитесь, что они функционируют должным образом.
5. Аварийная ситуация:
В случае возникновения аварийной ситуации с этиленом или этаном, немедленно примите меры по обеспечению своей безопасности и безопасности окружающих. Закройте и изолируйте источник утечки, уведомьте соответствующие службы и следуйте их рекомендациям.
Соблюдение этих рекомендаций поможет обеспечить безопасность при работе с этиленом и этаном. Однако, всегда необходимо также руководствоваться инструкциями производителя и соблюдать местные правила безопасности.