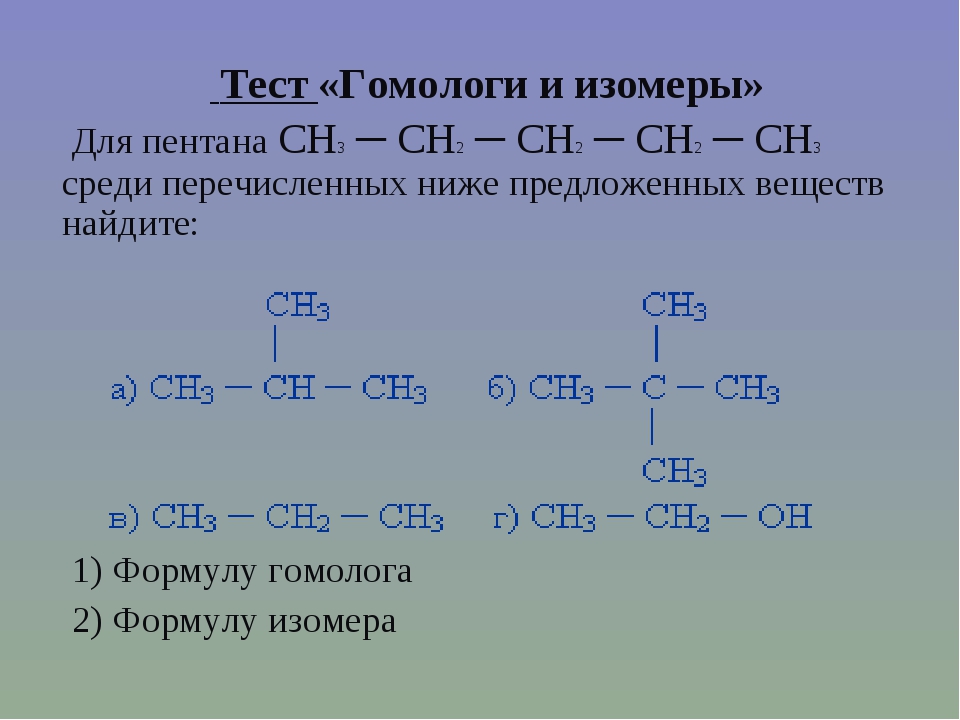
Типы изомеров
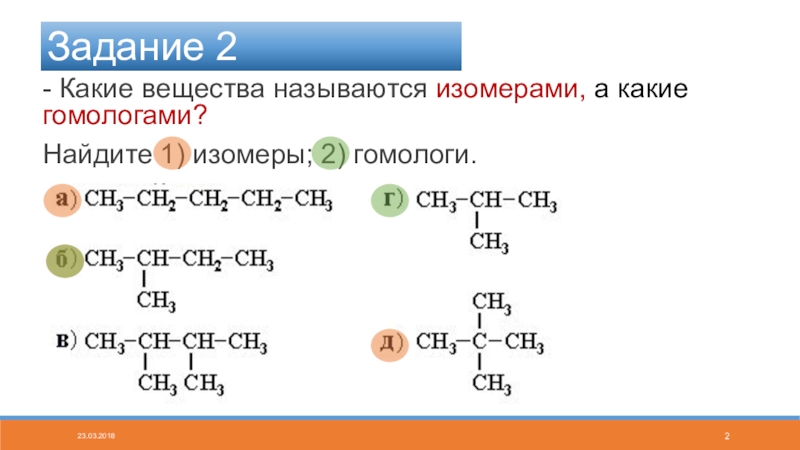
Как указано выше, представлены два типа изомеров, которые различаются упорядочением своих атомов. Типы изомеров следующие:
Конституционные изомеры (структурные)
Те соединения, которые имеют одинаковые атомы и функциональные группы, но расположены в другом порядке; то есть ссылки, составляющие их структуры, имеют различное расположение в каждом соединении.
Они делятся на три типа: позиционные изомеры, цепные или скелетные изомеры и изомеры функциональных групп, иногда называемые функциональными изомерами.
Цепные или скелетные изомеры
Они отличаются распределением углеродных заместителей в соединении, то есть тем, как они распределены линейно или разветвленно.
Функциональные группы изомеров
Также называемые функциональными изомерами, они состоят из одинаковых атомов, но они образуют разные функциональные группы в каждой молекуле..
таутомерия
Существует исключительный вид изомерии, который называется таутомерия, в которой происходит взаимопревращение одного вещества в другое, которое обычно происходит путем переноса атома между изомерами, вызывая баланс между этими видами.
Стереоизомеры (пространственные изомеры)
Это называется так для веществ, которые имеют абсолютно одинаковую молекулярную формулу и чьи атомы расположены в одном и том же порядке, но чья ориентация в пространстве отличается между одним и другим. Поэтому для обеспечения их правильной визуализации они должны быть представлены в трехмерном виде..
В общих чертах существует два класса стереоизомеров: геометрические изомеры и оптические изомеры..
Геометрические изомеры
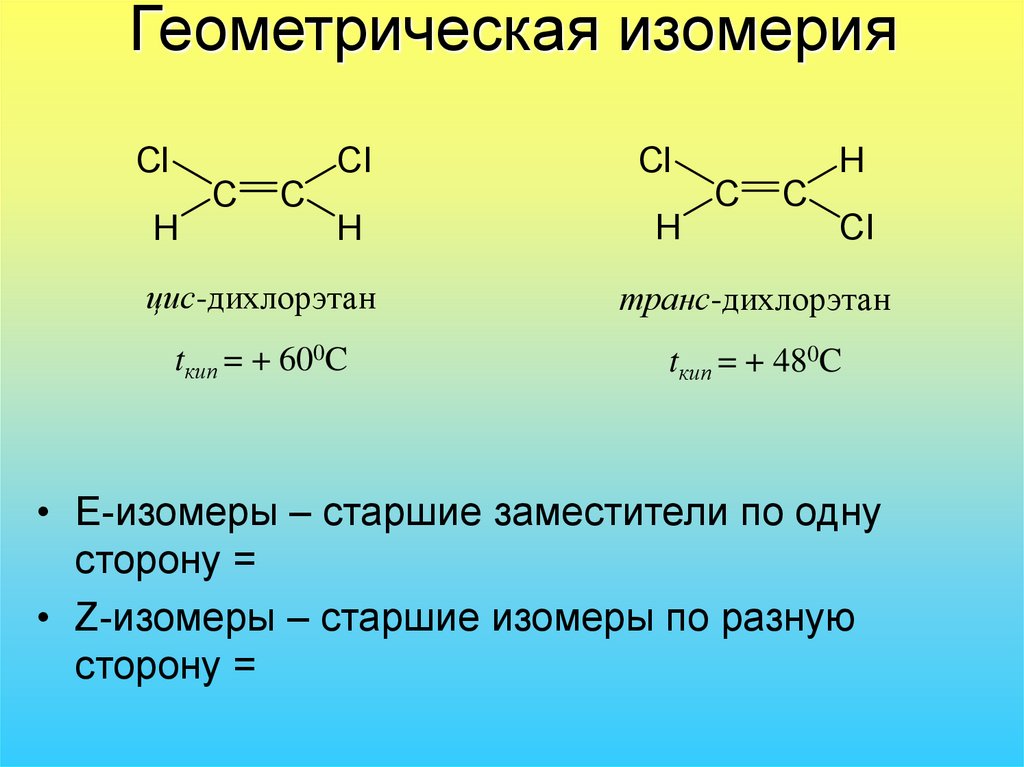
Они образуются путем разрыва химической связи в соединении. Эти молекулы представлены парами, которые отличаются по своим химическим свойствам, поэтому для их дифференциации были установлены термины цис (специфические заместители в соседних положениях) и транс (специфические заместители в противоположных положениях его структурной формулы)..
В этом случае выделяются диастереомеры, которые имеют разные конфигурации и не являются наложенными друг на друга, каждый со своими характеристиками. Также обнаружены конформационные изомеры, образованные вращением заместителя вокруг химической связи.
Оптические изомеры
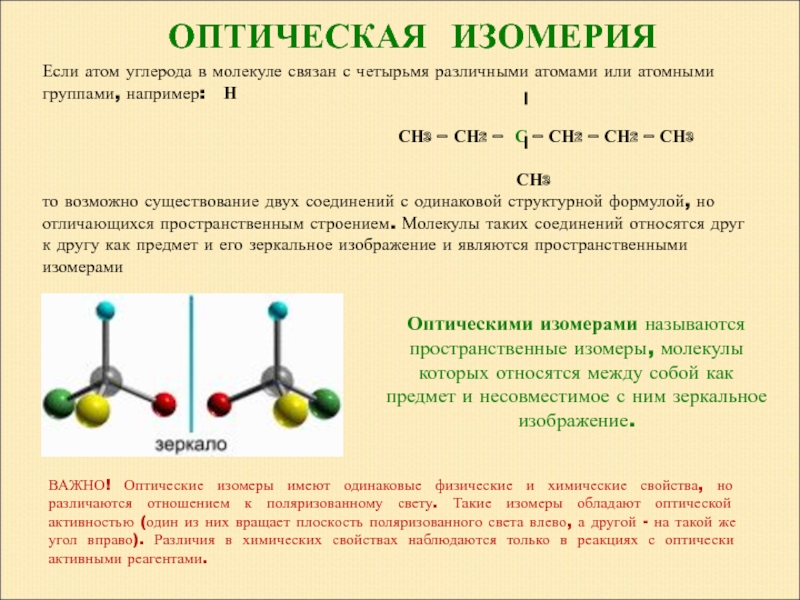
Это те, которые составляют зеркальные изображения, которые не могут перекрываться; то есть, если изображение изомера размещено на изображении другого, положение его атомов не совпадает точно. Тем не менее, они имеют одинаковые характеристики, но отличаются от их взаимодействия с поляризованным светом.
В этой группе выделяются энантиомеры, которые генерируют поляризацию света в соответствии с их молекулярным расположением и различаются как правовращающие (если поляризация света находится в правильном направлении плоскости) или левовращающие (если поляризация в левом направлении) самолета).
Когда имеется одинаковое количество обоих энантиомеров (d и l), чистая поляризация или результирующая величина равна нулю, что известно как рацемическая смесь.
Энантиомерия и диастереоизомерия
Хиральность молекул является одним из важнейших понятий органической химии. Хиральные атомы углерода — это такие атомы, которые связаны с четырьмя разными заместителями. Если данное химическое соединение имеет один хиральный атом, то оно затем образует две пары молекул, так называемые энантиомеры. Они характеризуются тем, что выглядят как зеркальное отражение друг друга, но не перекрывают друг друга. Это обусловлено тем, что связи вокруг хирального атома расположены тетраэдрически.
Характерной особенностью энантиомеров является их способность вращать плоскость поляризованного света. Если один из них вращает плоскость света на строго определенный угол влево, то другой из пары вращает вправо также на ту же величину угла. Рацемическая смесь — это такая смесь, которая содержит равное количество обоих энантиомеров и поэтому не имеет способности к вращению. Явление вращения поляризованного света используется в поляриметрии. Это позволяет измерять концентрацию оптически активного вещества в испытуемом образце, в зависимости от величины угла поворота плоскости поляризованного света.
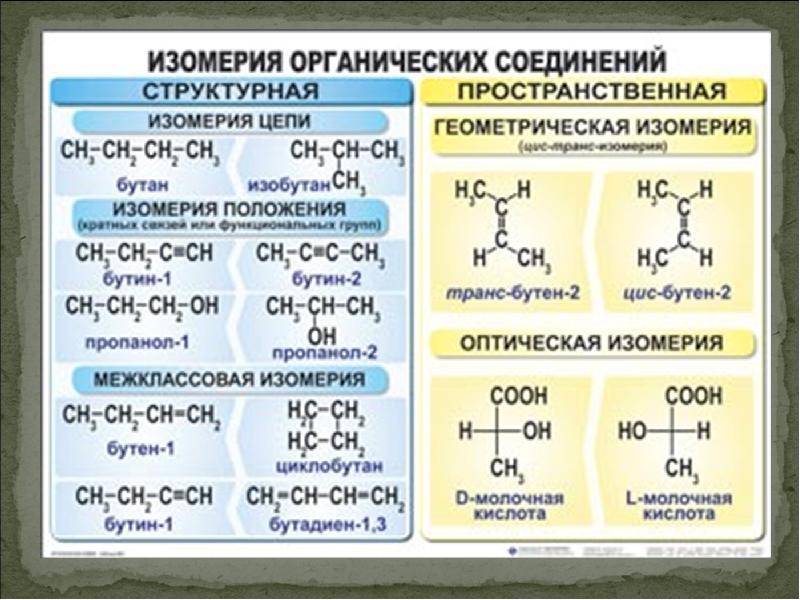
Структурный тип
Существует несколько типов изомерии. Структурным является тот, при котором различия наблюдаются в химическом строении молекулы. Сюда можно отнести несколько видов:
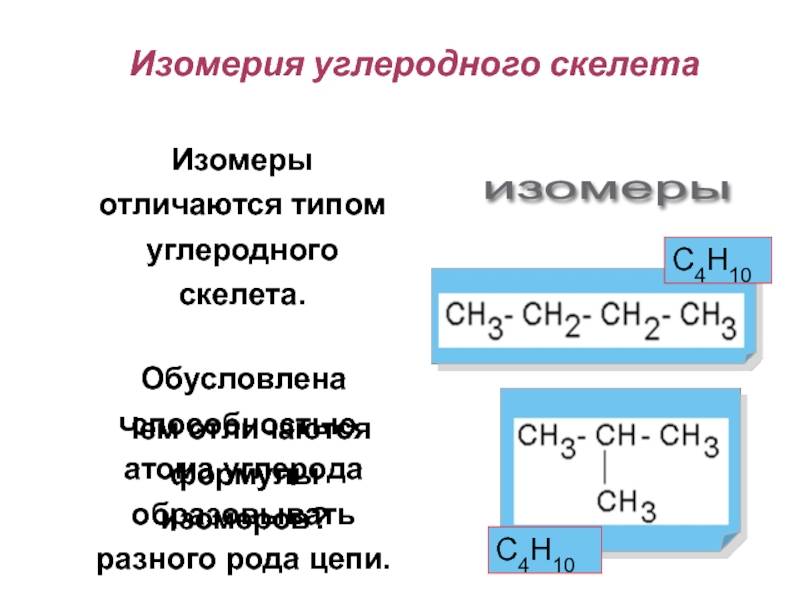
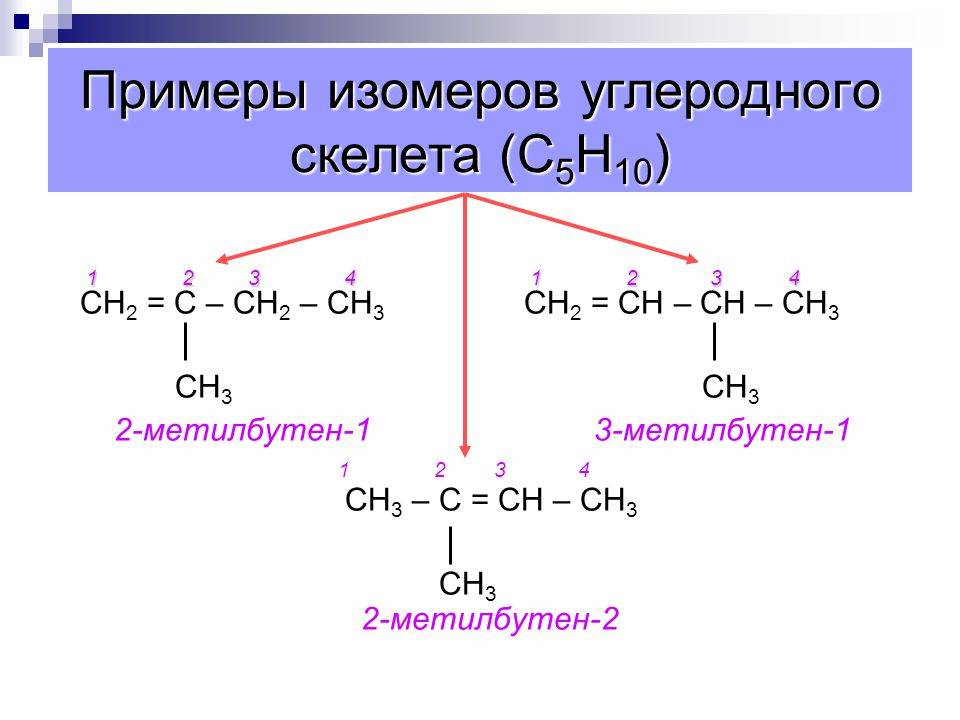
- углеродного скелета;
- валентную;
- межклассовую;
- положения;
- метамерию.
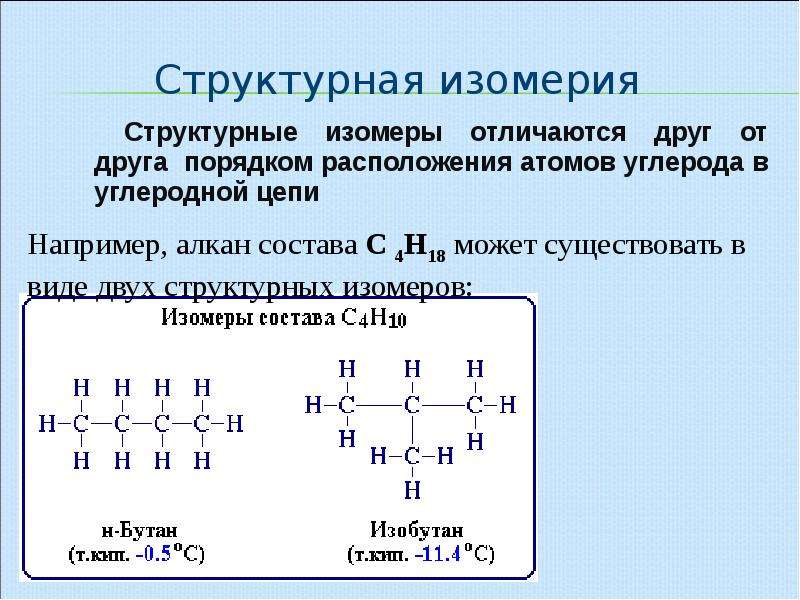
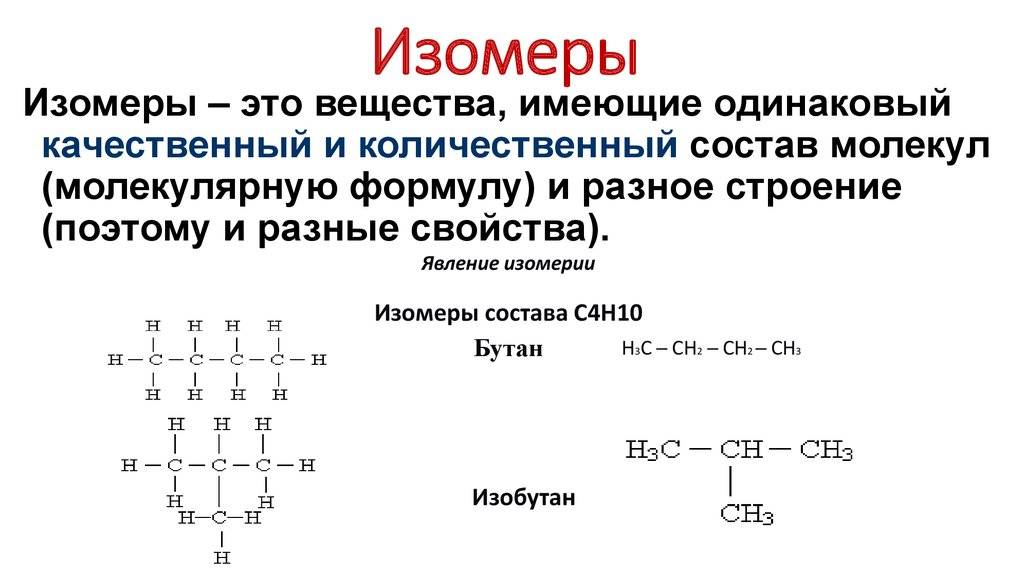
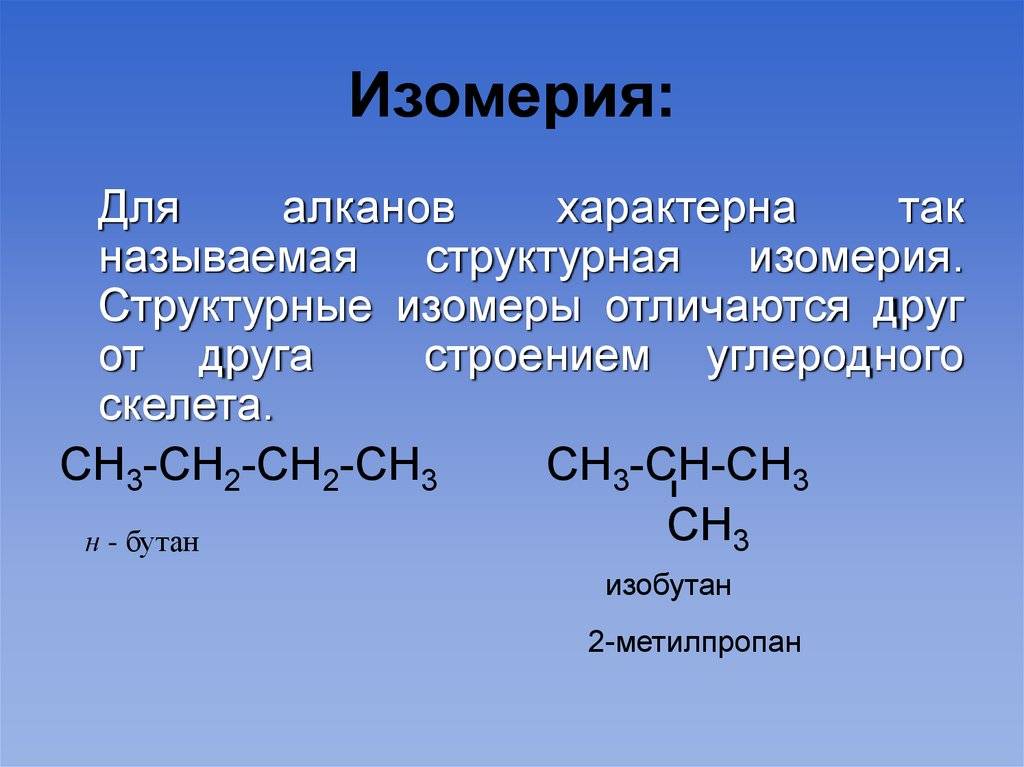
Разный порядок связи атомов обуславливает изомерию углеродного скелета. Самые простые примеры для этого случая: бутан и изобутан. Формула первого — СН3-СН2-СН2-СН3, а второго — (СН3)3СН. Сюда же можно отнести такие вещества, как фенантрен и антрацен, метилциклопропан и циклобутан. А также структурная изомерия характерна для гомологического ряда алканов.
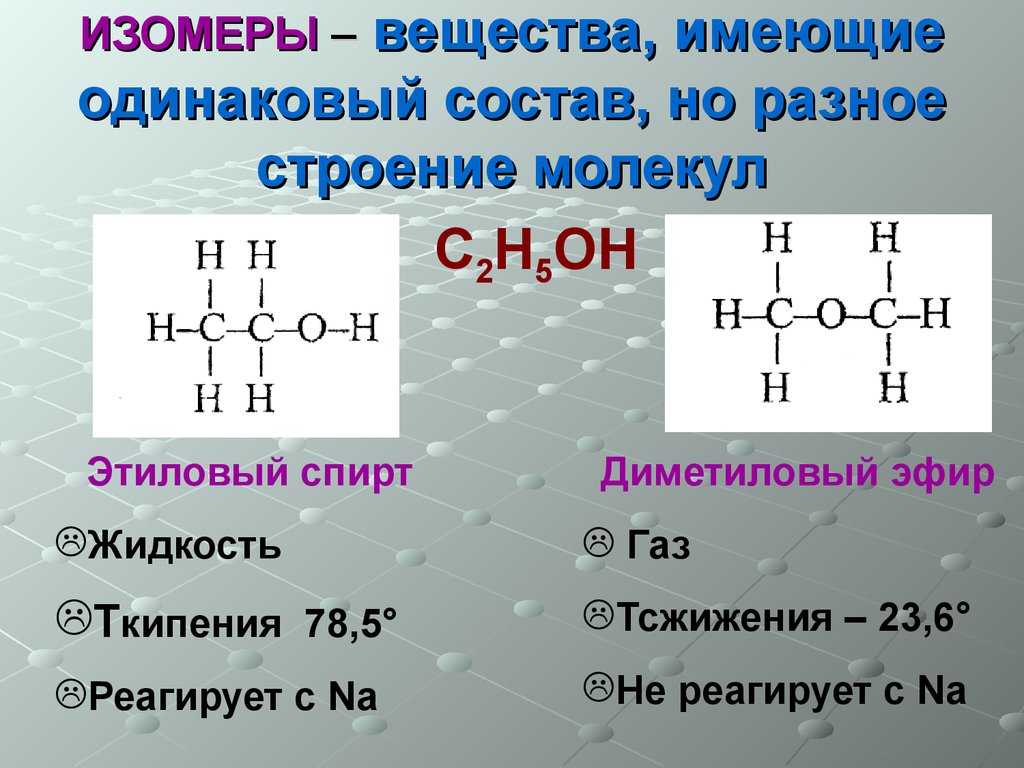
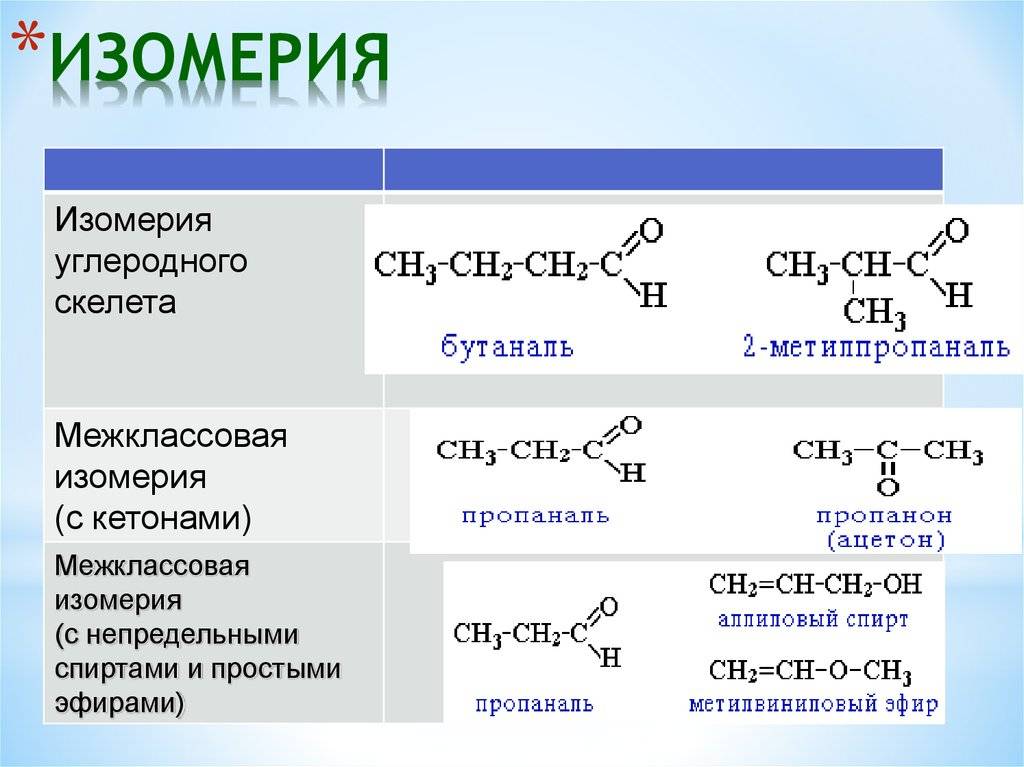
Если отличается характер функциональной группы, то говорят о межклассовом типе. К нему относят диметиловый эфир и этанол: СН3-О-СН3 и СН3-СН2-ОН. Отличия в положении одних и тех же кратных связей или функциональных групп при общем углеродном скелете — характерные черты одноименной изомерии. Основные примеры: 4-хлорбутановая кислота или 2-хлорбутановая кислота.
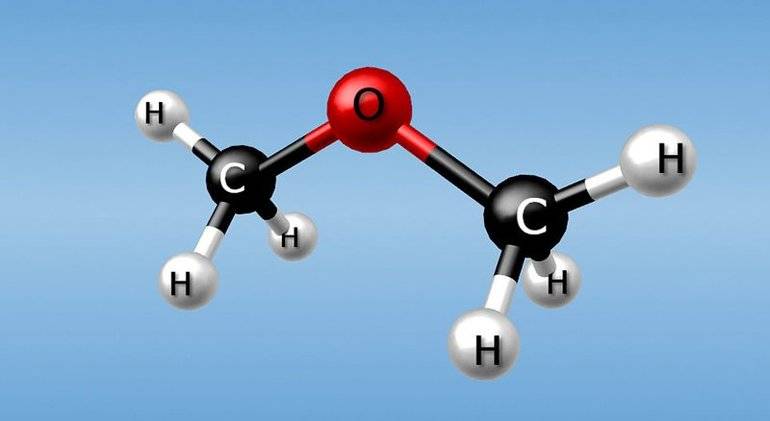
Метамерия — еще один вид изомерии органических соединений. Его особенности заключаются в том, что атомы углерода по-разному распределяются между углеводородными радикалами, которые разделены гетероатомом. Известен этот тип в числе простых и сложных эфиров, аминов и тиоспиртов. Но сегодня это понятие редко используется. А. Бутлеров называл явление изомерией нецельных структур, а наглядными примерами служат диэтиловый и метилпропиловый эфир: СН3СН2ОСН2СН3 и СН3ОСН2СН2СН3.
Что такое конституционные изомеры?
Конституционные (структурные) изомеры – это соединения с одной и той же молекулярной формулой, но с другой структурой.
Конституционные изомеры бывают трех типов:
- Скелетные (цепные) изомеры;
- Позиционные изомеры;
- Изомеры функциональных групп.
Скелетные изомеры имеют однородный количественный, качественный и функциональный состав, но структурно разную цепочку молекул. Цепи могут быть прямыми или разветвленными. Обычно скелетные изомеры имеют разные физические свойства.
Позиционные изомеры различаются расположением функциональной группы, заместителя или сложных связей в цепи. Они различаются в первую очередь физическими свойствами, а в некоторых случаях и биохимическими. Например, встречающиеся в природе аминокислоты являются преимущественно альфа-изомерами.
Метамерия – это форма позиционной изомерии, при которой функциональная группа включается в сам углеводород, тем самым разделяя его на два углеводородных остатка с разной длиной. Метамерия происходит у диалкиламинов, простых эфиров и т. Д.
Функциональные изомеры имеют одинаковый количественный и качественный состав, но разные функциональные группы. Это приводит к различию их химических свойств. Классическими примерами функциональных изомеров являются глюкоза и фруктоза.В природе функциональные изомеры имеют различное биохимическое значение.
Таутомерия – это тип структурной изомерии, при которой при определенных условиях одна пространственная структура трансформируется в другую с динамическим равновесием между ними. Таутомерию можно рассматривать как форму функциональной изомерии.
История аллотропов и изомеров
И аллотропия, и изомерия были концепциями, предложенными шведским ученым Йенсом Якобом Берцелиусом. Он предложил концепцию аллотропия в 1841 г. После принятия гипотезы Авогадро в 1860 г. стало понятно, что элементы могут существовать в виде многоатомных молекул, и два аллотропа кислорода были признаны как O2 и O3. В начале 20 века было признано, что другие случаи, такие как углерод, были вызваны различиями в кристаллической структуре.
Изомерия была впервые замечена в 1827 году, когда Фридрих Вёлер приготовил циановую кислоту и заметил, что, хотя ее элементный состав был идентичен фульминовой кислоте (полученной Юстусом фон Либихом в предыдущем году), ее свойства были совершенно другими. Это открытие бросило вызов преобладающему химическому пониманию того времени, согласно которому химические соединения могут быть разными только тогда, когда они имеют разный элементный состав. После того, как были сделаны дополнительные открытия такого же рода, такие как открытие Велера в 1828 году, что мочевина имеет тот же атомный состав, что и химически отличный цианат аммония, Йонс Якоб Берцелиус ввел термин изомерия описать явление.
Что такое конфигурационные изомеры
Конфигурационные изомеры являются стереоизомерами, которые не могут превращаться друг в друга путем вращения молекулы вокруг одинарной связи. Эти конфигурационные изомеры могут быть найдены в двух типах как геометрические изомеры и оптические изомеры.
Геометрические изомеры
Геометрические изомеры также называют цис-транс-изомерами. Этот тип изомерии встречается в основном у алкенов и редко у алканов. Геометрическая изомерия описывает наличие двух идентичных групп (которые присоединены к атомам углерода винила), расположенных на одной стороне или противоположной стороне двойной связи. Если две идентичные группы находятся на одной стороне, это называется цис-изомером, а если две идентичные группы находятся на противоположных сторонах, это называется транс-изомером.
Рисунок 1: цис-транс изомерия
Здесь один изомер не может вращаться, чтобы получить другой изомер из-за присутствия двойной связи. Пи-связь запрещает вращение вокруг нее.
Оптические изомеры
Оптическая изомерия может быть обнаружена в молекулах, где присутствует хиральность. Хиральность – это наличие хиральных атомов углерода, которые могут вызывать оптическую активность молекулы. Хиральный углерод представляет собой атом углерода, к которому присоединены четыре различные группы. Следовательно, зеркальное отображение этой молекулы не накладывается на молекулу.
Рисунок 2: Оптическая Изомерия
На изображении выше показаны два оптических изомера. Эти изомеры способны вращать плоскополяризованный свет в противоположных направлениях.R-изомер может вращать плоскополяризованный свет в направлении, противоположном тому, что s-изомер может вращать свет. Буква R указывает направление по часовой стрелке, тогда как буква S указывает направление против часовой стрелки.
Основное различие – L и D изомеры
Моносахариды – это самая основная форма сахаров. Моносахариды могут объединяться друг с другом, образуя дисахариды, олигосахариды и полисахариды. Все моносахариды состоят из атомов C, H и O, расположенных в альдегидной или кетоновой формах. Конфигурации моносахаридов часто имеют небольшие различия в их изомерах
Поэтому важно правильно называть моносахариды, чтобы различать их. Соглашение D, L – это способ наименования моносахаридов в соответствии с их конфигурацией
Основное различие между L- и D-изомерами состоит в том, что ОН- группа предпоследнего углерода расположена справа от D-изомера. в то время как, в L-изомере он расположен с левой стороны.
Ключевые области покрыты
1. Что такое проекция Фишера 2. Что такое L Isomer – Определение, свойства 3. Что такое D-изомер – Определение, свойства 4. В чем разница между L- и D-изомерами – Сравнение основных различий
Ключевые слова: альдегид, D-изомер, проекция Фишера, изомер, кетон, L-изомер, моносахарид, предпоследний углерод, полисахарид.

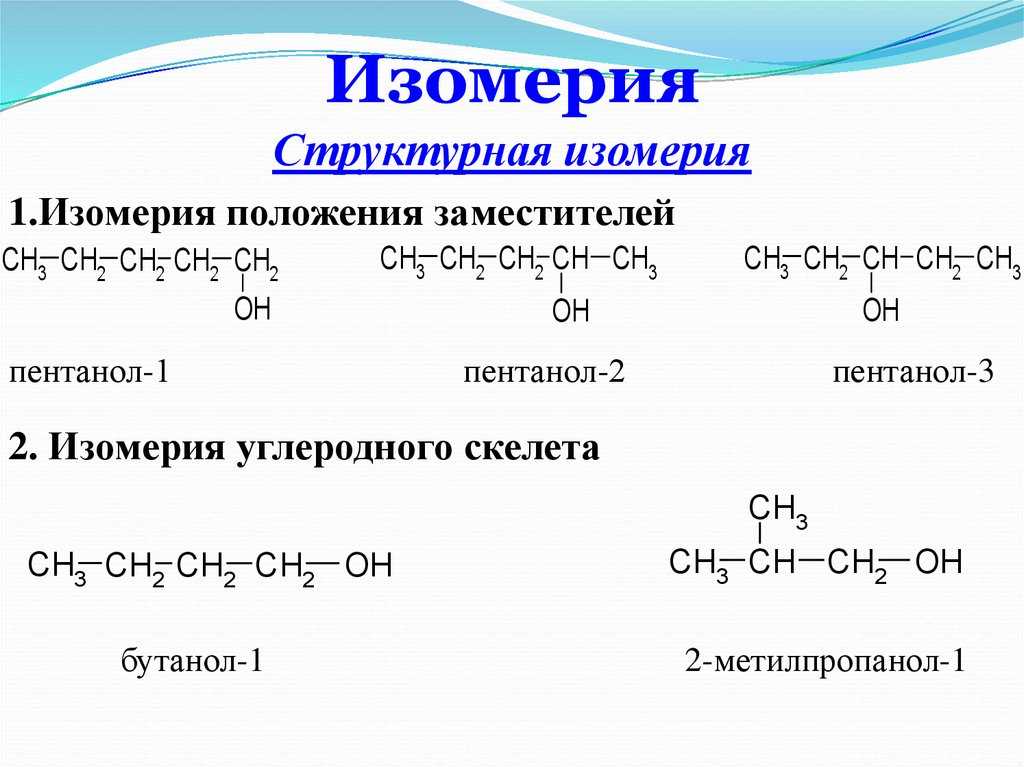
Структурные изомеры
Структурные изомеры – это вещества имеющие сходную формулу структуры вещества, но отличаются по формуле молекулы. Структурные изомеры — это которые идентичны друг другу по количественному и качественному составам, но порядок атомного связывания (химического строения) имеет различия.
Структурные изомеры классифицируются по типу изометрической структуры, виды которой приведены выше, в пункте о видах изомерии.
Структурная формула изомера вещества имеет широкий спектр видоизменений. Некоторыми примерами изомерии могут служить такие вещества, как бутановая кислота, 2-метилпропановая кислота, метил пропионата, диоксан, этил ацетат, изопропиловый формиат имеют одинаковый состав всех трех типов атомов в составе вещества, но различаются по положению атомов в самом соединении.
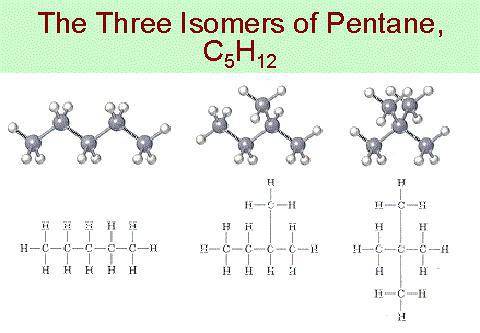
Еще один яркий пример изомерии – это существование пентана, неопентана и изопентана.
Виды изомерии в органической химии
В классификации изомерии выделяют два основных типа изомеров:
- структурные;
- пространственные.
Структурная изомерия
Выделяют несколько видов изомерии по структуре молекулы.
1. Изомерия углеродной цепи.
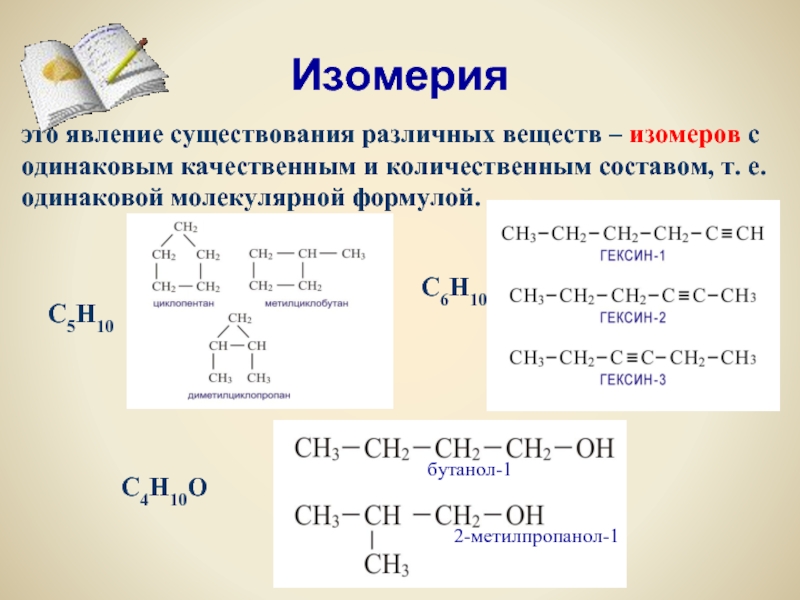
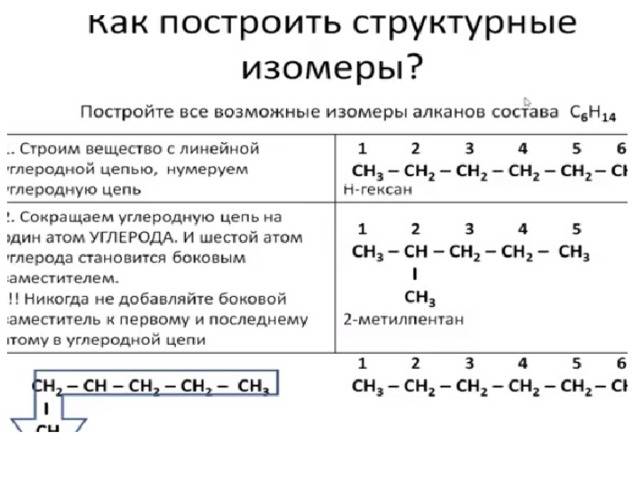
Углеродная цепь или углеродный скелет представляет собой остов молекулы, состоящий из углеродных атомов. Если порядок соединения атомов углерода в молекуле отличается, то вещества являются структурными изомерами по углеродной цепи.
Так, пентану , относящемуся к ряду алканов, свойственны три структурные формулы изомеров.
2. Валентная изомерия.
Валентные изомеры различаются распределением химических связей внутри молекулы. К примеру, для бензола (), помимо стандартной молекулы в форме плоского шестиугольника, известно еще три валентных изомера. Они представлены на изображении ниже.
3. Изомерия положения функциональной группы.
В молекулах органических соединений, не относящихся к классу углеводородов, можно выделить две составляющие части: углеводородный фрагмент (радикал) и функциональная группа.
Функциональная группа — фрагмент органического соединения, определяющий его свойства и принадлежность к определенному классу органических соединений. Например, -CN — цианогруппа (функциональная группа класса нитрилов), -OH — гидроксильная группа (функциональная группа спиртов и фенолов).
Изомеры положения функциональной группы отличаются расположением функциональной группы в молекулах. В качестве примера рассмотрим изомеры хлорпентана — вещества, относящегося к классу галогенпроизводных углеводородов. В хлорпентане функциональной группой является -Cl. Его изомеры, отличающиеся положением функциональной группы:
4. Межклассовая изомерия.
Межклассовые изомеры — вещества, имеющие одинаковый количественный и качественный состав, но относящиеся к различным классам органических соединений. Поскольку молекулы таких изомеров содержат различные функциональные группы, такой вид изомерии также называют изомерией функциональной группы.
Спирты (соединения с функциональной группой -ОН) изомерны простым эфирам (веществам с функциональной группой -О-). Например, этанол является межклассовым изомером диметилого эфира:
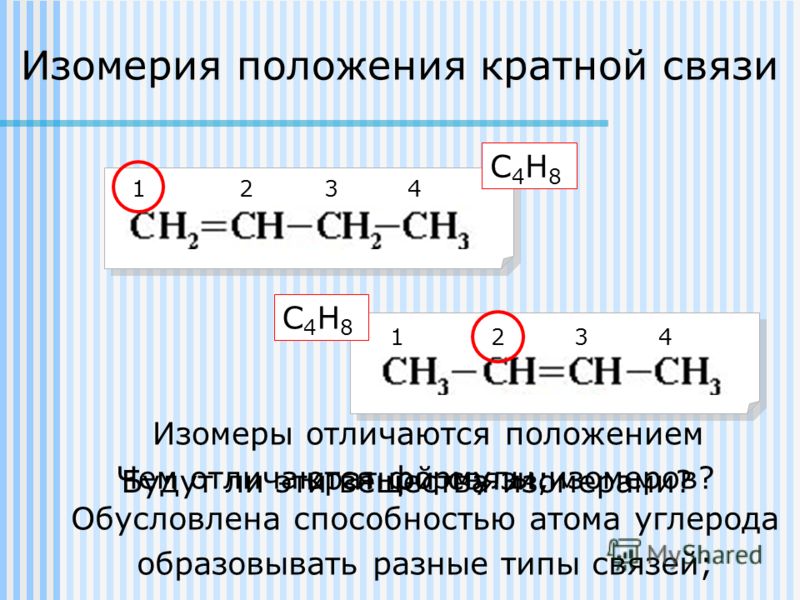
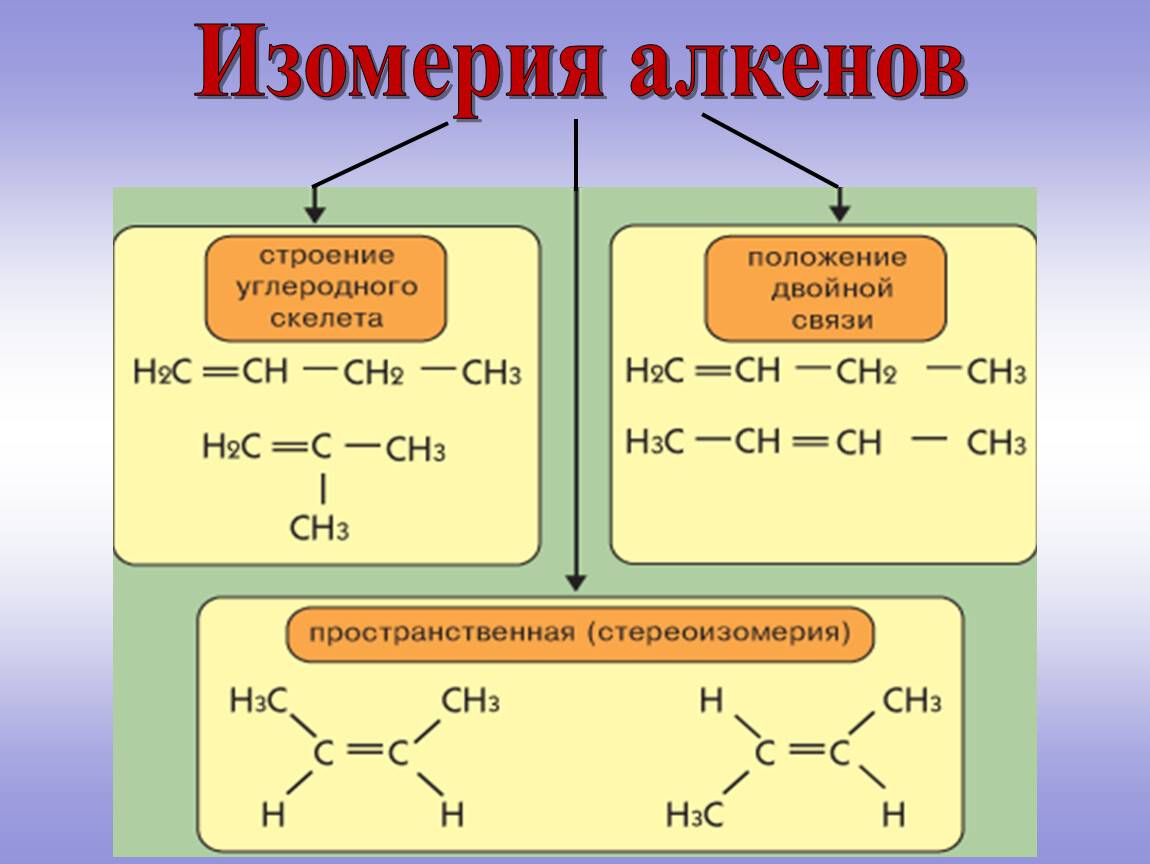
5. Изомерия положения кратной связи
Подобно изомерии положения функциональной группы, изомеры данного вида отличаются расположением элемента в углеродной цепи. В данном случае такой элемент — кратная связь. Рассмотрим изомеры бутена по положению двойной связи:
СН–СН–СН=СН — это бутен-1
СН–СН=СН–СН — это бутен-2
Пространственная изомерия (стереоизомерия)
Структурные формулы пространственных изомеров могут быть одинаковыми, но молекулы при этом будут отличаться расположением атомов в пространстве, т.е. будут иметь различные пространственные формулы. Химики выделяют два вида пространственной изомерии:
- оптическая (энантиомерия);
- геометрическая (цис- и трансизомеры).
Рассмотрим подробнее каждый из типов.
1. Оптическая изомерия (энантиомерия).
Оптическую изомерию также называют зеркальной. Оптические изомеры (энантиомеры) — это молекулы, которые являются зеркальными отражениями друг друга. Такой вид изомерии возникает, когда у одного атома углерода появляется четыре разных заместителя. Эти атомы углерода называются ассиметрическими, или хиральными (от греч. хиро — рука, поскольку наши руки также являются зеркальными отражениями друг друга). Таким образом оптические изомеры различаются порядком расположения заместителей вокруг асимметричного центра. На практике такие изомеры различаются по направлению вращения плоскости поляризации плоскополяризованного света. Один из оптических антиподов является правовращающим (вращает плоскость поляризации вправо, его обозначают знаком «+»), а другой — левовращающим (вращает плоскость поляризации влево, обозначают знаком «−»).
Оптическая изомерия характерна для многих классов природных органических соединений (углеводов, аминокислот). Например, на рисунке представлены оптические изомеры аминокислоты аланина:
2. Геометрическая изомерия.
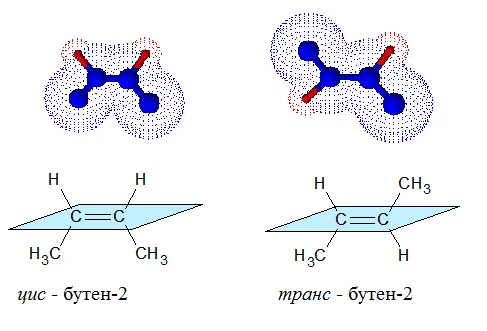
Геометрическая изомерия также называется цис,транс-изомерией, показывает разное положение заместителей относительно цикла или двойной связи.
Когда заместители находятся по одну сторону двойной связи (плоскости цикла), то вещество называют цис-изомером. Если заместители расположены по разные стороны, то речь идет о транс-изомерах. Пример — это цис-бутен-2 и транс-бутен-2.
На изображении ниже транс-бутен-2 представлен слева, а цис-бутен-2 — справа.
Изомерия углеводородного скелета
Насыщенные углеводороды, содержащие от одного до трех атомов углерода (метан, этан, пропан), не имеют изомеров. Для соединения с четырьмя атомами углерода С 4 Н 10 (бутан) возможно существование двух изомеров, для пентана С 5 Н 12 – трех изомеров, для гексана С 6 Н 14 – пяти (рис.2):
Рис.2.
С увеличением числа атомов углерода в молекуле углеводорода количество возможных изомеров резко возрастает. Для гептана С 7 Н 16 существует девять изомеров, для углеводорода С 14 Н 30 – 1885 изомеров, для углеводорода С 20 Н 42 – свыше 366 000. В сложных случаях вопрос о том, являются ли два соединения изомерами, решают, используя различные повороты вокруг валентных связей (простые связи это допускают, что в определенной степени соответствует их физическим свойствам). После перемещения отдельных фрагментов молекулы (не допуская при этом разрыва связей) накладывают одну молекулу на другую. Если две молекулы полностью совпадают, то это не изомеры, а одно и то же соединение. Изомеры, отличающиеся структурой скелета, обычно имеют разные физические свойства (температура плавления, температура кипения и т.п.), что позволяет отделить один от другого. Изомерия такого типа существует и у ароматических углеводородов (рис.4).
Теория А.М. Бутлерова
1. Атомы в молекулах соединены между собой в определенной последовательности химическими связями в соответствии с их валентностью. Порядок связи атомов называется их химическим строением. Углерод во всех органических соединениях четырехвалентен.
2. Свойства веществ определяются не только качественным и количественным составом молекул, но и их строением.
3. Атомы или группы атомов взаимно влияют друг на друга, от чего зависит реакционная способность молекулы.
4. Строение молекул может быть установлено на основании изучения их химических свойств.
Органические соединения обладают рядом характерных особенностей, которые отличают их от неорганических. Почти все они (за редким исключением) горючи; большинство органических соединений не диссоциирует на ионы, что обусловлено природой ковалентной связи в органических веществах. Ионный тип связи реализуется только в солях органических кислот, например, CH3COONa.
Гомологический ряд
– это бесконечный ряд органических соединений, имеющих сходное строение и, следовательно, сходные химические свойства и отличающихся друг от друга на любое число СН2– групп (гомологическая разность).
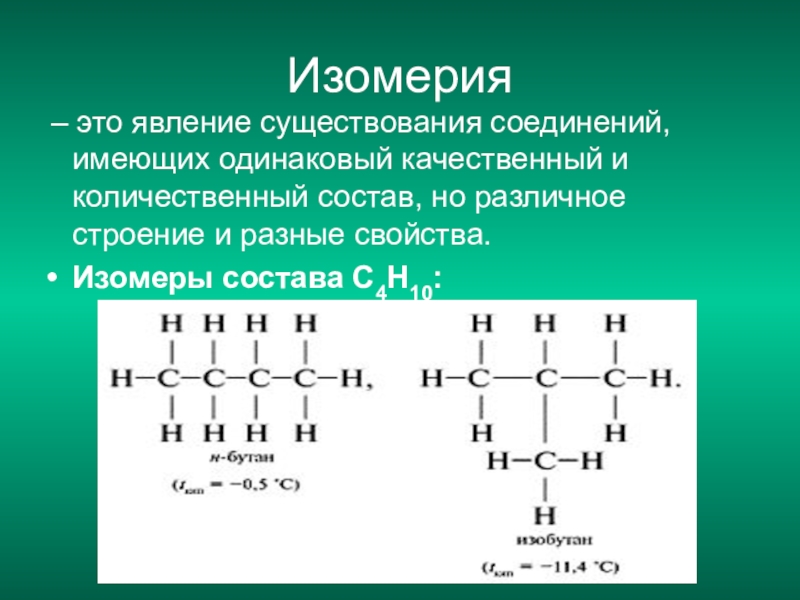
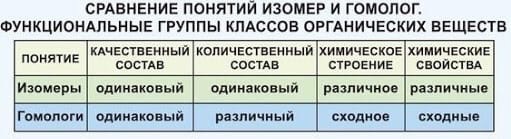
Еще до создания теории строения были известны вещества одинакового элементного состава, но c разными свойствами. Такие вещества были названы изомерами, а само это явление – изомерией.
В основе изомерии, как показал А.М. Бутлеров, лежит различие в строении молекул, состоящих из одинакового набора атомов.
Изомерия
– это явление существования соединений, имеющих одинаковый качественный и количественный состав, но различное строение и, следовательно, разные свойства.
Различают 2 вида изомерии: структурную
изомерию и пространственную
изомерию.
Изомерия органических соединений
В органической химии изомеры широко распространены, их суть заключается в том, что существует множество различных веществ, имеющих одинаковый молекулярный тип, но различную структуру и, следовательно, различные химические и физические свойства. В этом случае знание только молекулярного типа не дает полного представления о свойствах вещества. Знание структурного (графического) типа вещества может дать нам такое представление.
Существуют различия между строительными блоками, положениями, геометриями (CIS, trans) и оптическими изомерами органических соединений.
Структурная изомерия органических соединений
В этом случае порядок превращения индивидов в изомеры одинаков, но их пространственное расположение различно. Эти изомеры называются пространственными или стереоизомерами. Стереоизомеры, стереогруппы которых представляют собой многочисленные связи или маленькие круги, называются геометриями.
Наличие геометрических изомеров позволяет нескольким связям иметь функциональные группы. Разница между изомерами заключается в пространственном расположении рабочих групп по отношению к уровню двойных связей.
Названия этих изомеров производятся с помощью цис- и транс-.
В цис-сомере два одинаковых заместителя у разных атомов углерода с двойной связью находятся по одну сторону от двойной связи.
В трансмономере идентичные заместители находятся на противоположных сторонах двойной связи.
Если все заместители в пределах нескольких связей различны, используются названия e, z (entgegen- «z» от zusammen — вместе). Чтобы определить тип конфигурации (e- или z-), необходимо сравнить древность заместителей, т.е. индивидуальные номера.
Z-конфигурация имеет один изомер с двумя верхними заместителями на одной стороне двойной связи, а e-конфигурация имеет один изомер с двумя верхними заместителями на противоположной стороне двойной связи.
Например, тип 1-бром-1-хлор-2-2-нителия показан на схеме. Изомеры этилена имеют следующие заместители: H (атомный номер -1), BR (атомный номер -35), N (атомный номер -7), CL (атомный номер -17).
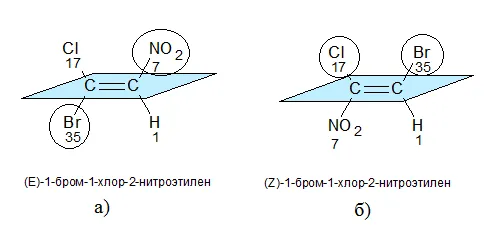
(a) первый атом углерода имеет BR (35) в качестве верхнего заместителя, а второй атом углерода имеет N (7). Эти заместители находятся на противоположных сторонах нескольких связей. Поэтому он является изомером e.
(b) первый атом углерода имеет верхний заместитель (17), а второй атом углерода имеет Br (35). Эти заместители находятся на одной стороне нескольких связей. Следовательно, это изомер Z.
Если заместители, связанные непосредственно с ненасыщенным атомом углерода («первый слой»), одинаковы, то заместители во «втором слое» сравниваются с «третьим слоем».
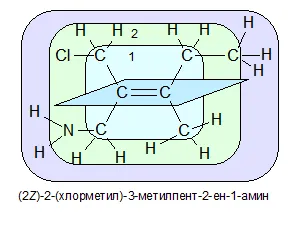
В представленном примере все заместители «первого слоя» одинаковы — это C. Поэтому необходимо изучить «второй слой». Во втором слое первый уголь, присоединенный к двойной связи, имеет CL в качестве верхнего заместителя — второй атом углерода C.
Оптическая изомерия органических соединений
В начале 19 века было обнаружено, что некоторые вещества отклоняют уровень поляризации под определенным углом, когда через них проходит поляризованный свет. Кроме того, существуют два (изомерных) соединения, которые отклоняют уровни поляризации с одинаковой величиной, но разными знаками (слева и по часовой стрелке). Такие вещества называются изомерами (противоположными или анти-изомерами).
Смеси, содержащие равные количества левого и правого изомеров, визуально инертны и называются ракельными смесями.
Визуальная активность характерна для веществ, содержащих один или несколько асимметричных атомов углерода (т.е. углеродов, связанных с четырьмя различными заместителями). Например:.
Два визуальных изомера различаются как объекты и их кумиры. Когда они накладываются друг на друга, они не совпадают, как левая рука и правая рука, когда они накладываются друг на друга. Такие молекулы называются молекулами ручной работы (греч. ‘hand’ — рука). С другой стороны, если молекула совпадает со своим кумиром, она беспрепятственно движется.
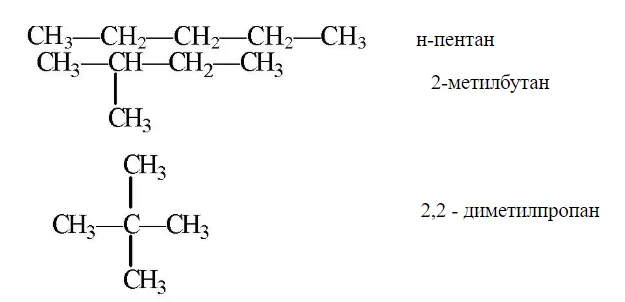
В органических молекулах соединения, содержащие такие индивиды, как кремний, азот и фосфор, в дополнение к углеродам, связанным с четырьмя различными заместителями, могут иметь стереоось или уровень, а также руководство.
На уровнях оптические изомеры рисуются в проекции Фишера типа
Вывод
Термины аллотропы и изомеры совершенно не похожи. У них разная природа и функциональность. Аллотропы – это несколько химических соединений, образованных из одного элемента, которые имеют различные химические формулы и устройства. Напротив, изомеры – это химические соединения, которые имеют сходные молекулярные формулы, но разные структурные формулы.
Изомеры состоят из различных элементов, тогда как аллотропы состоят из одного и того же элемента. В основном существует два типа изомерии; структурная изомерия и стереоизомерия.
Аллотропы одного элемента могут существовать в разных состояниях. С другой стороны, аллотропия ограничивается твердыми материалами. Они действительно имеют сопоставимые характеристики благодаря своему составу. Это применимо только к элементам, но не к соединениям.
Изомеры – это химические соединения, которые имеют сходную молекулярную формулу, но различаются структурными формулами. Их характеристики не всегда одинаковы. Функциональная группа определяет это.