Как определить, является ли основание растворимым, то есть щелочью, если его нет в таблице растворимости?
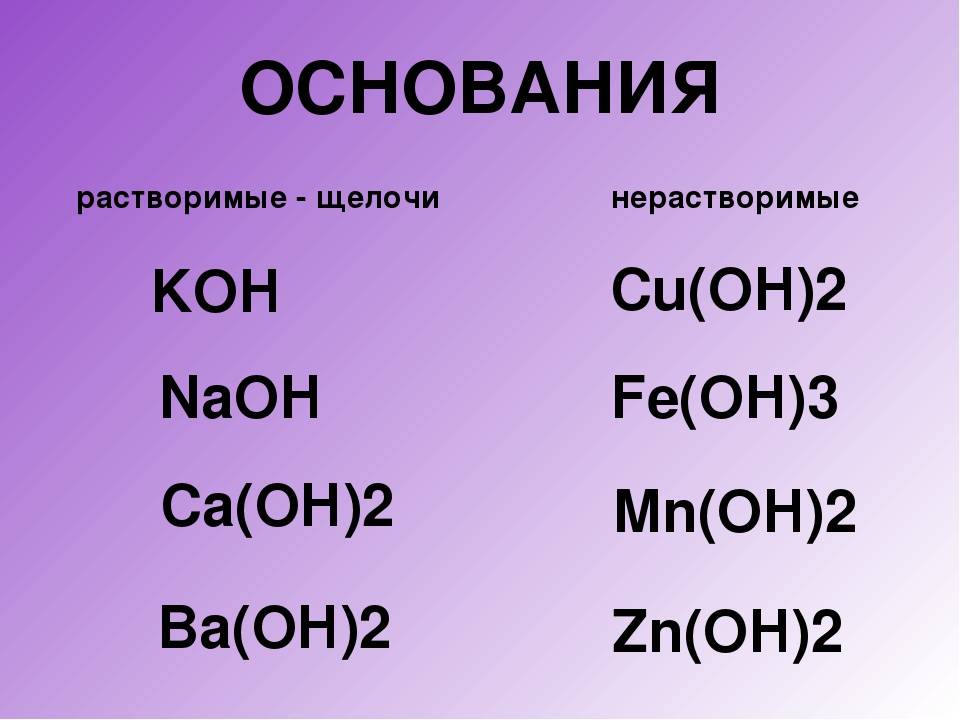
В состав щелочей входят металлы IА-группы Периодической Системы Д. И. Менделеева, а также кальций, стронций и барий.
Полный список щелочей:
NaOH – гидроксид натрия, едкий натр, гидроокись натрия, каустическая сода
KOH – гидроксид натрия, едкое кали, гидроокись калия
LiOH – гидроксид лития, гидроокись лития
CsOH – гидроксид цезия, гидроокись цезия
FrOH – гидроксид франция, гидроокись франция
RbOH – гидроксид рубидия, гидроокись рубидия
Ba(OH)2 – гидроксид бария, едкий барий, баритовая вода
Ca(OH)2 – гидроксид кальция, гашеная известь, известковое молоко, известковая вода.
Sr(OH)2 – гидроксид стронция
Остальные основания считаем нерастворимыми (кроме аммиака, образующего гидрат аммония, являющегося хоть и растворимым, но нестойким соединением). Гидроксид аммония, образующийся при пропускании аммиака через воду, можно представить в виде формулы NH4OH (лучше NH3·H2O – гидрат аммония) является растворимым (раствор называют нашатырным спиртом), однако щелочью это вещество не является.
Гидроксид лития и гидроксид кальция растворяются не так хорошо, как другие основания, но все равно считаются щелочами.
Задание в формате ЕГЭ с ответом:
- Ga(OH)3
- RbOH
- Cr(OH)2
- щелочь
- нерастворимое основание
- амфотерный гидроксид
Ответ:
| А | Б | В |
|---|---|---|
Ответить
Комментарий к заданию: Галлий, в представленном гидроксиде, имеет степень окисления +3, поэтому он относится к группе амфотерных гидроксидов. Гидроксид рубидия – щелочь, так как рубидий – элемент IА-группы. Гидроксид хрома – нерастворимое основание, так как хром в степени окисления +2 не является амфотерным, и не относится к щелочным или щелочноземельным металлам, поэтому не может образовать щелочь.
Пример задания из КИМ ЕГЭ:
- Sr(OH)2
- Zn(OH)2
- Fe(OH)2
- щелочь
- нерастворимое основание
- амфотерный гидроксид
Ответ:
| А | Б | В |
|---|---|---|
Ответить
Комментарий к заданию: Стронций является щелочноземельным металлом (металлы IIА-группы, кроме магния и бериллия, образуют растворимые гидроксиды), поэтому образует щелочь. Гидроксид цинка вместе с гидроксидом бериллия входят в группу исключений и, несмотря на вторую валентность, образуют амфотерные гидроксиды. Гидроксид железа нерастворим и не входит в группу амфотерных веществ, он является нерастворимым основанием.
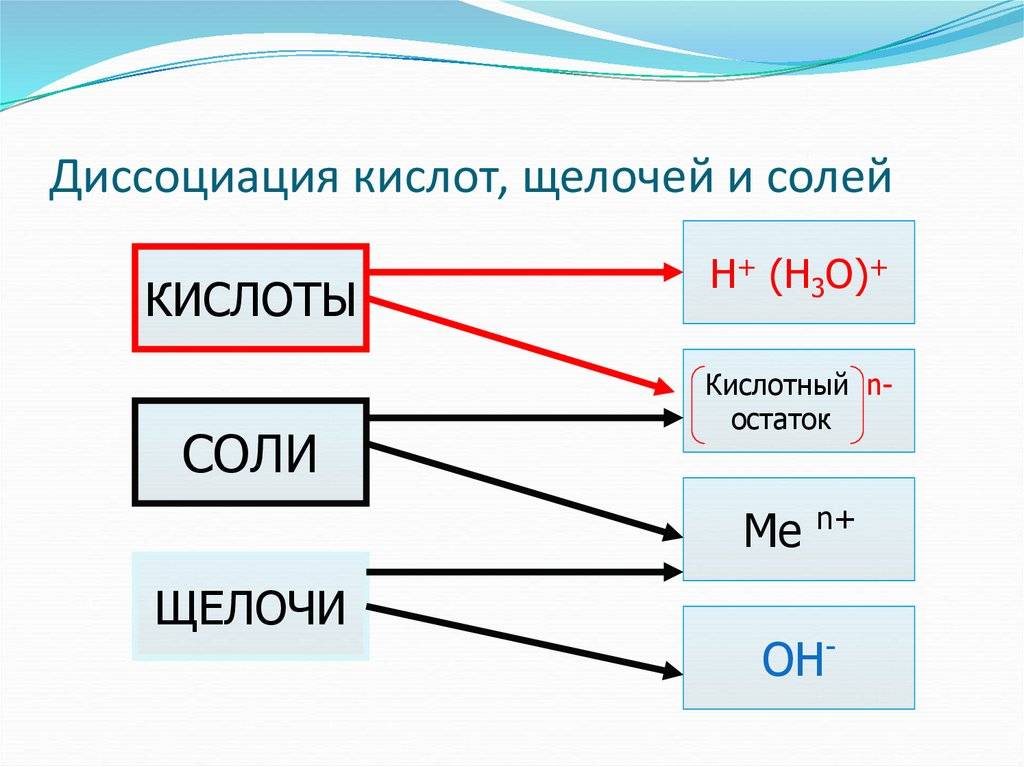
Щёлочи, являясь сильными основаниями, диссоциируют в воде очень быстро, тогда как нерастворимые основания диссоциируют медленно, ступенчато:
Диссоциация щелочей | Диссоциация слабых оснований |
Ca(OH)2 = Ca2+ + 2OH‒ | Fe(OH)2 = FeOH+ + OH‒ (I ступень) FeOH+ = Fe2+ + OH‒(II ступень) |
Диссоциация настолько быстрая, что ступенчатостью процесса можно пренебречь | Диссоциация очень медленная, быстрее идет по первой ступени, по второй ступени практически не идёт |
Основные различия между кислотой и основанием
Ниже приведены важные моменты, которые отличают кислоты от кислоты основания:
- Согласно концепции Аррениуса : кислота – это вещество, когда растворяется в воде, увеличивает концентрацию ионов H +, тогда как основа – это вещество, когда растворяется в воде, увеличивает концентрацию ионов OH–.
- С другой стороны, концепция Бронстеда-Лоури гласит, что кислоты являются донорами протонов, а основа – акцепторами протонов.
- Теория Льюиса объясняет их как такие разновидности, которые принимают пару электронов (электрофил) и будут иметь свободные орбитали, известные как кислота Льюиса, в то время как такие разновидности, которые жертвуют пару электронов (нуклеофил) и будут иметь одиночную пару электронов, являются известный как база Льюиса.
- Химическая формула кислоты начинается с Н, например, HCl (соляная кислота), H3BO3 (борная кислота), CH2O3 (угольная кислота). Хотя CH3COOH (уксусная кислота) является исключением, тогда как такие соединения, химическая формула которых заканчивается на OH, например, KOH (калий) гидроксид), NaOH (гидроксид натрия) известен как основание. Шкала рН (концентрация ионов водорода в растворе) составляет менее семи, тогда как в основании она превышает 7.
- Кислоты кислые, дают ощущение жжения, обычно липкие, реагируют с металлами с образованием газообразного водорода. Хотя основания противоположны, поскольку они горькие, как правило, без запаха (кроме аммиака), они скользкие; основы реагируют с жирами и маслами.
- В фенолфталеине индикаторные кислоты остаются бесцветными, а основа дает розовый цвет . Хотя в лакмусовой бумаге тестовые кислоты превращают синюю лакмусовую бумагу в красную, а красная лакмусовая бумажка в синий.
- Сила кислот зависит от концентрации ионов гидроксония, в то время как сила зависит от концентрации ионов гидроксида.
- Кислоты диссоциируют, давая свободные ионы водорода (Н + ) при смешивании в воде, тогда как основания диссоциируют, давая свободные ионы гидроксида (ОН– ) при смешивании в воде.
- Несколько примеров кислот: соляная кислота (HCl), серная кислота (H2SO4), азотная кислота (HNO3), угольная кислота (H2CO3). Примерами оснований являются гидроксид аммония (NH4OH), гидроксид кальция (Ca (OH) 2), гидроксид натрия (NaOH).
Вывод
Стоит иметь краткое представление о некоторых основных физических и химических принципах, которые прямо или косвенно связаны с жизнью. Кислоты и основания являются одними из них. В приведенном выше содержании мы обсудили их вместе с их свойствами. Мы обсудим три важные теории с некоторыми примерами. Мы заключаем, что это важная часть жизни, и мы часто используем их не только в химической лаборатории, но и в повседневной работе.
Кислоты и щелочи в нашем организме
Для переваривания пищи организм использует желудочный сок, в состав которого входят соляная кислота и различные ферменты. Иногда, особенно после переедания, мы можем почувствовать боль в желудке. Чаще всего для снятия неприятных ощущений достаточно принять антацидный, или противокислотный, препарат, основное действие которого направлено на нейтрализацию соляной кислоты в желудке. Как правило, все антациды – щелочи, и именно они нейтрализуют повышенную активность кислот.
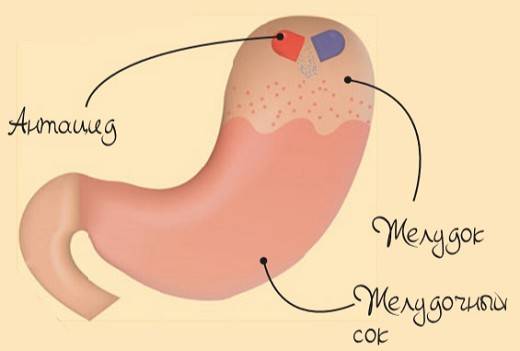
Ответ на этот вопрос, как всегда, звучит примиряюще – важна гармония! Идеальный кислотно-щелочной баланс организма человека нейтральный – pH 7,36. Этот важный показатель, отвечающий за здоровье и долголетие, каждый может измерить в домашних условиях.
Если анализ показал кислотную среду (pH меньше 7,36), значит, что у вас развивается ацидоз, т.е снижается усвоение необходимых организму минералов: калия, кальция, магния, натрия. Последствием дефицита этих важных веществ уже скоро могут стать снижение иммунитета, хрупкость костей, слабость. А потом могут начаться боли в суставах и мышцах, проблемы с сердцем и кровообращением, скачки давления, мочекаменная болезнь и диабет. Также следует знать, что ацидоз предрасполагает к опухолям, в том числе злокачественым.
Если же показатель pH более 8,5, т.е. слишком сдвинут в сторону щелочи, то это тоже непорядок: может начаться дисфункция работы всего ЖКТ, плохое усвоение пищи и дурной запах изо рта. Но главное следствие щелочного сдвига pH вашего организма – захламление крови токсинами. Это состояние приводит к хроническим запорам, проблемам с печенью и, как следствие, к аллергии, невозможности противостоять грибковым заболеваниям и, опять же, склонности к онкологии.
Таким образом, для нормального функционирования организма человека, для правильного течения всех биохимических реакций необходимы и кислоты, и щелочи.
Однако не так давно стали появляться научные теории, в которых «окисление» напрямую связывается со старением организма, а борьба со старением стала приравниваться к борьбе с кислотностью, даже появилось название класса веществ–участников этой борьбы, получивших названием «антиоксиданты».
В основе этих теорий лежат факты: новорожденный ребенок имеет щелочной рН, равный 8-8,5. Щелочными являются такие жизненно важные среды организма как слюна человека, его слезы, женское грудное молоко и мужская семенная жидкость, панкреатический секрет. В отличие от желудочного сока с его высокой кислотностью, среда кишечника, особенно тонкого – преимущественно щелочная.
Поэтому сегодня особенно популярны теории Иосифа Локэмпер и Петера Ентшуры, итальянского доктора Симончини, который предлагает онкобольным проводить щелочную терапию, им вторит наш профессор Неумывакин, рекомендующий лечить целый ряд недугов пищевой содой – самой распространенным бытовым карбонатом.
И все же не стоит увлекаться экстремальными научными веяниями и опытам над собственным организмом. В организме, как и в любой природной системе, важна естественная гармония, которая, подчас, является очень тонкой и хрупкой
Доказательство – возьмем кислотно–щелочной баланс такой важной субстанции как кровь. Нормальный показатель рН человеческой крови 7,36-7,42
При самом незначительном сдвиге его в ту или иную сторону на 0,1 человек приобретает серьезную патологию, при сдвиге на 0,2 – впадает в кому, а при изменении всего лишь на 0,3 – умирает.
Поэтому мы предлагаем поддерживать свой кислотно-щелочной баланс с помощью правильного питания. Ученые рекомендуют сформировать рацион так, чтобы на 80% он состоял из щелочных продуктов и лишь на 20% – из кислотных.
К щелочным относятся практически вся растительная пища, овощи и фрукты. Особенно (как ни странно!) лимоны; все виды огородной зелени; корнеплоды, такие как свёкла, редис, морковь; сельдерей; огурцы; чеснок; овощи крестоцветного вида и авокадо. Все это необходимо как можно чаще включать в свой рацион.
К сильно «закисляющим» наш организм продуктам относятся простые углевода – хлебо-булочные изделия из белой муки, разнообразная сдоба, макароны, шоколад и какао, пиво и сладкие безалкогольные напитки, а также говядина, свинина, моллюски, сыры. А из натурального растительного – грецкие орехи и арахис, черника, клюква, чернослив.
Важно помнить, что при нарушении гармонии веществ-антагонистов – кислот и щелочей – для нашего организма чревато дискомфортом и печальными последствиями. Однако пр разумном подходе каждый из нас может стать «хозяином» собственного кислотно-щелочного баланса! А значит – и здоровья, и активного долголетия
Щелочи – это едкие, твердые и легкорастворимые основания. Кислоты, как правило, кислые жидкости.
Безопасность и предосторожности при работе с кислотами и щелочами
При работе с кислотами и щелочами необходимо соблюдать определенные меры безопасности и предосторожности. Неправильное обращение с химическими веществами может привести к опасным последствиям для здоровья человека и окружающей среды
В данном разделе мы рассмотрим основные меры безопасности при работе с кислотами и щелочами.
Перед началом работы необходимо ознакомиться с технической документацией и специальными инструкциями по безопасности, предоставленными производителем химических реагентов
Эти документы содержат информацию о мерах предосторожности, правилах хранения и обращения с кислотами и щелочами
Одна из основных мер безопасности при работе с кислотами и щелочами — использование специального защитного оборудования. Работникам необходимо надевать защитные очки, резиновые перчатки, халаты, маски и другие средства индивидуальной защиты. Это позволит избежать контакта химических веществ с глазами, кожей и дыхательными путями.
При работе с кислотами и щелочами следует также обращать особое внимание на проведение работ в хорошо проветриваемых помещениях или под вытяжными шкафами. Это поможет избежать накопления вредных паров и газов в воздухе, что может привести к отравлению
| Меры безопасности | Кислоты | Щелочи |
|---|---|---|
| Хранение | Хранить в хорошо закрытых контейнерах, отдельно от других веществ | Хранить в хорошо закрытых контейнерах, отдельно от других веществ |
| Разбавление | Добавлять кислоту в воду, а не воду в кислоту | Добавлять щелочь в воду, а не воду в щелочь |
| Нейтрализация | Использовать щелочь для нейтрализации | Использовать кислоту для нейтрализации |
| Утилизация | Утилизировать в соответствии с региональными правилами и принятой классификацией отходов | Утилизировать в соответствии с региональными правилами и принятой классификацией отходов |
Не рекомендуется проводить работы с кислотами и щелочами в одиночку. При возникновении аварийной ситуации необходимо немедленно вызвать специалистов или других опытных работников. В случае контакта кислоты или щелочи с кожей или глазами, необходимо немедленно промыть зону контакта большим количеством воды и обратиться к врачу.
Соблюдение указанных мер безопасности и предосторожности поможет предотвратить возникновение аварийных ситуаций и минимизировать риск получения травм и отравлений при работе с кислотами и щелочами
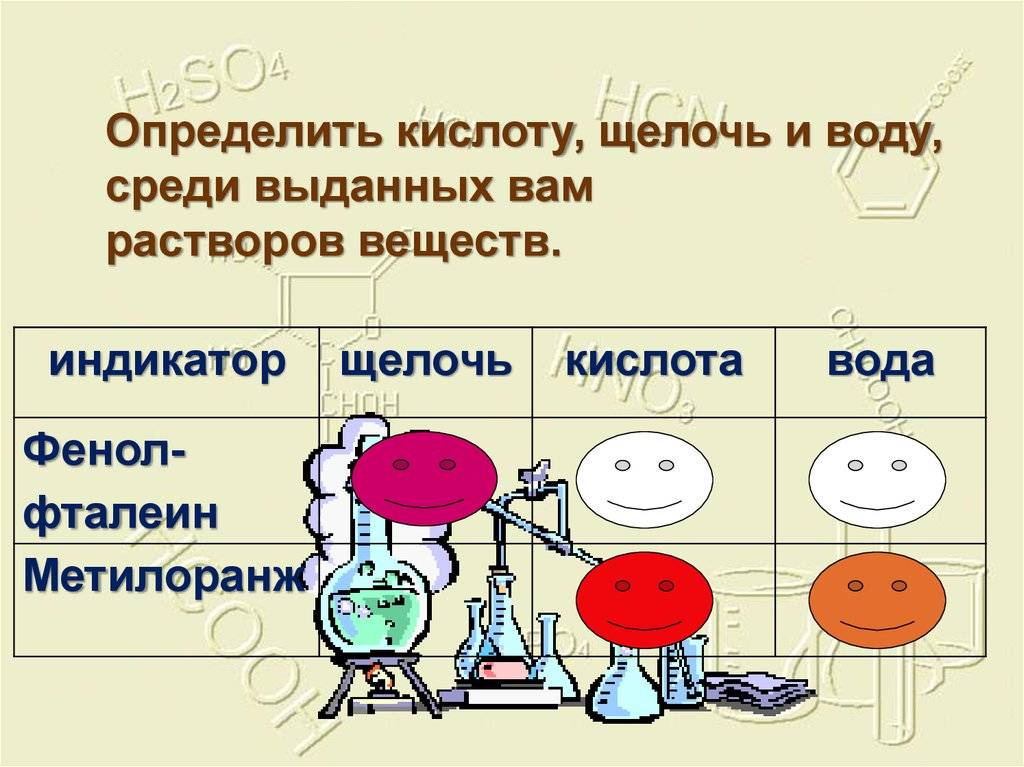
Кислота или щелочь?
Пробовать неизвестную жидкость на ощупь или на вкус, чтобы определить, это кислота или щелочь, чрезвычайно опасно и может оказаться даже смертельным. Обычно такое проделывают с помощью индикатора. Индикатор — это вещество, меняющее цвет при добавлении его в кислоту или щелочь. Самым известным индикатором является лакмус. Его используют в виде раствора или сухой полоски бумаги, пропитанной этим веществом. В обычном виде лакмус розового цвета. При добавлении его к кислоте цвет меняется на красный, а к щелочи— на синий. Если окраска лакмуса не меняется, то вещество, к которому его добавили, не является ни кислотой, ни щелочью, оно нейтрально.
 В средние века ужасная болезнь чума убивала миллионы людей. Тела покойников обливали известью, сильной едкой щелочью. Известь убивала микробы и способствовала быстрому разложению тел.
В средние века ужасная болезнь чума убивала миллионы людей. Тела покойников обливали известью, сильной едкой щелочью. Известь убивала микробы и способствовала быстрому разложению тел.
Кислоты и щелочи широко используют в промышленности. Каждый год производят миллионы тонн серной кислоты. Ее используют в автомобильных аккумуляторах, в производстве моющих средств, взрывчатых веществ, удобрений и красителей.
Кислоты и щелочи очень важны для земледелия и лесного хозяйства. Любое растение лучше всего растет на почве определенного типа: кислой, нейтральной либо щелочной. Тип почвы можно изменить с помощью добавок. Так, внесение извести в кислую почву превращает ее в нейтральную.
(едкий натр), KOH (едкий калий), Ba(OH) 2 (едкий барий). В качестве исключения можно отнести к щелочам гидроксид одновалентного таллия TlOH , который хорошо растворим в воде и является сильным основанием. Едкие щёлочи – тривиальное название гидроксидов лития LiOH , натрия NaOH , калия КОН , рубидия RbOH , и цезия CsOH .
Соли
С представителями веществ этого класса вы встречаетесь ежедневно на кухне, в быту, на улице, в школе, сельском хозяйстве.
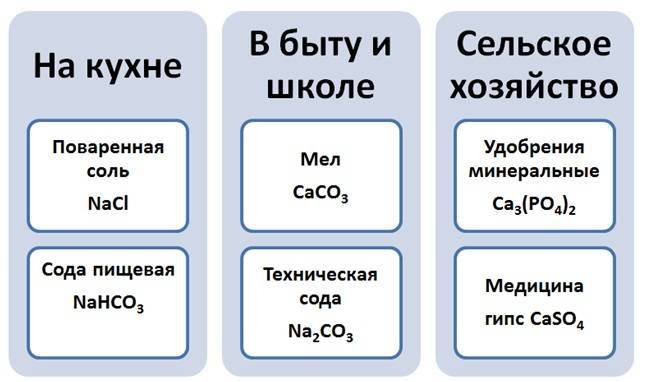
Объединяет все эти вещества, что они содержат атомы металла и кислотный остаток. Исходя из этого, дадим определение этому классу.

Средние соли – это продукт полного обмена между веществами, в которых содержатся атомы металла и кислотный остаток (КО) (мы помним, что это часть чего-то, которая не имеет возможности существовать отдельно).
Выше было рассмотрено 3 класса соединений, давайте попробуем подобрать комбинации, чтобы получить соли, типом реакции обмена.
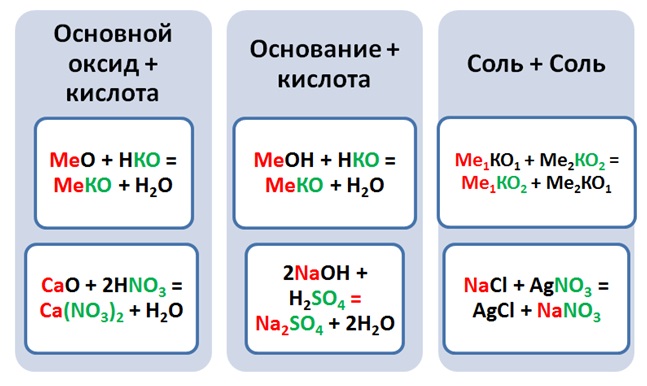
Чтобы составить название солей, необходимо указать название кислотного остатка, и в родительном падеже добавить название металла.
Ca(NO3)2– нитрат (чего) кальция, CuSO4– сульфат (чего) меди (II).
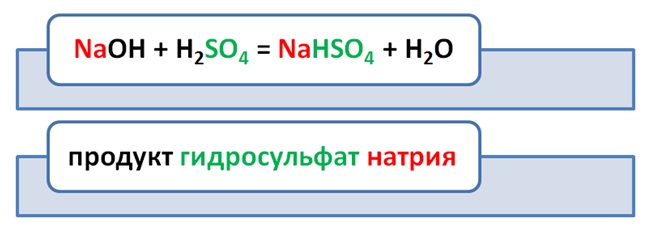
Наверняка многие из вас что-то коллекционировали, машинки, куклы, фантики, чтобы получить недостающую модель, вы менялись с кем-то своей. Применим этот принцип и для получения солей. К примеру, чтобы получить сульфат натрия необходимо 2 моль щёлочи и 1 моль кислоты. Допустим, что в наличии имеется только 1 моль NaOH, как будет происходить реакция? На место одного атома водорода станет натрий, а второму Н не хватило Na. Т.е в результате не полного обмена между кислотой и основанием получаются кислые соли. Название их не отличается от средних, только необходимо прибавить приставку гидро.
Однако бывают случаи, с точностью наоборот, не достаточно атомов водорода, чтобы связать ОН-группы. Результатом этой недостачи являются основные соли. Допустим реакция происходит между Ва(ОН)2 и HCl. Чтобы связать две гидроксильные группы, требуется два водорода, но предположим, что они в недостаче, а именно в количестве 1. Реакция пойдёт по схеме.
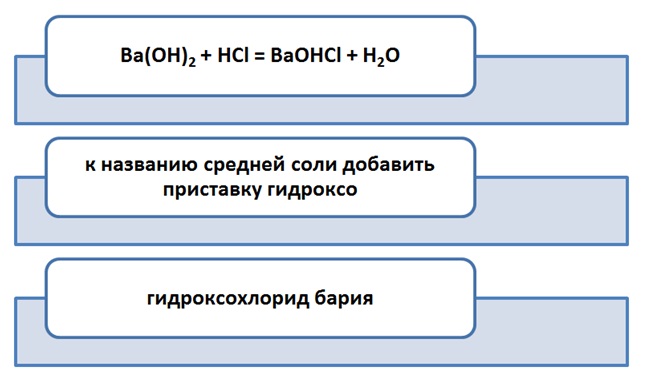
Особый интерес и некоторые затруднения вызывают комплексные соли, своим внешним, казалось,громоздким и непонятным видом, а именно квадратными скобками:K3[Fe(CN)6] или [Ag(NH3)2]Cl. Но не страшен волк, как его рисуют, гласит поговорка. Соли состоят из катионов (+) и анионов (-). Аналогично и с комплексными солями.
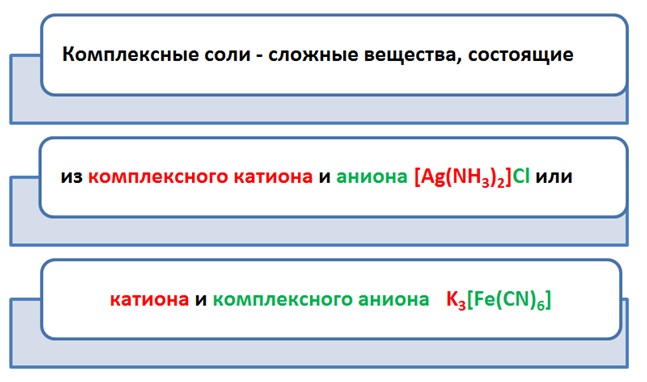
Образует комплексный ион элемент-комплексообразователь, обычно это атом металла, которого, как свита, окружают лиганды.
Теперь необходимо справиться с задачей дать название этому типу солей.

Попробуем дать название K3[Fe(CN)6]. Существует главный принцип, чтение происходит справа налево. Смотрим, количество лигандов, а их роль выполняют циано-группы CN−, равно 6 – приставка гекса. В комплексообразователем будут ионы железа. Значит, вещество будет иметь название гексацианоферрат(III) (чего) калия.

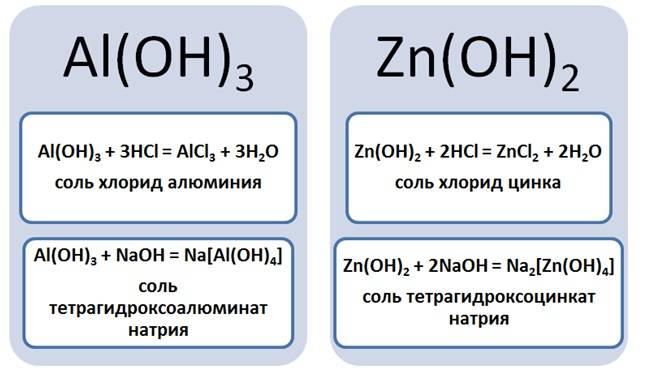
Образование комплексных солей происходит путём взаимодействия, к примеру, амфотерных оснований с растворами щелочей. Амфотерность проявляется способностью оснований реагировать как с кислотами, так и щелочами. Так возьмём гидроксид алюминия или цинка и подействуем на них кислотой и щёлочью.
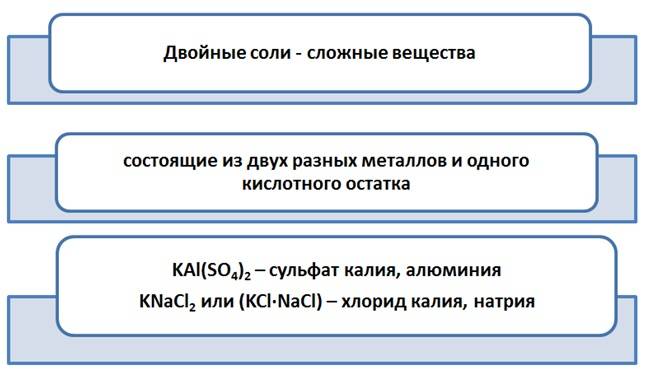
В природе встречаются соли, где на один кислотный остаток приходится два разных металла. Примером таких соединений служат алюминиевые квасцы, формула которых имеет вид KAl(SO4)2. Это пример двойных солей.
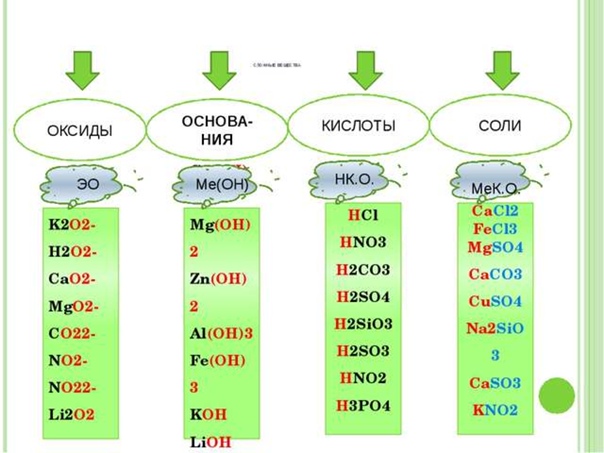
Из всего вышесказанного можно составить обобщающую схему, в которой указаны все классы неорганических соединений.
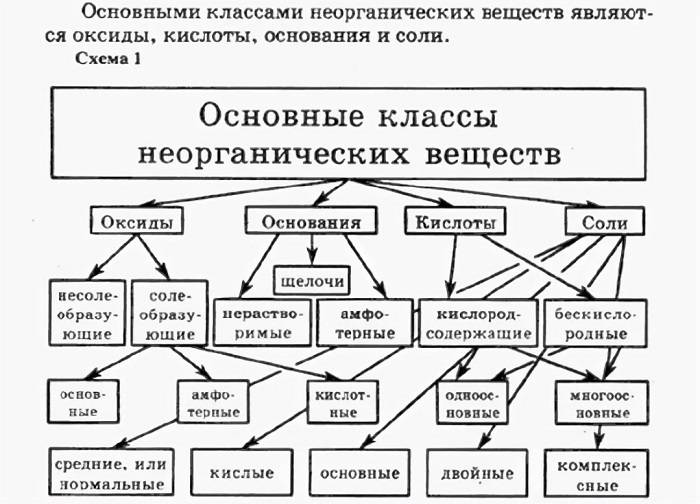
Определение и свойства
Кислоты обычно имеют кислотный вкус, хотя этот признак не всегда применим. Они также способны взаимодействовать с веществами, содержащими кислород, и донорами протона — это основная характеристика кислот. Они образуются при растворении газов, таких как диоксид углерода, в воде, и они могут быть кислотными соединениями, полученными из органических и неорганических источников. Когда кислота растворена в воде, она выделяет положительно заряженные ионы водорода (H+), что приводит к изменению pH раствора.
Щелочи, с другой стороны, обладают щелочным вкусом и способностью принимать протоны. Они обычно образуются при диссоциации минеральных веществ, таких как оксиды и гидроксиды металлов, в воде. Когда щелочь растворена в воде, она выделяет отрицательно заряженные гидроксидные ионы (OH-), что также приводит к изменению pH раствора.
Таким образом, хотя кислоты и щелочи могут иметь сходства, основная разница между ними заключается в их способности выделять водородные и гидроксидные ионы в водном растворе, что влияет на pH раствора.
Кислоты
как правило, цветом, не отличающимся от цвета воды, а также способностью изменять
цвет индикаторов. Они обладают высоким уровнем активности и образуются при
реакции кислорода со многими элементами и соединениями. Кислоты имеют свойства,
которые могут быть определены взаимодействием с щелочами.
Цвет кислот зависит от их состава и концентрации. Некоторые кислоты,
такие как серная и соляная кислоты, имеют цвет безразличный, тогда как
другие, например, хлорная кислота, имеют ярко-зеленый цвет.
Индикаторы используются для определения наличия кислоты или щелочи
в растворе. Они меняют свой цвет в зависимости от pH раствора. Например,
использование фенолфталеина становится красным при контакте с кислотной
средой и безцветным в щелочи.
Кислоты активно взаимодействуют с щелочами, образуя соль и воду.
Это происходит при реакции кислорода с основными металлами, такими как
натрий, калий и кальций. С этой точки зрения кислоты и щелочи являются
противоположными по своим свойствам веществами.
Разница между кислотами и щелочами заключается в их сходстве,
которое, тем не менее, устроит существенные различия в их химическом
составе, свойствах и воздействии на окружающую среду. Поэтому, необходимо
понимать, что кислоты и щелочи представляют собой различные классы химических
соединений, имеющие собственные характеристики и функции.
Щелочи
Одним из важных характеристик щелочей является их способность образовывать растворы с высоким pH-значением, обычно больше 7. Это происходит из-за присутствия гидроксидных ионов (OH-) в растворах щелочей. Как правило, щелочи имеют горький вкус и они проводят электрический ток в растворе.
Щелочи также могут изменять цвет некоторых индикаторных веществ. Например, показатель pH фенолфталеина становится красным при взаимодействии с щелочью. Это связано с тем, что гидроксидные ионы в щелочах реагируют с индикатором и образуют новое соединение, которое обладает красным цветом.
Однако, различия между щелочами и кислотами становятся более заметными при более подробном рассмотрении их химической структуры и эффектов, оказываемых на другие вещества. Например, кислоты образуются при отделении водорода (H+) и щелочи образуются при отделении гидроксидных ионов (OH-). Это является ключевым различием между ними.
Кислоты и щелочи в природе
Главное различие между кислотами и щелочами заключается в их химическом составе и свойствах. Кислоты содержат водородные ионы (H+) и обычно обладают кислым вкусом. Щелочи, с другой стороны, содержат гидроксидные ионы (OH-) и имеют щелочной вкус.
Однако кислоты и щелочи могут быть определены не только по вкусу. Существуют специальные вещества, называемые индикаторами, которые изменяют цвет в присутствии кислот или щелочей. Например, индикатор фенолфталеин окрашивается в розовый цвет в щелочной среде, в то время как в кислой среде он остается безцветным.
Различие между кислотами и щелочами не только в их составе и вкусе, но и в их реакционной способности. Кислоты реагируют с основаниями, образуя соль и воду. Одна из наиболее известных кислотных реакций — реакция гидроксида натрия (щелочи) с уксусной кислотой, которая приводит к образованию соли (ацетата натрия) и воды.
Таким образом, разница между кислотами и щелочами за их сходством скрываются ключевые различия в составе, вкусе и реакционной способности. В природе существует множество кислот и щелочей, каждая из которых выполняет свою функцию в химических процессах, и это устроит для поддержания жизни на Земле.
Распространенность кислот
Одним из способов определения наличия кислоты в растворе является использование специальных индикаторов. Такие индикаторы обычно меняют цвет в зависимости от pH-значения раствора. Например, кислые растворы обычно окрашиваются в красный или оранжевый цвет.
Разница между кислотами и щелочами заключается в концентрации ионов водорода и гидроксила (OH-) соответственно. В щелочных растворах количество ионов гидроксила превышает количество ионов водорода, в то время как в кислых растворах количество ионов водорода превышает количество ионов гидроксила.
Распространенность кислот в окружающей среде зависит от множества факторов, таких как геологические процессы, метеорологические условия, а также промышленные выбросы и деятельность человека. Большинство кислот, встречающихся в природе, являются слабыми и не представляют опасности для окружающей среды и живых организмов. Однако некоторые кислоты, такие как серная кислота и соляная кислота, могут быть коррозионно активными и вызывать значительные повреждения при контакте с тканями.
Природная составляющая щелочей
Щелочи представляют собой химические соединения, обладающие способностью реагировать с кислотами, образуя соль и воду. Но что же делает щелочи особыми?
Природная составляющая щелочей заключается в том, что они содержат ионы гидроксида (OH-) в своей структуре. Эти ионы обладают особым свойством принимать водородные ионы (H+) от кислот, что приводит к нейтрализации кислоты.
Для определения степени щелочности или кислотности растворов обычно используются специальные индикаторы, которые меняют свой цвет в зависимости от подкисления или подщелачивания среды. Это происходит благодаря взаимодействию индикаторных молекул с ионами водорода — чем больше ионов H+ в растворе, тем сильнее кислотное окисление, и наоборот.
Таким образом, основное различие между кислотами и щелочами состоит в наличии ионов гидроксида в щелочах и ионов водорода в кислотах. Этот маленький, но важный факт придаёт щелочам и кислотам их характерные свойства. Индикаторы позволяют нам легко и удобно определить степень щелочности или кислотности раствора, что устроит любого химика.
Концентрированные кислоты и щелочи
Ядовитые жидкости находятся не только в школьных лабораториях, они и вокруг нас. Это различные средства бытовой химии (стиральные порошки и пятновыводители), цветочные удобрения и ядохимикаты, лаки и краски, клеи и растворители, бензин и дизельное топливо, аккумуляторные, тормозные и прочие технические жидкости, а на кухне – уксус и уксусная кислота.
Совершенно очевидно, что все вышеупомянутые вещества должны использоваться строго по назначению и в соответствии с определенными правилами, указанными на этикетке каждого средства. К сожалению, несоблюдение мер безопасности при работе с ядовитыми средствами может привести к серьезным проблемам со здоровьем: отравлению, различным повреждениям кожи и слизистых оболочек.
Ты уже успел убедиться в том, что вокруг нас – огромное количество кислот и щелочей. Молочные продукты, овощи и фрукты содержат лимонную, яблочную, щавелевую, уксусную, молочную, аскорбиновую и другие кислоты. Трудно поверить, но в косточках вишен и миндаля содержится (хоть и в минимальных количествах) такой сильный яд, как синильная кислота! Известно, что многие насекомые предпочитают защищаться разными кислотами. Никогда не задумывался, почему укусы обыкновенного крошечного муравья бывают такими болезненными? А все потому, что он вспрыскивает в ранку капельки муравьиной кислоты. Эту же кислоту выделяют и кое-какие виды гусениц, а тропические пауки и некоторые жуки защищаются от врагов при помощи уксусной и серной кислот.
Влияние на окружающую среду
Кислоты и щелочи влияют на окружающую среду по-разному. Кислоты содержат водород и могут быть определены с помощью индикаторов. Они могут высвобождать кислород при взаимодействии с другими веществами. Кислоты также могут вызывать ожоги, когда они контактируют с кожей или лицом.
С другой стороны, щелочи обладают высоким pH-уровнем и могут вызывать раздражение или ожоги при контакте с кожей. Щелочи обладают специфическими свойствами, позволяющими им использоваться в различных областях, таких как очистка и дезинфекция.
Разница между кислотами и щелочами заключается в их химической структуре и свойствах. Они также имеют разное влияние на окружающую среду и человека, в зависимости от их концентрации и способа взаимодействия.
Учитывая их различия, важно понимать, как кислоты и щелочи взаимодействуют с окружающей средой, чтобы принимать соответствующие меры предосторожности и поддерживать экологическую устойчивость
Влияние кислот на окружающую среду
Одно из ключевых свойств кислот — их кислотность. Кислоты обладают кислым вкусом и могут менять цвет индикаторов. Они образуют окрашенные растворы, которые могут варьироваться от ярко-красного до бледно-розового, в зависимости от концентрации кислоты.
Кислоты также способны окислять другие вещества. Высокая концентрация кислорода в кислых растворах позволяет им совершать окислительные реакции. Это может привести к изменению свойств окружающей среды, например, привести к окислению металлов или разрушению органических веществ.
Разница между кислотами и щелочами заключается в их химической природе и свойствах. Кислоты отличаются способностью отдавать водородные ионы, тогда как щелочи принимают эти ионы. Кислоты ищут доноров электронов, в то время как щелочи ищут акцепторов электронов. Эта разница в химическом поведении кислот и щелочей определяет их влияние на окружающую среду.
Выводя контекст, кислоты могут иметь негативное влияние на окружающую среду из-за их свойств. Однако, справедливо отметить, что кислоты имеют широкий спектр применения в промышленности и науке, а также играют важную роль в живой природе. Знание о кислотах и их влиянии на окружающую среду является важным для устойчивого и безопасного использования этих веществ.
Основные отличия кислоты и щелочи в химии
Химические соединения, известные как кислоты и щелочи, обладают различными свойствами и играют важную роль во многих химических реакциях. Несмотря на то, что оба типа соединений относятся к классу химических веществ, они имеют ряд существенных отличий.
1. Кислоты и щелочи имеют разные pH-значения. Кислотное растворение имеет pH меньше 7, что свидетельствует о наличии большего количества ионов водорода (H+) в растворе. В то же время, растворы щелочей имеют pH больше 7 и содержат большее количество ионов гидроксида (OH-).
2. Процессы образования и разложения кислот и щелочей также различаются. Кислоты образуются путем отдачи ионов водорода, когда растворение протекает. С другой стороны, щелочи образуются путем отдачи ионов гидроксида. Разложение кислот происходит с образованием воды и солей, в то время как щелочи разлагаются с образованием воды и оксидов металлов.
3. Кислоты и щелочи обладают разными химическими свойствами. Кислоты характеризуются способностью реагировать с металлами, образуя соли и выделяя водород. С другой стороны, щелочи обладают свойством реагировать с кислотами и образовывать соли и воду.
4. Кислоты и щелочи обычно имеют разные химические формулы и источники. Например, кислоты могут быть органическими или неорганическими соединениями, такими как серная кислота (H2SO4) или уксусная кислота (CH3COOH). Щелочи, с другой стороны, обычно являются соединениями, содержащими основные металлы, такие как гидроксид натрия (NaOH) или гидроксид калия (KOH).
What is Alkali?
Our world is made up of elements. Some exist in sharing electrons with someone making ionic bonds, and some make covalent bonds fulfilling each other’s octet.
However, some things are common. The bonds they form are always in a stable state. And all elements strive to make bonds with someone to find stability.
Alkali metals are the group 1 element of the periodic table designed by scientists. Various periodic tables were suggested, but in 1913, the final table was considered one of the most reliable and appropriate.
Alkali metals like lithium, sodium, potassium, caesium, etc., have one thing in common. They have one election in their last shell.
This electron plays an important role in stabilising the elements. Their last electron can be used to make bonds with elements with 7 electrons in their last shell and need one more.
Like chlorine, If we see its last shell, it’s Deficit by one electron. This sodium electron can be given to chlorine to form bonds making sodium chloride.
The final stability comes when your last shell is complete. Either accept from someone or give someone. The last shell must be full to be stable.
Alkali metals have a pH of 7 and more, turning the red litmus paper into blue and showing acidity properties.
Also, alkali metals can be used to naturalize acidic reactions. These have less ionisation energy since it’s easy for them to donate one electron from their valence shell.
Чем отличаются щелочь и кислота
Щелочь и кислота представляют собой различные типы химических веществ, обладающие определенными свойствами и взаимодействующие с другими веществами по-разному.
Щелочь относится к классу основных химических веществ, характеризующихся высоким уровнем pH. Основные свойства щелочей включают растворимость в воде, электролитичность, амфотерность и способность нейтрализовать кислоты. Щелочи обычно имеют гладкую, мыльную текстуру и образуют щелочные растворы, которые могут обладать щелочным вкусом и запахом. Примеры щелочей включают натрий гидроксид (NaOH), калий гидроксид (KOH) и аммиак (NH3).
С другой стороны, кислоты относятся к классу химических веществ, которые обладают низким уровнем pH. Они обычно хорошо растворяются в воде и проявляют кислотные свойства, такие как выделение водорода, реакция с основаниями и металлами, а также способность вызвать раздражение на коже и слизистых. Кислоты обычно имеют острый, едкий запах и могут вызывать жжение при контакте с кожей. Примеры кислот включают серную кислоту (H2SO4), азотную кислоту (HNO3) и уксусную кислоту (CH3COOH).
| Щелочь | Кислота |
|---|---|
| Высокий уровень pH | Низкий уровень pH |
| Растворимость в воде | Растворимость в воде |
| Электролитичность | Электролитичность |
| Амфотерность (способность выступать как кислота и основание) | Не обладает амфотерностью |
| Могут нейтрализовать кислоты | Могут быть нейтрализованы щелочами |
В целом, щелочь и кислота различаются по своим химическим свойствам, вкусу, запаху и реакциям, которые они вызывают. Щелочи обычно обладают высоким уровнем pH и взаимодействуют с кислотами для образования солей и воды, тогда как кислоты имеют низкий уровень pH и могут растворять многие материалы и вызывать раздражение. Они выполняют важные функции в химических реакциях и бытовых нуждах.