Энергия
Когда атом превращается в ион, изменяется не только количество электронов. Меняется и энергия в атоме. Это необходимо для удаления электрона с его орбитали. Эта энергия известна как энергия ионизации. В общем, чем меньше электронов находится на внешней орбитали, тем меньше энергии ионизации потребуется для удаления части электронов из атома. Например, натрий (Na) имеет только 1 электрон на своей внешней орбитали, поэтому для его удаления не требуется много энергии. Однако неон имеет 8 электронов на своей внешней орбитали, что является идеальной конфигурацией для любого атома. Следовательно, чтобы превратить этот атом в ион, потребуется огромное количество энергии.
Валентные и неспаренные электроны
Валентные электроны — электроны, способные участвовать в образовании химических связей.
Представим вкусный большой многослойный ягодный торт. Каждый слой — своего рода уровень. На слоях располагаются ягоды, они же электроны. Но самые вкусные (валентные) всегда располагают сверху на торте. То есть валентные электроны могут быть как на внешнем (в качестве украшения торта), так и на предвнешнем (верхнем бисквитном слое) энергетическом уровне.
Поэтому важно научиться определять количество валентных электронов для различных элементов:
- для элементов главных подгрупп — это все электроны внешнего уровня;
- для элементов побочных подгрупп — это электроны внешнего слоя и предвнешнего d-подуровня.
Среди валентных электронов есть как спаренные электроны, так и неспаренные.
Неспаренными называют электроны, которые находятся поодиночке на орбитали атома, соответственно, спаренные — всегда вдвоем.
Например, у атома водорода один неспаренный электрон на внешнем энергетическом уровне, а вот у атома гелия неспаренных электронов уже нет, но так как оба они находятся на внешнем (и в данном случае единственном) энергетическом уровне, они будут валентными.
Запоминалка: существует последовательность чисел, которая позволяет определить количество неспаренных электронов для атомов главных подгрупп: 1-0-1-2-3-2-1-0.
Таким образом, все неспаренные электроны являются валентными, но не все валентные электроны должны быть неспаренными.
Разберем еще один пример задания №1 ЕГЭ по химии.Задание. Определите, атомы каких из указанных в ряду элементов имеют одинаковое количество неспаренных электронов.1) Li 2) Ca 3) N 4) Ne 5) HРешение. Чтобы решить задание, нужно вспомнить последовательность чисел, которая позволяет определить количество неспаренных электроновдля атомов главных подгрупп: 1-0-1-2-3-2-1-0.Li — элемент IA группы (1-0-1-2-3-2-1-0), значит, у него один неспаренный электрон.Ca — элемент IIA группы (1–1-2-3-2-1-0), значит, у него нет неспаренных электронов.N — элемент VA группы (1-0-1-2-3-2-1-0), значит, у него три неспаренных электрона.Ne — элемент VIIIA группы (1-0-1-2-3-2-1-), значит, у него нет неспаренных электронов.H — элемент IA группы (1-0-1-2-3-2-1-0), значит, у него один неспаренный электрон.Ответ: 15
Строение атома — это тема, с которой всегда начинают познание химии, потому что приступать к изучению химических свойств веществ можно только с пониманием поведения элементарных частиц на атомарном уровне. Изучить тему подробнее и разобрать все ее тонкости поможет статья «Особенности строения электронных оболочек атомов переходных элементов».
Взаимодействие атомов: связи и характер связей
Атомы могут вступать во взаимодействие между собой, образуя химические связи. Связи между атомами обусловлены взаимодействием их внешних электронных оболочек. В результате образуются ионы и молекулы.
Связи между атомами могут быть ионными, ковалентными и металлическими. В ионных связях один атом отдает электроны другому атому, образуя положительный и отрицательный ионы, которые притягиваются друг к другу. В ковалентных связях атомы обмениваются электронами, образуя общие пары электронов. В металлических связях электроны между атомами свободно движутся.
Характер связей между атомами зависит от разности их электроотрицательностей. Если электроотрицательности атомов отличаются наиболее сильно, образуется ионная связь. При меньшей разности электроотрицательностей образуются ковалентные связи. Металлические связи характерны для металлов и объясняют их способность проводить электрический ток.
Знание о связях между атомами является основой для понимания химических реакций и свойств веществ. Изучение характера связей позволяет предсказать, насколько стабильна молекула и как она будет взаимодействовать с другими веществами.
ДРУГОЕ
Иностранное слово «альфа» прочно прижилось в русском языке и встречается в самых разных сочетаниях. О том,…
Безусловно, каждый из нас в самом общем смысле хорошо представляет, что такое элемент. Элемент – это составная часть…
Слово “ядро” означает сердцевину чего-либо, имеющую форму шара. Однако значения у данного понятия могут быть разными, в…
Каждый из нас хоть раз, но любовался прекрасным ночным небом, усыпанным множеством звёзд. Не задумывались ли вы о том,…
Определение большого адронного коллайдера звучит так: БАК является ускорителем заряженных частиц, и создан он с целью…
Электрон – это элементарная частица, которая имеет отрицательный электрический заряд. Он равен -1. Электрон входит в…
Существует невидимая сила, которая протекает внутри биологических объектов и неживой среды. Эта сила называется…
Не так много людей хорошо разбираются в различных терминах, теориях и законах физики и химии. А некоторые, может быть,…
Реакции между разного рода химическими веществами и элементами являются одним из главных предметов изучения в химии.…
Понятие вещества изучается сразу несколькими науками. Вопрос о том, какие есть вещества, мы разберём с двух точек…
На уроках химии в школе учат решать различные задачи, популярными среди которых являются задачи на вычисление…
Электрический заряд – физическая величина, которая определяет способность тела принимать участие в электромагнитных…
Степень окисления – это условный заряд атома в молекуле, он получает атом в результате полного принятия электронов, его…
Установлено, что каждый химический элемент, находящийся в природе – это смесь изотопов (отсюда у них дробные атомные массы). Чтобы понять, чем отличаются изотопы один от другого, необходимо детально рассмотреть строение атома. Атом образует ядро и электронное облако. На массу атома влияют электроны, движущиеся с ошеломительной скоростью по орбиталям в электронном облаке, нейтроны и протоны, входящие в состав ядра.
Что такое изотопы
Изотопы
– это разновидность атомов какого-либо химического элемента. Электронов и протонов в любом атоме всегда равное количество.
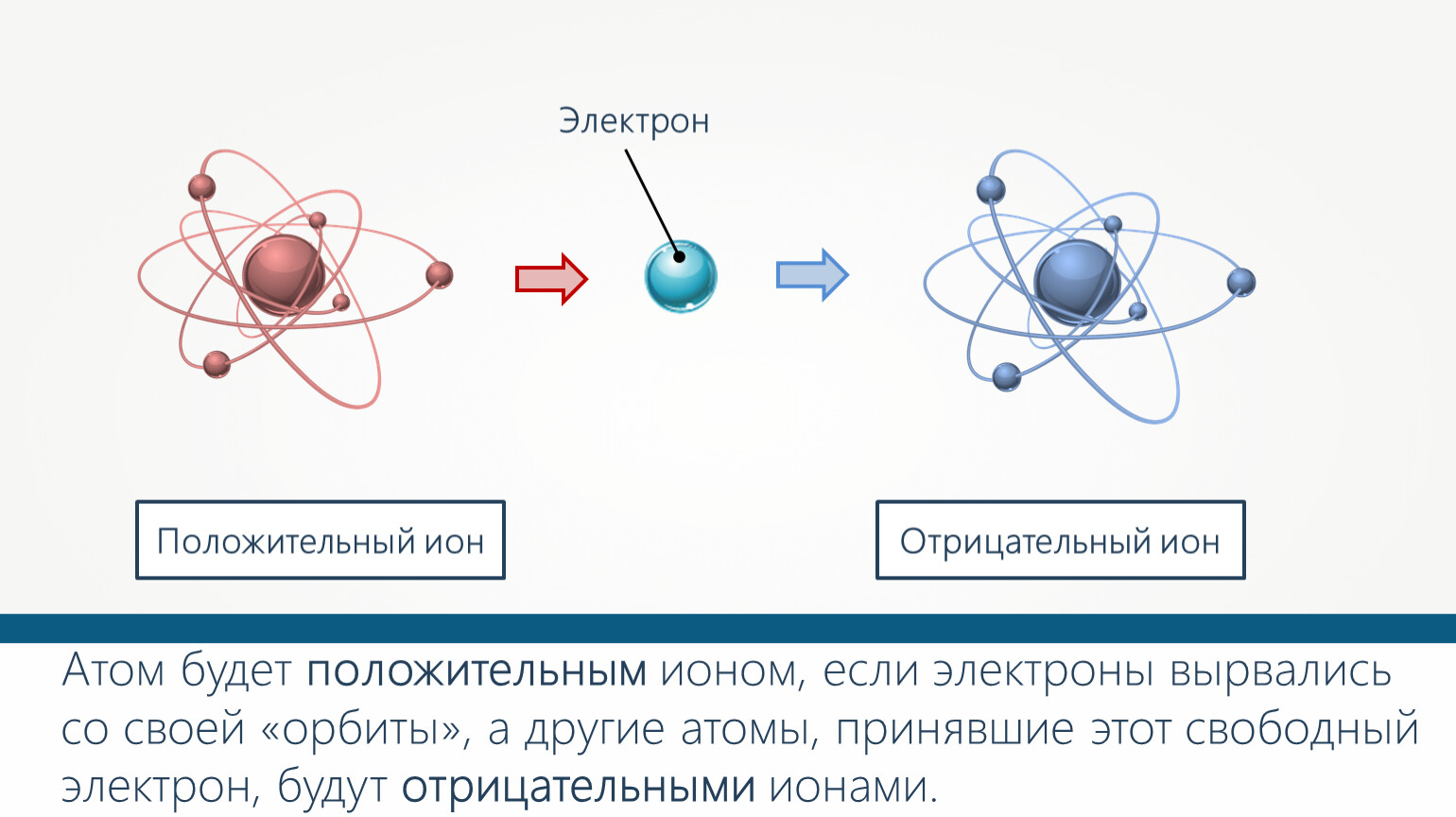
Поскольку они обладают противоположными зарядами (электроны – отрицательным, а протоны – положительным), атом всегда нейтрален (эта элементарная частица не несет заряда, он равен у нее нулю). При потере или захвате электрона атом теряет нейтральность, становясь либо отрицательным, либо положительным ионом.
Нейтроны не имеют заряда, зато их количество в атомном ядре одного и того же элемента может быть разным. Это никак не сказывается на нейтральности атома, однако влияет на его массу и свойства.
Например, в любом изотопе атома водорода есть по одному электрону и протону. А количество нейтронов разное. В протии имеется всего лишь 1 нейтрон, в дейтерии – 2 нейтрона и в тритии – 3 нейтрона. Эти три изотопа заметно отличаются друг от друга по свойствам.
ru.natapa.org
Атом и ион — это два различных термина, которые составляют главную долю химии.
Эти два термина составляют главную основу химии, и человек, который желает понять, как все устроено, обнаружит, что ему придется полностью понимать данные термины. Атом — это очень маленькая часть каждого объекта.
Ион — это атом или молекула, общее число электронов которых не равно общему количеству протонов. Это немного сбивает с толку учеников, пока они не понизят идею.
Атомы — это ключевые единицы, из которых состоит вся материя.
Ионная, ковалентная и металлическая связи
Атомы крошечные, шириной от 0,1 до 0,5 нанометров. Они настолько крошечные, что их даже не видно через микроскоп.
Имеется множество типов атомов.
Каждый атом имеет уникальное имя, массу и размер. Разные типы атомов называются элементами.
Компонент — это чистое вещество, которое имеет один или один вид атома, выделяющийся собственным атомным номером. Ядерный номер выходит из протонов, присутствующих в ядре элемента.
Всего было идентифицировано 118 элементов, разделенных на металлы, металлоиды и неметаллы. Любой компонент имеет собственный набор параметров.
Большинство элементов доступно на Земля, тогда как отдельные из них были созданы искусственно в результате ядерных реакций.
Компонент уже находится в его самой сырой форме и не может быть дальше сломан. Все детали можно отыскать в периодической таблице, перечисленные по атомному номеру.
Каждый атом каждого элемента состоит из протонов, нейтронов и электронов. Протоны и нейтроны составляют ядро ??атома и размещены в середине атома.
Ядро окружено облаком электронов, которые связаны с ядром электромагнитной силой. Электроны имеют негативный заряд, который притягивает их к ядру, так как протоны в ядре имеют позитивный заряд.
Нейтроны, с другой стороны, не имеют заряда.
Кол-во протонов, нейтронов и электронов в атоме определяет, каким элементом он считается. К примеру: атом железа имеет 26 протонов, 30 нейтронов и 26 электронов.
Каждый атом железа станет иметь эту конфигурацию.
Как видно из примера, атом железа имеет 26 протонов и 26 электронов. Каждый атом, который не создал никакой связи, станет иметь равное кол-во протонов и электронов.
Потому как атом не может свободно существовать в естественном мире, они без проблем связываются с другими атомами, которые доступны. Когда атом связывается, он либо теряет, либо получает электроны.
Если один атом связывается с иным атомом, один атом должен потерять электрон, тогда как другой атом получит электрон. Это даёт атому позитивный или негативный электрический заряд.
Атомы, протоны которых не равны его электронам, являются ионами.
Ионы делаются химическими или физическими средствами.
Существует два типа ионов: катион и анион.
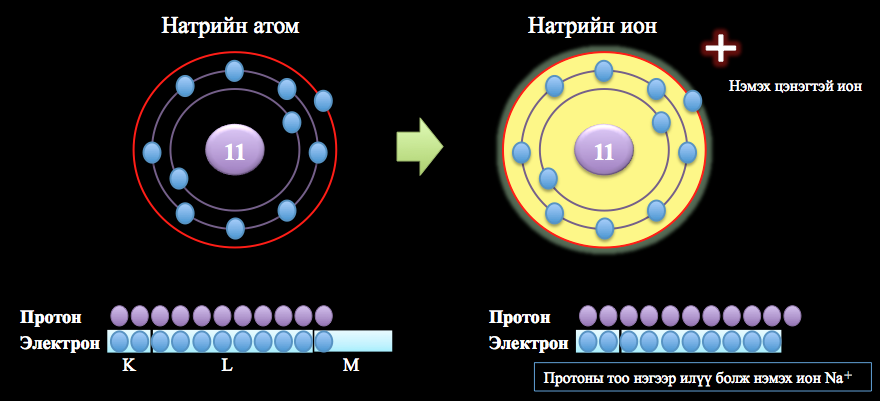
Считается, что нейтральный атом, который теряет электрон, имеет позитивный заряд из-за большего количества протонов и известный как катион. Атом, который получает электрон, имеет большее число электронов, чем протоны, и считается, что он имеет негативный заряд и рассматривается как анион.
Чем атом отличается от иона?
Ион, который состоит из одного атома, собой представляет ядерный или одноатомный ион; если он состоит из 2-ух или более атомов, это молекулярный или многоатомный ион.
Ионы обладают высокой реакционной способностью и связываются с ионами противоположного заряда, чтобы стать стабильными.
Ионы на стадии, аналогичной газу, являются огнеопасными и встречаются на Земля только в минимальных количествах, например как пламя, молния, электрические искры и остальные виды плазмы. Ионы, которые будут в жидком или твёрдом состоянии, часто взаимодействуют и связываются с экстрагентами, чтобы стать намного стабильными.
Все ионы заряжены, что означает, что они имеют несколько главных параметров: они притягиваются к противоположным электрическим зарядам, отталкиваются похожими зарядами, во время движения они двигаются по траекториям и отклоняются магнитным полем.
Применение ионов в реальной жизни
Ионы, благодаря своим уникальным свойствам, нашли широкое применение в различных сферах нашей повседневной жизни. Рассмотрим некоторые из них.
1. Медицина:
Ионы используются в медицине для проведения электролитической терапии, очистки крови и дезинфекции. Например, ионы серебра применяются в антисептических растворах, чтобы убить бактерии и предотвратить инфекцию. Ионы йода используются в препаратах для лечения щитовидной железы.
2. Производство:
Ионы используются в промышленности для процессов электролиза, гальванизации и электрохимической обработки поверхности материалов. Например, в процессе покрытия металлических изделий защитным слоем, применяются ионы цинка.
3. Аккумуляторы:
В батареях и аккумуляторах, ионы являются неотъемлемой частью. Например, в литий-ионных аккумуляторах ионы лития перемещаются между электродами, обеспечивая их зарядку и разрядку.
4. Очистка воды:
Процессы ионного обмена широко используются в системах очистки воды. Например, ионы катионы и анионы могут быть использованы для удаления загрязнений из воды и обмена их на безопасные ионы.
5. Косметика:
В косметической промышленности ионы используются для создания продуктов по уходу за кожей и волосами. Например, ионы кальция могут улучшить состояние ногтей и волос, а ионы железа могут усилить эффект глянцевого покрытия.
6. Электроника:
Ионы используются в электронных приборах для проведения электрического тока и сохранения заряда. Ионы металлов, таких как литий, кобальт и никель, используются в производстве батарей и других электронных устройств.
Применение ионов в реальной жизни демонстрирует их важность и ценность. Их уникальные свойства и возможность образования соединений с другими элементами делают ионы востребованными во многих отраслях науки, техники и медицины
Что такое атом
Атом – фундаментальная единица всей материи. Другими словами, вся материя состоит из атомов. Хотя раньше ученые считали, что атомы нельзя разделить дальше, эта концепция больше не действует. Эта концепция была изменена с открытием электрона, протона и ядра. После этого была развита атомная теория, описывающая строение атома.
Согласно современной атомной теории, атом состоит из двух компонентов. Это ядро и атомные орбитали. Ядро состоит из протонов, которые являются положительно заряженными субатомными частицами, и нейтронов, которые являются нейтрально заряженными субатомными частицами. Заряд протона +1. Вокруг ядра находится электронное облако, в котором электроны атома движутся по гипотетическим орбиталям. Электрон имеет электрический заряд -1. Следовательно, электроны – это отрицательно заряженные частицы.
Атомы определенного элемента идентичны друг другу. Следовательно, количество протонов и нейтронов, присутствующих в ядрах атомов, одинаково для одного элемента. Число электронов вокруг ядра одинаково для атомов, принадлежащих одному элементу.
Протоны и нейтроны слипаются в ядре из-за сильных сил, существующих между этими частицами. Эти силы называются взаимодействиями. Эти взаимодействия происходят из-за обмена очень крошечными частицами, называемыми мезоны. Следовательно, чтобы разбить ядро на протоны и нейтроны, требуется очень высокая энергия. Электроны движутся вокруг ядра. Поскольку электроны заряжены отрицательно; электроны не притягиваются к положительно заряженным протонам в ядре, не падают на ядро, поскольку сила, возникающая из-за движения электрона, равна силе притяжения ядра. Поскольку эти две силы уравновешивают друг друга, электроны остаются в своем движении на определенном расстоянии от ядра. Путь, по которому движутся эти электроны, называется оболочкой или орбиталью.

Рисунок 1: Упрощенная атомная структура
Строение атома можно описать так, но это неверно. Фактическая структура намного сложнее, чем на изображении выше.
Атомы могут участвовать в химических связях. Атомы соединяются вместе, образуя молекулы или соединения. Эти прикрепления происходят через химические связи. Эти связи могут быть ковалентными связями, ионными связями, координационными связями или металлическими связями. При образовании этих связей происходит обмен электронами. Но протоны и нейтроны в ядре не участвуют в химической связи. Но в процессе радиоактивного распада ядро атома превращается в совершенно другое ядро путем преобразования протонов или нейтронов в разные частицы вместе с испусканием излучения.
Квантовые числа
У каждого взрослого человека есть жизненно важные документы: паспорт, СНИЛС, медицинский полис и другие. У электрона тоже есть свои важнейшие «документы» — набор квантовых чисел:
- главное квантовое число (n);
- орбитальное квантовое число (l);
- магнитное квантовое число (ml);
- спиновое квантовое число (ms).
Главное квантовое число (n) характеризует номер энергетического уровня атома.
Главное квантовое число численно равно номеру периода.
Принимает значения: 1, 2, 3,….∞. Однако на сегодняшний день максимальным главным квантовым числом является 7, так как в таблице Менделеева всего 7 периодов. Например, главное квантовое число атома фосфора (P) равно трем, так как этот элемент находится в третьем периоде.
Орбитальное квантовое число (l), или его еще называют побочным квантовым числом, определяет форму атомных орбиталей (траекторий движения электрона).
Определить l можно по формуле:
l=n-1, гдеn — это главное квантовое число.
Максимально возможное орбитальное число всегда будет на единицу меньше главного квантового числа.
Важно помнить, что количество атомных орбиталей на каждом уровне равно номеру этого уровня.
Например, фосфор, находящийся в третьем периоде, имеет на первом энергетическом уровне одну атомную орбиталь (s), на втором — две (s и p), на третьем — три (s, p и d). То есть атом фосфора имеет три разных по энергии, но одинаковые по форме s-орбитали – на первом, втором и третьем энергетических уровнях.
Магнитное квантовое число (ml) определяет количество атомных орбиталей (ячеек).
Оно рассчитывается по формуле:
ml =2l+1, гдеl – это орбитальное квантовое число.
Например, у атома фосфора главное квантовое число n=3; орбитальное квантовое число l=3-1=2 (d-орбиталь); магнитное квантовое число ml =2 · 2+1=5. Таким образом делаем вывод, что на третьем (n) энергетическом уровне у фосфора находится пять (ml) различных по энергии d-орбиталей (l).
Спиновое квантовое число (ms) характеризует собственное движение электрона — спин.
Как мы уже сказали, спиновое квантовое число характеризует движение электрона вокруг ядра атома. То есть атом может двигаться как по часовой, так и против часовой стрелки. Это очень напоминает спиннер (вращающаяся игрушка). Более того, понятия «спиновый» и «спиннер» созвучны, что позволяет без труда вспомнить смысл этого квантового числа.
Расчеты главного, орбитального и магнитного квантовых чисел приведены в таблице.
Квантовые числа позволяют нам собрать информацию о строении атома химического элемента, о распределении его электронов, чтобы затем составить «паспорт».
Название ионов
Ионы металлов, которые имеют различные (переменные) степени окисления, записываются следующим образом:
- Fe2+ железо(II) или ион двухвалентного железа
- Fe3+ железо(III) или ион трехвалентного железа
- Сu+ медь(I) или ион одновалентной меди
- Cu2+ медь (II) или ион двухвалентной меди
- Sn2+ олово(II) или двухвалентного олова
- Sn4+ олово(IV) или ион четырехвалентного олова
Пример 2: Окисление или восстановление происходит при превращении иона трехвалентного железа в ион двухвалентного? Запишите уравнение этого процесса.
Решение: Уравнение реакции имеет следующий вид: Fe3+ + e— → Fe2+. Она представляет собой процесс восстановления, поскольку к исходному иону присоединяется электрон.
Надеюсь урок 6 «Простые ионы» оказался для вас понятным и полезным. Если у вас возникли вопросы, пишите их в комментарии.
Отличия между атомом и ионом
Основное отличие между атомом и ионом в том, что ион – заряженная частица, а атом – не заряженная.
Также атом и ион одного и того же элемента отличаются по массе, за счет разницы в количестве электронов. Катион имеет меньшую массу, чем атом того же элемента, а анион, соответственно, большую. Разница между массой атома и массой иона кратна массе электрона.
Ионы, в отличии от атомов, не обладают свойствами простого вещества. Примером этого могут служить кристаллы йода, которые имеют темно-синий цвет, в газообразном состоянии он фиолетовый, а его ионы бесцветны. Ионы йода не дают цветной реакции с крахмалом и не ядовиты, в отличии от кристаллов.
Аналогичный пример – медь. Этот металл имеет золотисто-красный цвет, а его ионы – зелено-голубые.
Калий – серебристый металл, атомы которого активно реагирую с водой, в то время как ионы этого вещества не обладают таким свойством. То же самое различие характерно для свойств атомов и ионов натрия.
Катион водорода в реакции с аммиаком формирует ион аммония. Для молекулы водорода такая реакция не характерна.
Атомы не встречаются в природе самостоятельно, в отличии от ионов. Исключение составляют только инертные газы, которые вступают в реакцию с другими элементами только в экстремальных условиях. Если ион формируется из нескольких атомов, то он существенно отличается от атома размером и структурой. В отличии от атома, ион не относится к элементарным частицам.
Ионы имеют завершенный внешний энергетический уровень – на нем 8 электронов. Никакие атомы, кроме инертных газов, не обладают этим свойством.
Электрические свойства атома
Основное электрическое свойство атома — электрический заряд, который может быть положительным, отрицательным или нейтральным. Положительный заряд носит протон, отрицательный заряд — электрон, а нейтральный заряд — нейтрон. Количество протонов определяет атомный номер элемента, а количество электронов обуславливает его электронную конфигурацию и химические свойства.
Взаимодействие электронов с протонами и с другими электронами внутри атома создает электростатическую силу притяжения и отталкивания. Это обуславливает основные электрические свойства атома, такие как возможность ионизации и образование молекул.
Атомы, обладающие положительными или отрицательными зарядами, называются ионами. Положительный ион называют катионом, а отрицательный ион — анионом. Ионы могут образовываться при передаче электронов от одного атома к другому в химических реакциях или при взаимодействии с внешними ионизирующими источниками, такими как электромагнитные поля или радиоактивные элементы.
Электрические свойства атома и его ионов имеют важное значение в различных научных областях, включая физику, химию и материаловедение. Понимание этих свойств позволяет улучшить наши знания о взаимодействии вещества и применить их в создании новых материалов и технологий
Ион-атом
Ион-атомы отличаются от нормальных ионов тем, что они могут существовать только в постоянном взаимодействии с полусвободными электронами.
Ион-атомы на поверхности металла имеют свободные связи, которые могут быть насыщены в результате адсорбции ионов, а также полярных молекул. Валентные электроны покинуть сферу металла в обычных условиях не могут, так как для этого их энергия недостаточна. Выход электронов из металла становится возможным лишь в случае увеличения их энергии, например под влиянием облучения поверхности металла.
Ион-атомы, расположенные на поверхности металла, в отличие от находящихся в глубине, испытывают только одностороннее воздействие со стороны других ион-атомов и электронов. Вследствие этого поверхность металла обладает другими свойствами, чем частицы, расположенные в толще образца, и н частности, 1высокой адсорбционной способностью.
Ион-атомы, находящиеся на поверхности металла, притягиваются диполями воды, и, если силы притяжения больше, чем силы связи между ионами и электронами в металле, некоторое количество иол-атомов в виде гидратированных ионов перейдет в раствор.
Ион-атомы на поверхности металла имеют свободные связи, которые могут быть насыщены в результате адсорбции ионов, а также полярных молекул. Валентные электроны покинуть сферу металла в обычных условиях не могут, так как для этого их энергия недостаточна. Выход электронов из металла становится возможным лишь в случае увеличения их энергии, например под влиянием облучения поверхности металла.
| Схема перехода ионов металла в раствор и образования двойного слоя. |
Ион-атомы, расположенные на поверхности металла, испытывают только одностороннее воздействие со стороны других ион-атомов и электронов, более удаленных от поверхности.
Ион-атомы, находящиеся на поверхности металла, испытывают только одностороннее воздействие более удаленных от поверхности ион-атомов и электронов. Поэтому поверхностные ион-атомы металла имеют ненасыщенные свободные связи, за счет которых на поверхности металла могут удерживаться ( адсорбироваться) молекулы, ионы и атомы. Поверхность металла даже при самой тщательной обработке не является совершенно однородной и гладкой, вследствие чего различные участки поверхности обладают различной адсорбционной способностью.
Ион-атомы подвергаются гидратации и отводятся вглубь раствора.
Ион-атомы в поверхностном слое металла в отличие от ион-атомов, находящихся в глубине, испытывают только одностороннее воздействие со стороны других ион-атомов и электронов металла.
Ион-атомы в поверхностном слое металла в отличие от ион-атомов, находящихся в глубине, испытывают только одностороннее воздействие со стороны других ион-атомов и электронов металла.
Чтобы ион-атомы могли покинуть поверхность металла, должен иметь место разрыв связи между ион-атомом и электроном. Источником энергии, необходимой для разрыва связи между ион-атомом и электроном, является процесс гидратации, сопровождающийся, как было указано, освобождением энергии.
Чтобы ион-атомы могли покинуть поверхность материала, должен быть разрыв связи между ион-атомом и электроном. Источником энергии, необходимой для разрыва связи между ион-атомом и электроном, является процесс гидратации, сопровождающийся, как было указано, освобождением энергии.
Чтобы ион-атомы могли покинуть поверхность металла, должен иметь место разрыв связи между ион-атомом и электроном. Источником энергии, необходимой для разрыва связи между ион-атомом и электроном, является процесс гидратации, сопровождающийся, как было указано, освобождением энергии.
Одновременно ион-атомы материала протектора переходят в раствор, что приводит к его разрушению. Сила тока при этом контролируется с помощью контрольно-измерительной колонки. Таким образом, разрушение металла все равно имеет место.