Химические свойства
Иод относится к группе галогенов.
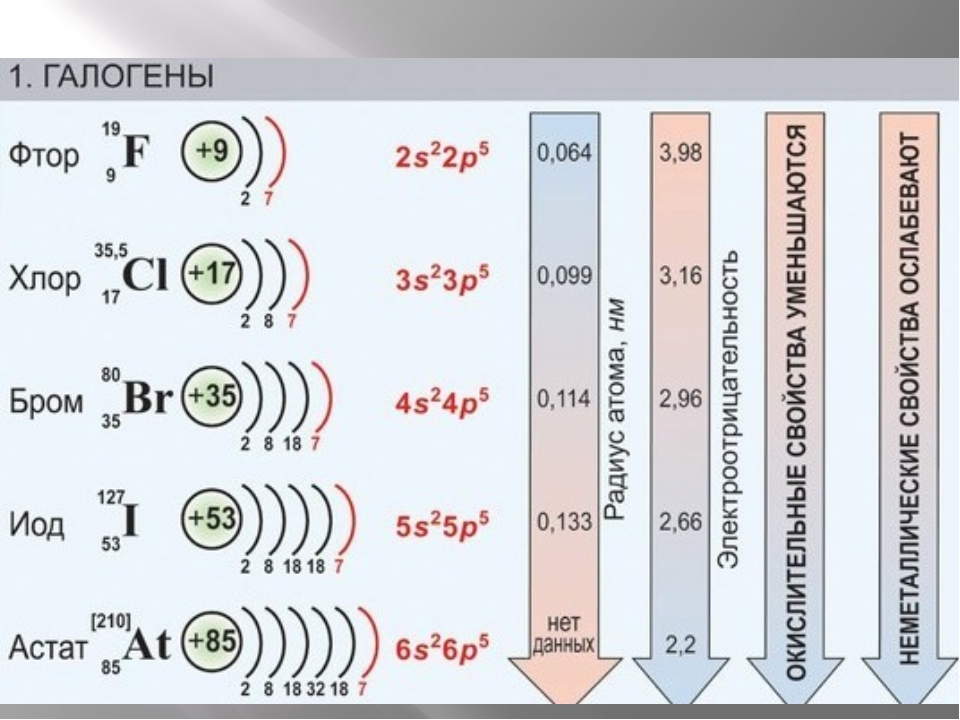
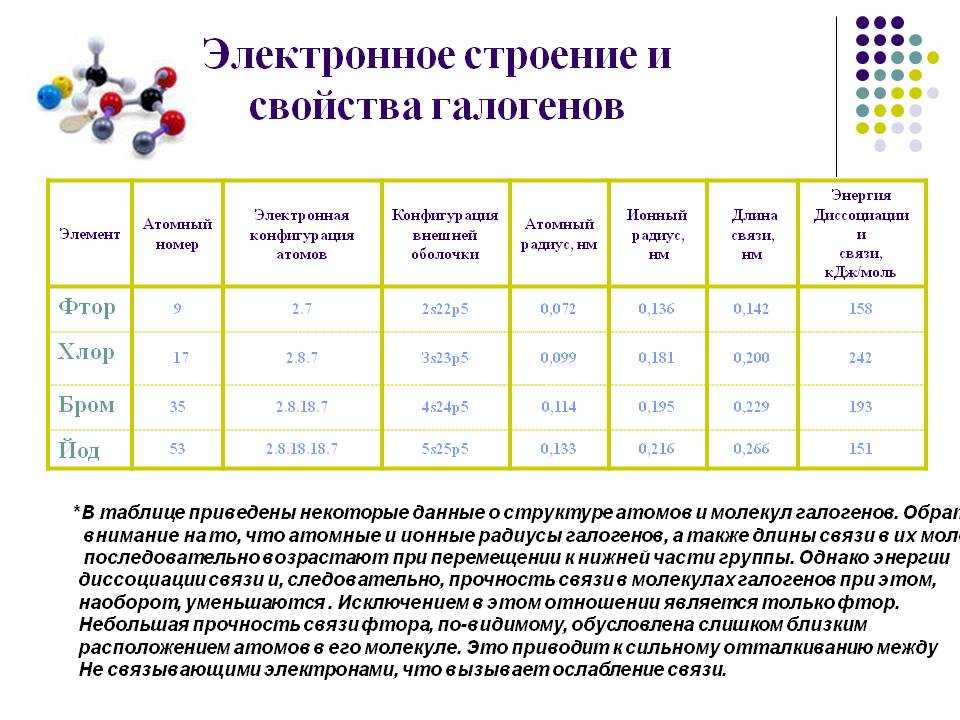
Электронная формула (Электронная конфигурация) иода: 1s22s22p63s23p63d104s24p64d105s25p5.
Образует ряд кислот: иодоводородную (HI), иодноватистую (HIO), иодистую (HIO2), иодноватую (HIO3), иодную (HIO4).
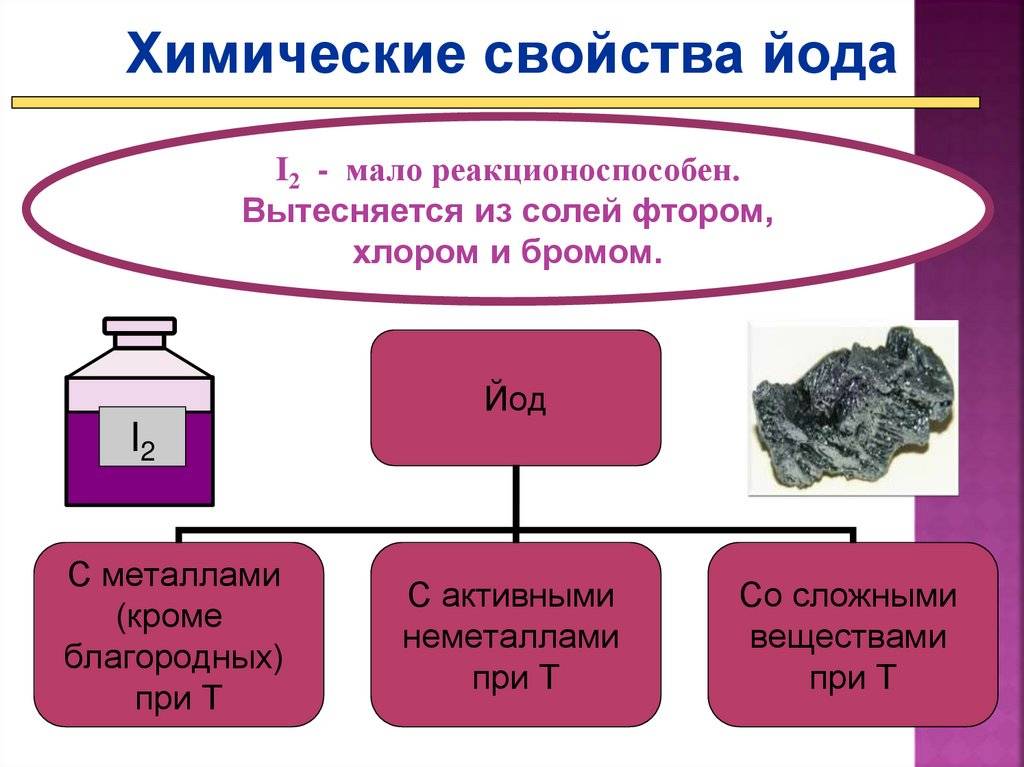
Химически иод довольно активен, хотя и в меньшей степени, чем хлор и бром.
- Довольно известной качественной реакцией на иод является его взаимодействие с крахмалом, при котором наблюдается синее окрашивание в результате образования соединения включения. Эту реакцию открыли в 1814 году Жан-Жак Колен (Jean-Jacques Colin) и Анри-Франсуа Готье де Клобри (Henri-François Gaultier de Claubry).
- С металлами иод при лёгком нагревании энергично взаимодействует, образуя иодиды:
С водородом иод реагирует только при нагревании и не полностью, образуя иодоводород:
- ⇄
Иод является окислителем, менее сильным, чем фтор, хлор и бром. Сероводород H2S, Na2S2O3 и другие восстановители восстанавливают его до иона I−:
Последняя реакция также используется в аналитической химии для определения иода.
При растворении в воде иод частично реагирует с ней
- pKc=15,99
Реакция образования аддукта нитрида трииода с аммиаком:
Это вещество почти не имеет практического значения и известно лишь своей способностью разлагаться со взрывом от малейшего прикосновения.
Иодиды щелочных металлов очень склонны в растворах присоединять (растворять) молекулы галогенов с образованием полииодидов (периодидов) — трииодид калия, дихлороиодат(I) калия:
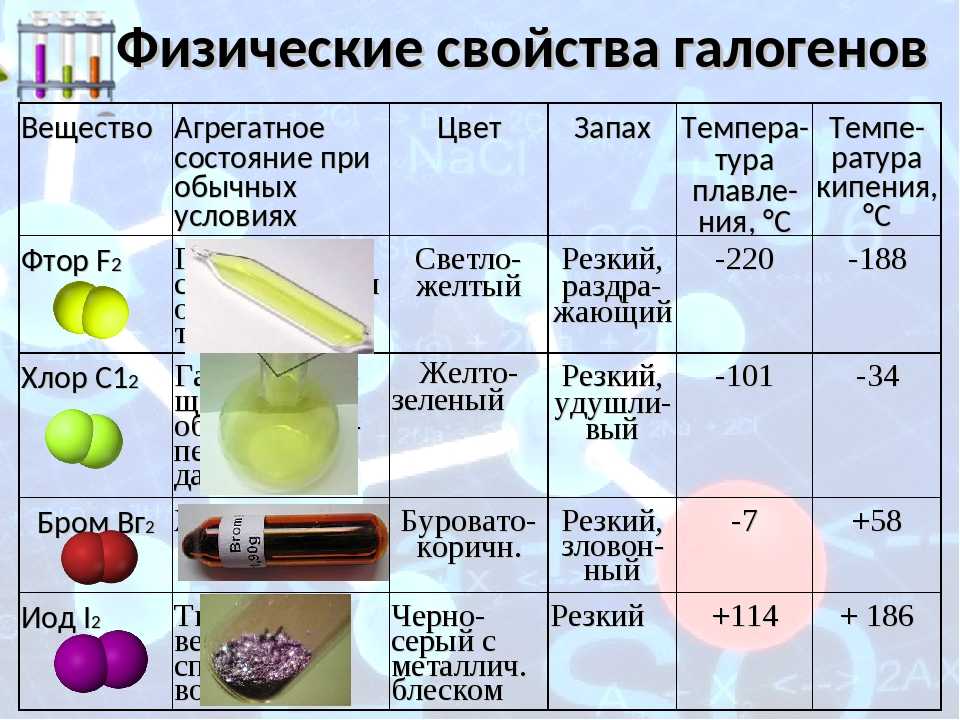
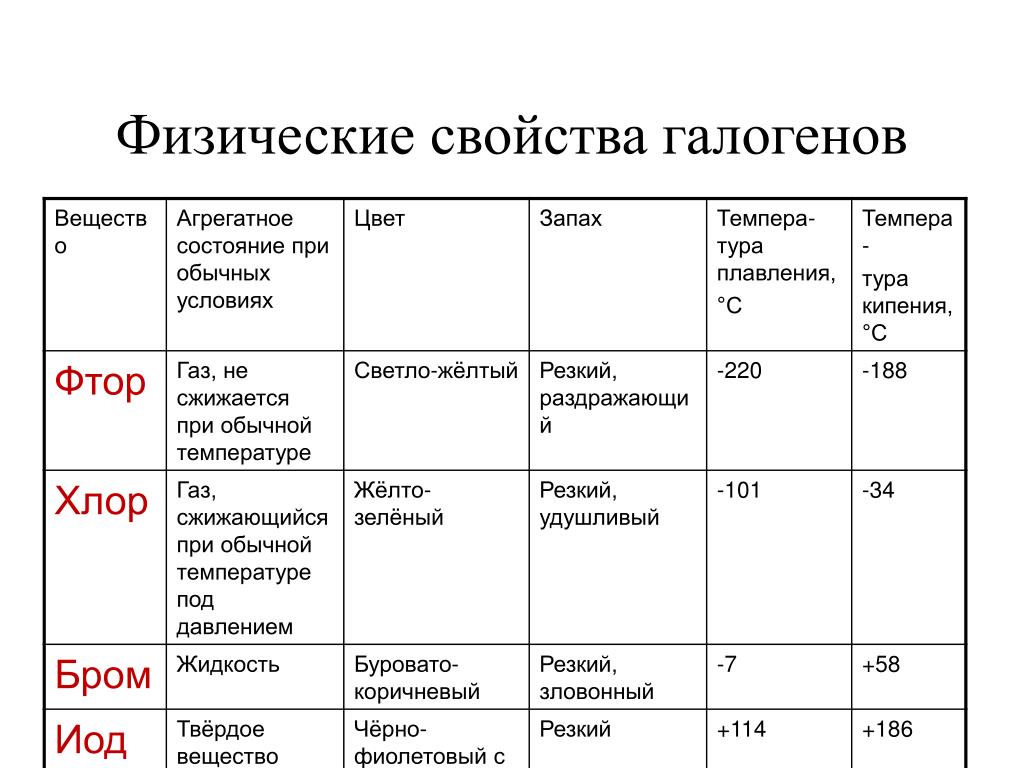
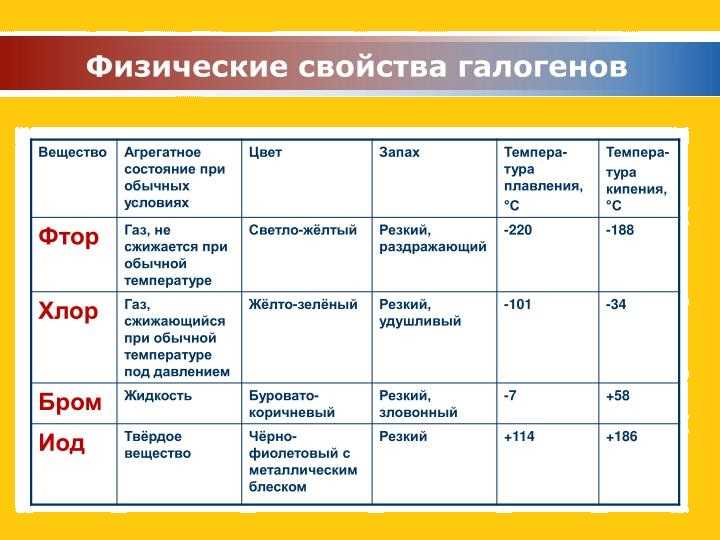
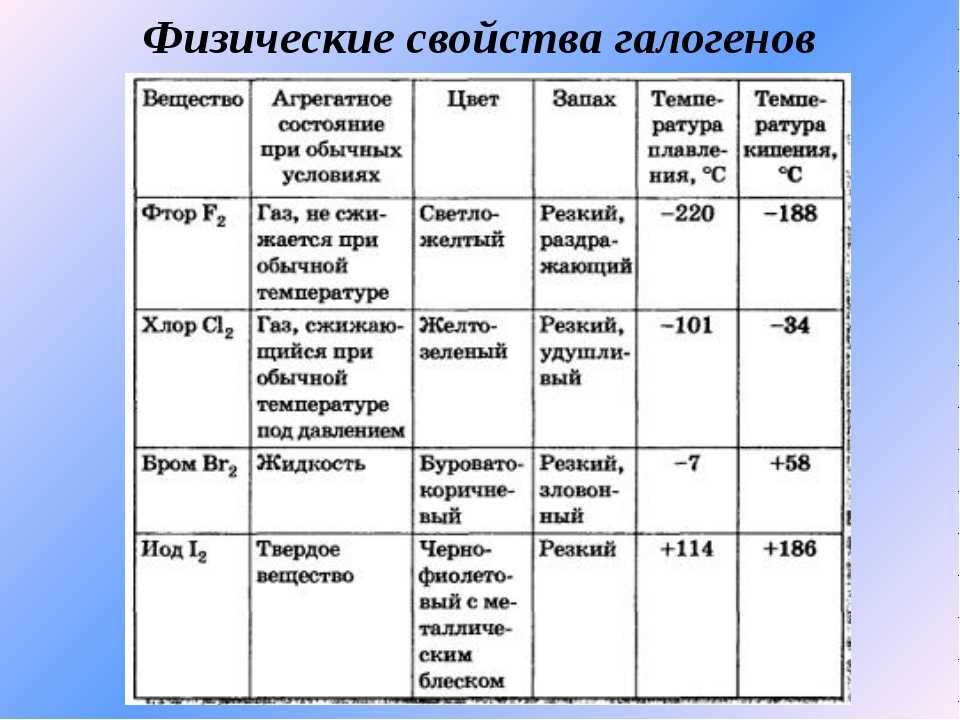
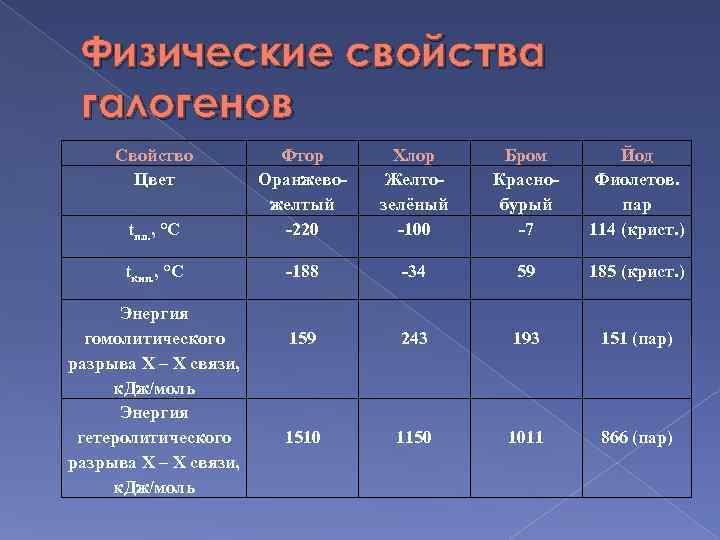
Физические свойства
- Йод – это твердое вещество, которое при комнатной температуре образует темно-фиолетовые кристаллы или голубые блестящие пластинки.
- Бром – это также твердое вещество, однако его структура представляет собой черный или красно-коричневый кристаллический порошок.
- Йод практически нерастворим в воде, но хорошо растворяется в органических растворителях, таких как этанол, эфир и хлороформ.
- Бром, в отличие от йода, довольно легко растворяется в воде, образуя оранжево-красное растворение.
- Температура плавления йода составляет около 114 градусов Цельсия, а для брома – около -7 градусов Цельсия.
- Оба элемента обладают характерным запахом. Йод имеет острый, раздражающий запах, в то время как бром имеет насыщенный слегка сладкий запах.
- Бром является токсичным веществом, в то время как йод является необходимым микроэлементом для организма человека и животных.
Температурные условия существования
Йод имеет более высокую температуру плавления по сравнению с бромом. Точка плавления йода составляет около 113 градусов Цельсия, в то время как бром плавится уже при температуре около -7 градусов Цельсия.
Это означает, что при комнатной температуре и ниже йод находится в твердом состоянии, в виде кристаллов или порошка, в то время как бром находится в жидком состоянии.
Поэтому йод является хорошо известным веществом, используемым в медицине и хозяйственных целях, таких как обработка ран и противодействие инфекционным заболеваниям, а бром находит применение в промышленности, например, в процессах производства пластмасс и фотопленок.
Отличия в температурных условиях существования йода и брома являются одной из основных причин, по которым эти два элемента имеют различные применения и свойства.
Состояния при комнатной температуре
Йод при комнатной температуре является твердым веществом, обладающим характерным фиолетово-черным цветом. Он имеет кристаллическую структуру и образует многочисленные микроскопические пластинки. Йод очень низко летучий, что означает, что он практически не испаряется в газообразное состояние при комнатной температуре. Поэтому йод часто используется в медицинских и лабораторных целях, а также в производстве и косметике.
Бром при комнатной температуре является красно-бурой жидкостью с характерным запахом. Он обладает низким уровнем летучести по сравнению с многими другими летучими жидкостями. Благодаря этому, бром используется в различных областях, включая производство осветительных приборов и противопожарных систем.
Таким образом, йод и бром имеют разные агрегатные состояния при комнатной температуре: йод является твердым веществом, а бром — жидкостью.
| Элемент | Состояние | Цвет |
|---|---|---|
| Йод | Твердое | Фиолетово-черный |
| Бром | Жидкое | Красно-бурый |
Физические свойства
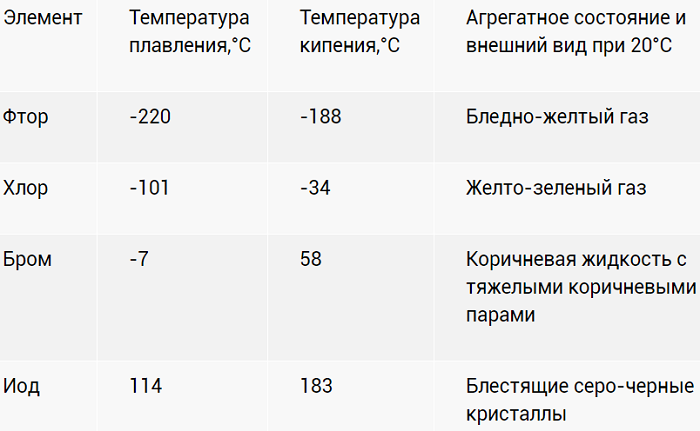
Галогены – ярко выраженные неметаллы. Летучи, с характерно едким «ароматом». Причем для йода (I2) жидкое агрегатное состояние вообще не характерно. При разогреве просто испаряется фиолетовым дымком.
Хлор – настоящее боевое отравляющее вещество. И применялось в таком качестве. Попадая в незащищенные глаза и органы, образует кислоты. С соответствующими последствиями. Для летального исхода достаточно концентрации в воздухе 2 мг/л.
Насыщенность цветов с «утяжелением» ядер возрастает. Активность, напротив, падает.
В воде растворимость ограничена. Лучше ведёт себя с органическими растворителями. Растворы оригинально окрашены: от слабо желтого до фиолетового.
Факторы, влияющие на скорость реакции брома и иода с металлами
1. Размер иона металла. Чем меньше ион металла, тем быстрее происходит реакция. Это связано с тем, что маленькие ионы металла имеют большую электроотрицательность и могут легче образовывать связи с атомами брома или иода.
2. Энергия активации. Реакция брома и иода с металлами происходит при повышенных температурах, так как энергия активации для этих реакций высока. Чем выше температура, тем больше энергии доступно молекулам для преодоления активационного барьера и более быстрая реакция.
3. Концентрация реагентов. При повышении концентрации брома или иода, а также металла, увеличивается количество молекул, способных к реакции. Это приводит к увеличению частоты столкновений и, соответственно, к повышению скорости реакции.
4. Физическое состояние реагирующих веществ. Взаимодействие брома и иода с металлами может происходить в разных физических состояниях – в растворе, в твердой фазе или в газообразной фазе. В каждом из случаев скорость реакции будет различной, так как разные состояния обладают разными свойствами и позволяют различным частям молекул вступать во взаимодействие.
5. Специфика реагирующих металлов. Различные металлы могут иметь разную реакционную активность с бромом и иодом. Это обусловлено различием в структуре и свойствах атомов металла. Например, металлы с более низкой электроотрицательностью могут образовывать более сильные связи с бромом или иодом, что ускоряет реакцию.
6. Присутствие катализаторов. Некоторые вещества, называемые катализаторами, могут ускорять реакцию брома и иода с металлами. Они понижают энергию активации реакции, образуя промежуточные соединения, которые затем разлагаются, ускоряя ход реакции.
Все эти факторы оказывают влияние на скорость реакции брома и иода с металлами и позволяют управлять этими реакциями, например, для ускорения или замедления процесса в зависимости от требуемых условий.
Химические свойства галогенов
Ключевые слова конспекта: химические свойства галогенов, реакция галогенов с металлами, реакции с неметаллами, реакции галогенов с водой, со щелочами, с солями-галогенидами.
Раздел ОГЭ: 3.1.2. Химические свойства простых веществ-неметаллов: водорода, кислорода, галогенов, серы, азота, фосфора, углерода, кремния
Вначале необходимо прочитать конспект «Галогены: характеристика, строение, получение»
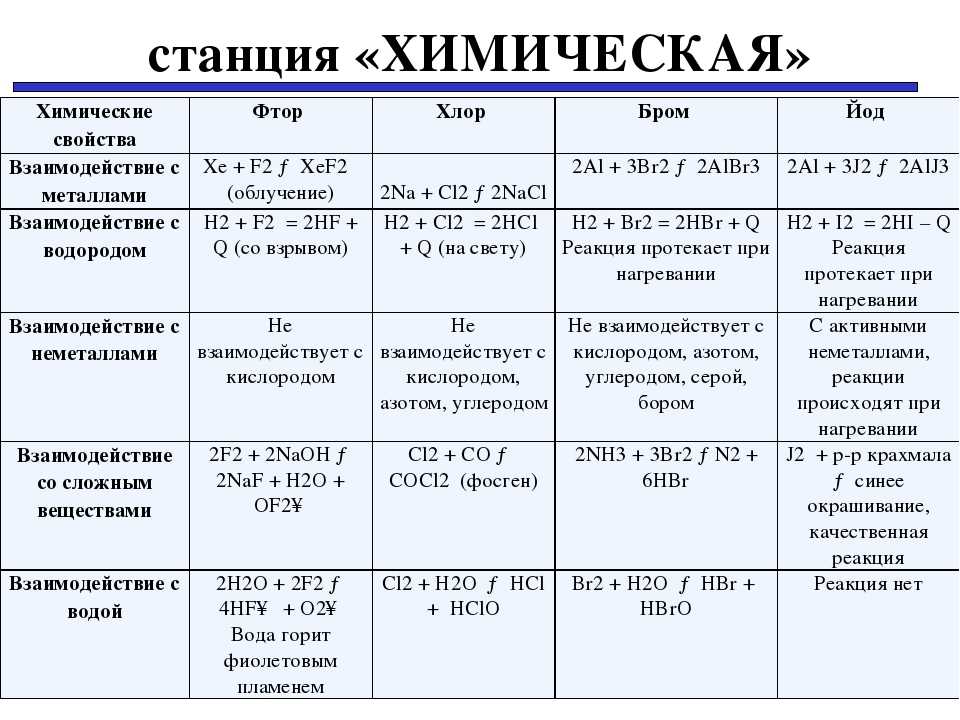
1. Реакция с металлами.
Галогены реагируют практически со всеми металлами (кроме благородных металлов) с образованием галогенидов. Например, натрий горит в хлоре: 2Na + Cl2 = 2NaCl
Со фтором реакции идут очень бурно, с йодом – только при нагревании, часто требуется вода как катализатор.
Окислительная активность галогенов снижается от фтора к йоду
Это можно продемонстрировать на примере окисления железа (обратите внимание на его степень окисления в галогенидах):. В ходе реакции с бромом Вг2 может образоваться как FeBr3, так и FeBr2:. В ходе реакции с бромом Вг2 может образоваться как FeBr3, так и FeBr2:
В ходе реакции с бромом Вг2 может образоваться как FeBr3, так и FeBr2:
В реакции с йодом I2 при температуре 500 °С образуется Fel2:
Фтор, хлор и бром окисляют железо глубже (до Fe3+), чем йод.
2. Реакции с неметаллами.
Окислительную способность галогенов можно сопоставить и в реакциях с неметаллами. Галогены реагируют со многими неметаллами (исключением являются благородные газы, азот N2, кислород O2).
Галогены реагируют с водородом, при этом условия проведения реакции зависят от того, с каким из галогенов проводится реакция:
Со фтором реакция может начинаться даже при t° = –250 °С, с хлором реакция идёт при сгорании водорода в хлоре или даже при комнатной t° на свету. С бромом и йодом реакция идёт при температуре 350–500 °С или при наличии катализатора платины Pt. Реакция образования йодоводорода HI обратима. Таким образом, по мере увеличения относительной молекулярной массы галогена от фтора F2 к иоду I2 условия проведения реакции должны быть более жёсткими.
Галогены реагируют с серой. Фтор взаимодействует с серой даже при температуре жидкого воздуха, окисляя её до высшей степени окисления:
Реакция серы с хлором приводит к образованию либо SCl2, либо S2Cl2:
Обратите внимание: здесь встретилась сравнительно редкая для серы степень окисления +2. С йодом сера не реагирует. Более глубокое окисление серы в реакции со фтором демонстрирует более высокую окислительную способность фтора
Более глубокое окисление серы в реакции со фтором демонстрирует более высокую окислительную способность фтора
С йодом сера не реагирует. Более глубокое окисление серы в реакции со фтором демонстрирует более высокую окислительную способность фтора.
Галогены реагируют с фосфором. Красный и белый фосфор уже при комнатной температуре самовоспламеняется во фторе и хлоре, реагирует с жидким бромом. При этом в реакции со фтором происходит более глубокое окисление фосфора:
В реакциях фосфора с хлором и бромом могут образоваться РCl3 и РВг3, но по мере повышения температуры в результате окисления фосфора глубина окисления возрастает – образуются РCl5 и РВг5.
Фтор реагирует с графитом при температуре выше 900 °С:
Остальные галогены не реагируют с простыми веществами, образованными углеродом (алмазом, графитом).
3. Реакции с водой.
Рассмотрим реакции галогенов со сложными веществами. Галогены взаимодействуют с водой. При этом фтор окисляет кислород воды. Пары воды горят в атмосфере F2:
Хлор обратимо реагирует с водой, но при этом не происходит окисление кислорода. В этой реакции хлор сам является как окислителем, так и восстановителем (такие реакции называют реакциями диспропорционирования):
5. Реакции галогенов с солями-галогенидами.
Галогены способны вытеснять друг друга из солей-галогенидов и из галогеноводородов. Фтор F2 вытесняет все остальные галогены из галогеноводородов и галогенидов (в растворах параллельно идёт реакция окисления воды). Хлор Cl2 вытесняет бром и йод из НВг, бромидов, HI и иодидов. Бром Вг2 вытесняет йод из йодидов и йодоводорода. Йод I2 не вытесняет другие галогены:
Признаком данной реакции в растворе является изменение окраски с бесцветной на жёлтую.
Конспект урока по химии «Химические свойства галогенов». Выберите дальнейшее действие:
- Вернуться к Списку конспектов по химии
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии
История открытия йода
Йод был открыт в 1811г. Куртуа. При кипячении серной кислоты с рассолом золы морских водорослей он наблюдал выделение фиолетового пара, при охлаждении превращающегося в темные кристаллы с ярким блеском.
Элементная природа йода установлена в 1811-13гг. Гей-Люссаком.
Важнейшим природным источником йода служат буровые воды нефтяных и газовых скважин.
В начале 20в. основными мировыми поставщиками йода были держатели чилийских селитренных фабрик “Йодное объединение” и “Международный синдикат”, которые ограничивали добычу йода, задействуя лишь 30 из 160 фабрик (700т/год из потенциальных 4000) для поддержания на мировом рынке высоких цен. В Великобритании, Японии и Норвегии йод производился из морских водорослей. В 1914г. английские фирмы скупили и закрыли норвежские йодные заводы. Россия импортировала чилийский йод через германских и американских посредников вплоть до 1917г., когда специальная царская комиссия одобрила основание завода в Архангельске по добыче йода из водорослей Белого моря для нужд фронта. К 1923г. из-за сложности со сбором сырья завод стал убыточным и был распущен, его сотрудники открыли новый Жижгинский завод при поддержке йодного отделения Архангельского института промышленных изысканий и привлекая к сбору сырья поморов. Начав с 50кг йода в 1923г., в 1929г. заводчане получили 1-ю тонну йода. При ежегодной потребности СССР в 115т Госплан РСФСР выделил дополнительные средства на устройство еще 20 заводов на Беломорье, а также рассмотрел возможность добычи йода из нефтяных источников Апшеронского полуострова. В 1964г. на базе Славянско-Троицкого месторождения (единственного в России промышленного месторождения йодобромных вод) заработал Троицкий йодный завод с мощностью эксплуатационных запасов 200т/год. С распадом СССР и появлением на внутреннем рынке дешевого йода из Чили к середине 1990-х гг. предприятие стало убыточным, в 2015г. в связи с износом инфраструктуры добыча сырья прекратилась, в июне 2019г. завод признан банкротом, а в 2020г. куплен фармацевтическим предприятием “ЮжФарм”.
Применение брома
Бром это элемент химической таблицы, который имеет множество применений. Он используется для выработки моторных бензинов с повышенным качеством, а также находит широкое применение в фотографии и медицине.
Например, соединения брома широко применяются в производстве фотопленок и фотобумаги. Они также используются в медицине для лечения заболеваний щитовидной железы и как анестетики. Кроме того, бром используется в производстве огнезащитных составов, которые помогают предотвратить распространение огня в зданиях и автомобилях.
Таким образом, можно сделать вывод, что бром является важным элементом в нашей жизни, который находит широкое применение в различных областях, начиная от производства моторных бензинов и заканчивая медициной и огнезащитными составами.
В медицине
Бром, химический элемент принадлежащий к галогенам, широко применяется в медицине для лечения многих заболеваний. К примеру, бромиды используются как успокоительные и снотворные средства, а также как антиконвульсанты при лечении эпилепсии. Бром также применяется в качестве противовоспалительного средства, антисептика, противогрибкового и противовирусного препарата. Бром помогает уменьшить аллергические реакции, улучшить кровообращение, а также может снижать уровень тревожности и нервозности у пациентов. В некоторых случаях, бром может быть использован для лечения дерматита и других кожных заболеваний.
В фотографиях
Фотографические эмульсии и фоточувствительные материалы содержат бромиды, которые играют важную роль в создании изображений. Бромиды используются в фотоэмульсиях для улучшения их светочувствительности и контрастности. Они также могут служить в качестве промежуточных продуктов при синтезе других химических соединений. Кроме того, бромиды могут применяться в медицине, в частности, в качестве противосудорожного средства при лечении эпилепсии.
В химической промышленности
Бромовые соединения – это группа химических соединений, которые нашли широкое применение в различных областях науки и промышленности. Например, бромиды – это важный ингредиент в фотохимических процессах и медицине. Бромиды используются для лечения различных заболеваний, таких как эпилепсия, болезнь Паркинсона и т.д. Органобромные соединения, с другой стороны, широко используются в качестве реагентов в различных синтезах, таких как синтез медицинских препаратов и пищевых добавок. Бром также может использоваться в качестве катализатора в различных процессах, таких как полимеризация, альдольная конденсация и др. Например, бром может быть использован в производстве поликарбонатов, которые широко используются в автомобильной и строительной промышленности. Кроме того, бром может быть использован в качестве антипиренных и антисептических добавок в различных материалах, таких как текстиль, дерево и пластмассы.
Химические свойства водорода
С точки зрения свойств водорода как простого вещества, он, все-таки, имеет больше общего с галогенами. Водород, также как и галогены, является неметаллом и образует аналогично им двухатомные молекулы (H2).
В обычных условиях водород представляет собой газообразное, малоактивное вещество. Невысокая активность водорода объясняется высокой прочностью связи между атомами водорода в молекуле, для разрыва которой требуется либо сильное нагревание, либо применение катализаторов, либо и то и другое одновременно.
Взаимодействие водорода с простыми веществами
с металлами
Из металлов водород реагирует только с щелочными и щелочноземельными! К щелочным металлам относятся металлы главной подгруппы I-й группы (Li, Na, K, Rb, Cs, Fr), а к щелочно-земельным — металлы главной подгруппы II-й группы, кроме бериллия и магния (Ca, Sr, Ba, Ra)
При взаимодействии с активными металлами водород проявляет окислительные свойства, т.е. понижает свою степень окисления. При этом образуются гидриды щелочных и щелочноземельных металлов, которые имеют ионное строение. Реакция протекает при нагревании:
Следует отметить, что взаимодействие с активными металлами является единственным случаем, когда молекулярный водород Н2 является окислителем.
с неметаллами
Из неметаллов водород реагирует только c углеродом, азотом, кислородом, серой, селеном и галогенами!
Под углеродом следует понимать графит или аморфный углерод, поскольку алмаз — крайне инертная аллотропная модификация углерода.
При взаимодействии с неметаллами водород может выполнять только функцию восстановителя, то есть только повышать свою степень окисления:
Взаимодействие водорода со сложными веществами
с оксидами металлов
Водород не реагирует с оксидами металлов, находящихся в ряду активности металлов до алюминия (включительно), однако, способен восстанавливать многие оксиды металлов правее алюминия при нагревании:
c оксидами неметаллов
Из оксидов неметаллов водород реагирует при нагревании с оксидами азота, галогенов и углерода. Из всех взаимодействий водорода с оксидами неметаллов особенно следует отметить его реакцию с угарным газом CO.
Смесь CO и H2 даже имеет свое собственное название – «синтез-газ», поскольку из нее в зависимости от условий могут быть получены такие востребованные продукты промышленности как метанол, формальдегид и даже синтетические углеводороды:
c кислотами
С неорганическими кислотами водород не реагирует!
Из органических кислот водород реагирует только с непредельными, а также с кислотами, содержащими функциональные группы способные к восстановлению водородом, в частности альдегидные, кето- или нитрогруппы.
c солями
В случае водных растворов солей их взаимодействие с водородом не протекает. Однако при пропускании водорода над твердыми солями некоторых металлов средней и низкой активности возможно их частичное или полное восстановление, например:
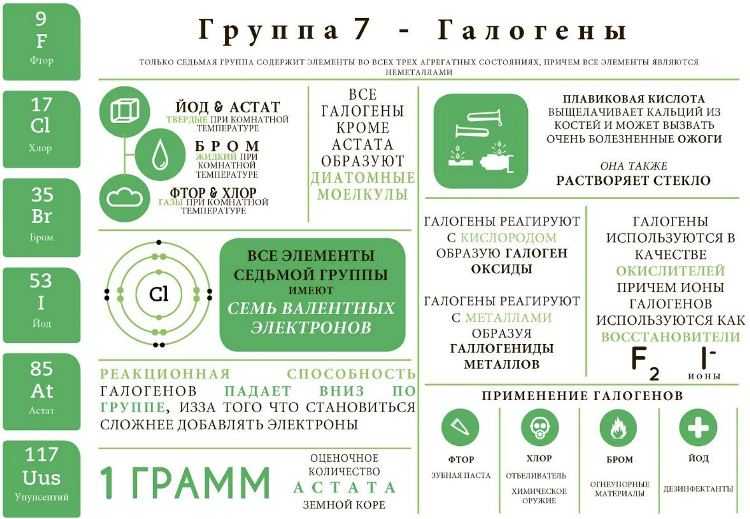
Применение галогенов
Галогены и их соединение нашли широкое применение во всех отраслях промышленности: пищевой, химической, сельскохозяйственной.
Применение простых веществ галогенов
Простые вещества используются для синтеза соответствующих кислот, а также, в производстве пластмасс и синтетических каучуков.
Хлор активно используется в реакциях органического синтеза, так как способен замещать ионы водорода по радикальному механизму.
Бром менее реакционно способен. Он используется в жидком виде. Бром способен участвовать в тех же реакциях, что и хлор, но менее ярко. Часто он применяется для идентификации органических соединений с кратными (двойными и тройными) связями.
Основные области применения йода – медицина и химическая промышленность.
В органической химии йод используется для идентификации сложных комплексов, например, крахмала. В медицине используется в качестве наружного обеззараживающего раствора, так как окисляет стенки бактерий.
Астат использует в радиоактивной химии.
Использование соединений галогенов
Кристалл фтора криолит Na3AlF6 применяется для получения чистого алюминия. Добавки фтора используются в лечебных зубных пастах, так как фтор является основным компонентом эмали зубов.
Соединения хлора используются для производства кислот и в синтетической промышленности.
Наличие в природе
Йода не очень много в земной коре. По оценкам, его количество составляет от 0,3 до 0,5 частей на миллион. Он находится в нижней трети элементов, с точки зрения изобилия. Но, тем не менее, он более распространён, чем кадмий, серебро, ртуть и золото. Его содержание в морской воде ещё меньше — около 0,0003 частей на миллион.
Этот элемент, как правило, концентрируется в земной коре лишь в нескольких местах, когда-то покрытых океанами. За миллионы лет океаны испарились и оставили химические соединения, которые были растворены в них и сегодня существуют под землёй, как соляные копи.
Существует возможность собирать этот элемент из морской воды, солоноватой воды, рассола или морских водорослей. Морская вода имеет разные названия, в зависимости от количества растворенных в ней твёрдых веществ. Водоросли являются популярным источником йода, так как поглощают элементы из морской воды. Со временем они начинают иметь гораздо более высокую концентрацию йода, чем морская вода. Морскую водоросль собирают, сушат и сжигают для сбора вещества. Процесс мало чем отличается от того, который использовал Куртуа в 1811 году.
Нахождение в природе
Ампула с бромом внутри акрилового куба
Кларк брома — 1,6 г/т. Бром широко распространён в природе и в рассеянном состоянии встречается почти повсеместно. Почти все соединения брома растворимы в воде и поэтому легко выщелачиваются из горных пород. Как примесь он есть в сотнях минералов. Но имеется лишь небольшое количество нерастворимых в воде минералов — галогенидов серебра и меди. Самый известный из них — бромаргирит AgBr. Другие минералы — йодобромит Ag(Br, Cl, I), эмболит Ag(Cl, Br). Собственных минералов брома мало ещё и потому, что его ионный радиус очень большой и ион брома не может надёжно закрепиться в кристаллической решетке других элементов, вместе с катионами средних размеров. В накоплении брома основную роль играют процессы испарения океанической воды, в результате чего он накапливается как в жидкой, так и в твёрдой фазах. Наибольшие концентрации отмечаются в конечных маточных рассолах. В горных породах бром присутствует главным образом в виде ионов, которые мигрируют вместе с грунтовыми водами. Часть земного брома связана в организмах растений в сложные и большей частью нерастворимые органические соединения. Некоторые растения активно накапливают бром. Это в первую очередь бобовые — горох, фасоль, чечевица, а также морские водоросли. В море сосредоточена большая часть брома. Есть он и в воде солёных озёр, и в подземных водоносных пластах, сопутствующих месторождениям горючих ископаемых, а также калийных солей и каменной соли. Есть бром и в атмосфере, причем содержание этого элемента в воздухе приморских районов всегда больше, чем в районах с резко континентальным климатом.
В качестве исходного сырья для производства брома служат:
- морская Вода (65 мг/л),
- рассолы соляных озёр,
- щёлок калийных производств,
- подземные воды нефтяных и газовых месторождений.
Краткая характеристика соединений брома и йода
Чтобы начать рассмотрение различий, нужно обратить внимание на характеристику каждого из элементов. Только после сравнения будет наглядно видна разница между ними. Для того чтобы определить основное отличие рассматриваемых веществ, рекомендуется рассмотреть их основные свойства
Для того чтобы определить основное отличие рассматриваемых веществ, рекомендуется рассмотреть их основные свойства.
Бром обозначается в периодической таблице, как Br. Атомный номер (число, по которому можно найти) — 35.
В обычных условиях, при комнатной температуре и без нагревания или охлаждения вещество имеет коричнево-красный оттенок. Представляет собой жидкость.
Особенность брома состоит в том, что этот химический элемент хотя и относится к группе неметаллов, но когда температура комнатная, он находится в жидком агрегатном состоянии.
Особенности, которые необходимо учитывать:
- галогенид;
- имеет неприятный запах;
- пары коричневого цвета.
Галогены инфографика
Молекула обозначается в формулах, как Br₂ . Если сравнивать его с йодом, то с химической точки зрения этот металл является более активным, чем йод. Одновременно он уступает по этому показателю таким веществам, как хлор или фтор (или соединениям, таким как фторид).
Бром — вещество природного происхождения. Месторождения имеются в Китае или Америке.
С помощью электролиза можно извлечь бром из солевых отложений. Это первое вещество, которое удалось получить из морской воды.
Теперь нужно разобраться с тем, что представляет собой молекула йода и вещество в целом. Объединяет его с бромом то, что элемент является галогеном. Атомный номер — 53.
Нужно обратить внимание на то, что вещество находится в твердом состоянии при нормальных условиях (комнатной температуре и обычном давлении). Йод относится к группе неметаллов. Важен тот факт, что вещество представляет собой кристалл
Цвет черный с характерным блеском
Важен тот факт, что вещество представляет собой кристалл. Цвет черный с характерным блеском.
Если же происходит нагрев и последующее кипение, элемент преобразуется. Возникает пар, который имеет фиолетовый оттенок. В воде йод и его соединения растворяется плохо, но достаточная активность проявляется при взаимодействии с неполярными растворителями, такими, как, например, гексан.

Йод в привычном виде