Химические свойства
Кислород является необходимым для дыхания процессом, позволяющим организмам получать энергию. Он находится в атмосфере и образует около 21% ее состава. Концентрация кислорода в атмосфере остается стабильной благодаря постоянному обмену газами между организмами и окружающей средой.
Озон также присутствует в атмосфере, но его концентрация намного ниже, поскольку он образуется в результате фотохимической реакции между кислородом и ультрафиолетовым излучением. Этот процесс происходит на высоте около 20-30 километров от земной поверхности.
Однако, в некоторых случаях, таких как промышленные выбросы или автомобильные выбросы, концентрация озона может возрастать, особенно в городах. Это может привести к образованию фотохимического смога, который негативно влияет на здоровье людей и окружающую среду.
Озон имеет свойства защищать Землю от вредного ультрафиолетового излучения, блокируя его проход в атмосферу. Однако при нарушении равновесия, например, из-за разрушения озонового слоя, увеличивается проникновение ультрафиолетовых лучей, что может вызывать различные заболевания у людей и повреждение экосистемы.
Таким образом, химические свойства кислорода и озона различаются, их концентрация в атмосфере регулируется разными процессами, а их влияние на окружающую среду и здоровье человека может быть как положительным, так и отрицательным.
Степень окисления
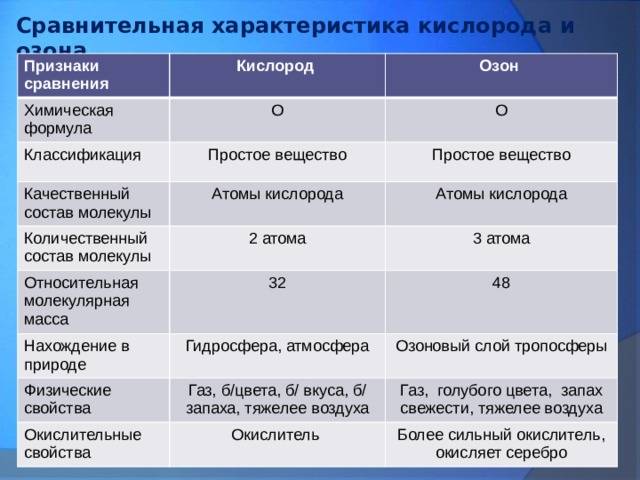
Кислород (O2) — это атмосферный газ, который составляет около 21% общего объема атмосферы. Он является жизненно важным для всех организмов, поскольку используется в процессе дыхания для получения энергии. Кислород имеет молекулярную структуру и обладает нулевой степенью окисления.
Озон (O3) — это также форма кислорода, но с отличной структурой и степенью окисления. Озон состоит из трех атомов кислорода и обеспечивает защиту окружающей среды от вредных ультрафиолетовых лучей солнца.
Разница в степени окисления между кислородом и озоном обусловлена различными способами их образования. Кислород образуется в атмосфере как результат процессов фотосинтеза и фотодиссоциации. Озон, напротив, формируется в реакции между кислородом и ультрафиолетовым излучением в стратосфере.
Концентрация кислорода и озона в атмосфере также различается. Кислород преобладает в нижних слоях атмосферы, в то время как озон обычно находится в стратосфере.
Таким образом, степень окисления является одним из фундаментальных отличий между кислородом и озоном. Они имеют разную структуру, различные способы образования и разное распределение в атмосфере.
Реактивность и активность
Озон образуется в атмосфере благодаря фотохимической реакции между кислородом и ультрафиолетовым излучением от Солнца. Этот процесс называется озоновым образованием. Высокая концентрация озона приводит к образованию фотохимического смога, который может быть опасным для дыхания и окружающей среды.
Кислород в атмосфере более стабилен и менее реактивен по сравнению с озоном. Он является необходимым для дыхания живых организмов и играет важную роль в окружающей среде. Концентрация кислорода в атмосфере обычно составляет около 21 процента.
Окислительные свойства
Окислительные свойства озона означают, что он может реагировать с различными веществами и соединениями. Озон активно взаимодействует с органическими и неорганическими веществами, разрушая их структуру и меняя их химические свойства.
Одним из наиболее известных последствий окислительных свойств озона является его роль в формировании фотохимического смога. Этот тип смога образуется в результате реакции озона с загрязняющими веществами, такими как оксиды азота и углеводороды, в присутствии солнечного света.
Концентрация озона в атмосфере является важным показателем ее качества. Высокая концентрация озона может быть вредной для живых организмов, в том числе для людей, животных и растений. Она может вызывать различные респираторные проблемы, агрессивно воздействовать на легкие и приводить к развитию аллергий и других заболеваний.
Кислород (О2) также имеет окислительные свойства, но они гораздо слабее, чем у озона. Концентрация кислорода в атмосфере не является проблемой для здоровья людей и других организмов, так как он является основным компонентом воздуха, необходимым для дыхания.
Пути образования озона в атмосфере связаны с рядом химических реакций, включая фотохимическую реакцию между кислородом и ультрафиолетовым излучением. Этот процесс особенно активен в присутствии загрязняющих веществ, особенно оксидов азота.
§26. Озон. Аллотропия кислорода
1. Какое значение имеет озон для жизни на Земле? Используя дополнительные источники информации, узнайте, над какими участками Земли озоновый слой наиболее тонкий.
Озоновый слой, находящийся на высоте 20-25 км защищает всё живое на Земле от губительного воздействия космического излучения. Наиболее тонкий озоновый слой располагается над Антарктикой.
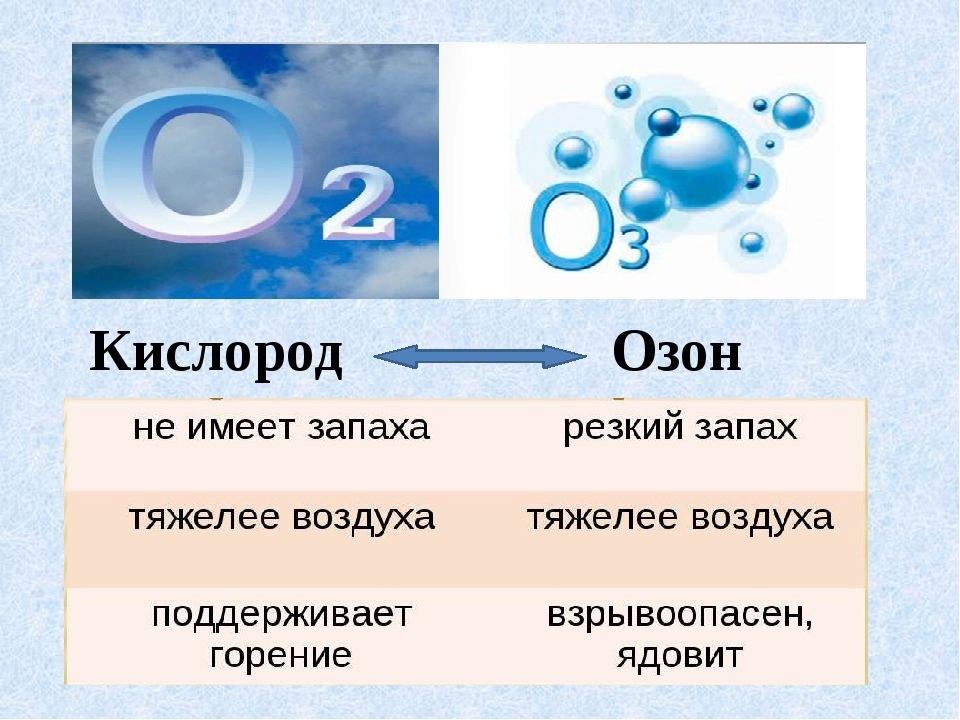
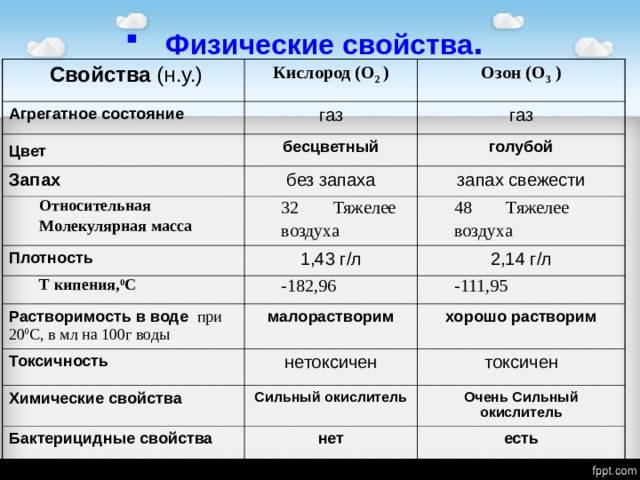
2. Сравните свойства кислорода и озона. На основе этих примеров поясните сущность аллотропии.
| Кислород | Озон | |
|---|---|---|
| Физические свойства | Бесцветный газ, без вкуса и запаха. Малорастворим в воде. | Голубой газ с характерным запахом. Плотность в 1,5 раза больше, чем у кислорода. Намного лучше растворяется в воде, чем кислород. |
| Химические свойства | Взаимодействует с многими веществами при нагревании с выделением тепла и света. | Значительно более активен, чем кислород. Это связано с тем, что молекула озона распадается на 1 атом и 1 молекулу кислорода : O3 = O2 + O. В атмосфере озона некоторые вещества (спирт, фосфор) воспламеняются. Каучук становится хрупким, а красители обесцвечиваются. |
Сущность аллотропии заключается в способности химического элемента образовывать несколько простых веществ, которые различаются между собой физическими и химическими свойствами.
3. Расскажите соседу по парте об озоне по следующему плану : 1) нахождение в природе; 2) получение; 3) свойства;4) применение.Оцените работу друг друга.
Нахождение в природеВ природе озон образуется во время грозы под действием электрических разрядов – молний. В лесах озон образуется в результате окисления смолы хвойных деревьев. Озон постоянно образуется также в верхних слоях атмосферы на высоте 20-25 км.
ПолучениеОзон получают в специальных приборах – озонаторах. В озонаторе кислород превращается в озон под действием электрического разряда3O2 _постоянный ток⟶ 2O3
СвойстваПлотность озона в 1,5 раза больше плотности кислорода. Он намного лучше, чем кислород, растворяется в воде. Кроме того, его химическая активность значительно превышает активность кислорода. Так, в атмосфере озона некоторые вещества (например, фосфор и спирт) воспламеняются, каучук становится хрупким, а многие красители обесцвечиваются. Из-за высокой химической активности озон ядовит.
Высокая химическая активность озона объясняется тем, что его молекулы неустойчивы и легко распадаются с образованием атомов кислорода : O3 = O2 + O.Атомарный кислород намного активнее молекулярного.
ПрименениеВысокую химическую активность озона используют, в частности, при обеззараживании питьевой воды, воды в бассейнах, сточных вод. В воде, через которую пропускают озон, гибнут болезнетворные микроорганизмы.
Тест
1. Аллотропными модификациями являются1) кислород и водород2) кислород и озон3) натрий и калий4) алюминий и медьКислород и озон являются разными простыми веществами, образованными одним химическим элементом – кислородом. Кислород (O2) и озон (O3) Поэтому они являются аллотропными модификациями.Правильный ответ 2.
2. Озон получают1) в аппарате Киппа2) в озонаторе3) в кристаллизаторе4) в газометре Озон получают из кислорода в специальном аппарате – озонаторе : Правильный ответ 2.
3. Определите вещество по описанию : газ с характерным запахом свежести, голубого цвета, в 1,5 раза тяжелее кислорода.1) озон2) аммиак3) углекислый газ4) сероводородАммиак, углекислый газ и сероводород бесцветны, поэтому ответы 2,3,4 неверны.Правильный ответ 1.
Назад
Вперед
Применение промышленных озонаторов
Являясь в природе вторым по мощности после фтора окислителем, газ озон применяется не только в медицине, но и в промышленности.
Способность этого прибора обеззараживать широко используется, чтобы чистить воздух от микроорганизмов, содержать в чистоте оборудование и помещения. Такой озонатор отличается от бытового только своими размерами и мощностью. В зависимости от метража и уровня дезинфекции должны применяться определенные модели озонаторов.
Озонатор применяется, чтобы убрать неприятный запах и обогатить воздух кислородом. Он позволяет обеззаразить склады для продуктов питания и сами продукты, так как убивает плесень и бактерии. Это хорошая альтернатива обработке хлором, который достаточно ядовит и непригоден во многих отраслях пищевой промышленности. К тому же контактная влажная уборка намного более трудоемка и затратна, чем установка озонатора.
Применение озонатора способствует лучшему сохранению пищевых продуктов и увеличению срока их хранения за счет обеззараживающего эффекта и уничтожения тех организмов, которые вызывают гниение и порчу. Обрабатывание озоном в таких случаях дает легкий эффект консервации на ягоды, фрукты, овощи.
Еще одним немаловажным свойством озонатора является его способность уничтожать посторонние запахи. Результатом обработки этим препаратом всегда служит эффект дезодорации помещения с запахом свежего воздуха, как после дождя.
Высокая чувствительность к озону всевозможных грызунов позволяет без лишних затрат прогнать их из обрабатываемого помещения. Заслышав запах озона, они спешно бегут из зоны поражения, а те, что не убегают – погибают.
Озон используют для обработки холодильников: обеззараживают и также избавляют их от посторонних запахов. При обработке озонатором холодильника около часа достигается дезинфекция не только основной камеры, но и поддонов, решеток, крюков и прочих элементов. Это позволяет избегать частых размораживаний и обходиться без влажной механической дезинфекции небезопасным хлором, который выделяет при нанесении токсические соединения. При этом продукты, которые содержатся в камерах, можно также подвергнуть дезинфекции: например, мясные продукты увеличат свой срок годности после такой обработки и улучшится их качество.
Для увеличения срока годности продуктов также используется озонированная вода, получаемая с помощью воздействия озонатора на воду с определенной мощностью и периодичностью.
Получение и производство[править | править код]
Озон образуется во всех процессах которые сопровождаются выделением атомарного кислорода (разложение перекисей, окисление фосфора, электролизе кислородсодержащих кислот и т. п.), а также при действии на кислород коротковолнового излучения (λ<2000 Α) и потоков быстрых частиц (электронов, протонов и др.). Очень малые количества озона могут быть получены в лабораторной практике путём слабого нагревания в пробирке персульфата аммония с концентрированной азотной кислотой или взаимодействием концентрированной серной кислоты с перекисью бария.
Промышленное получение озонаправить | править код
Получение в озонаторах
В промышленных условиях озон производят в озонаторах. Разрядный промежуток озонатора ограничен одним или двумя диэлектрическими электродами, которые стабилизируют ток разряда по поверхности. Электропитание озонаторов осуществляется переменным током, при том мощность озонатора пропорциональна частоте потребляемого тока. Важнейшей характеристикой любого озонатора является отношение активной мощности озонатора к расходу обрабатываемого газа. Как правило с ростом концентрации озона в озонаторе, энергетический выход озона падает и КПД озонатора снижается. Это обусловлено происходящим одновременно с образованием распадом озона. Для повышения выхода озона и увеличения КПД озонатора применяются следующие меры: тщательна осушка вводимого кислорода (точка росы ниже -50°С), охлаждение вводимого кислорода, снижение примесей азота и других газов в водимом кислороде. В современных промышленных озонаторах расход энергии на получение озона достигает 10-15 кВт/кг озона. Следует отметить что применение вместо кислорода обыкновенного атмосферного воздуха снижает выход озона в 3-5 раз, увеличивает расход энергии и получаемый озон сильно загрязнён окислами азота, и этот способ в промышленности практикуется крайне редко.
Электролитический способ
В гораздо более значительных количествах и с меньшим расходом энергии озон производится электролитически. Так как например для потребностей современной химической промышленности и ракетной техники нужен наиболее дешёвый озон, то разработан способ его производства в больших количествах. Способ заключается в электролитическом разложении 40-50% водных растворов хлорной кислоты постоянным током при температурах -50 -60°С. Этот способ чрезвычайно эффективен, и средний выход озона в составе кислородного электродного газа составляет 20-30 вес %. Процесс электролитического получения озона проводится под постоянным уменьшенным давлением (0,1 атм).
Как отличить кислород от озона химическим способом
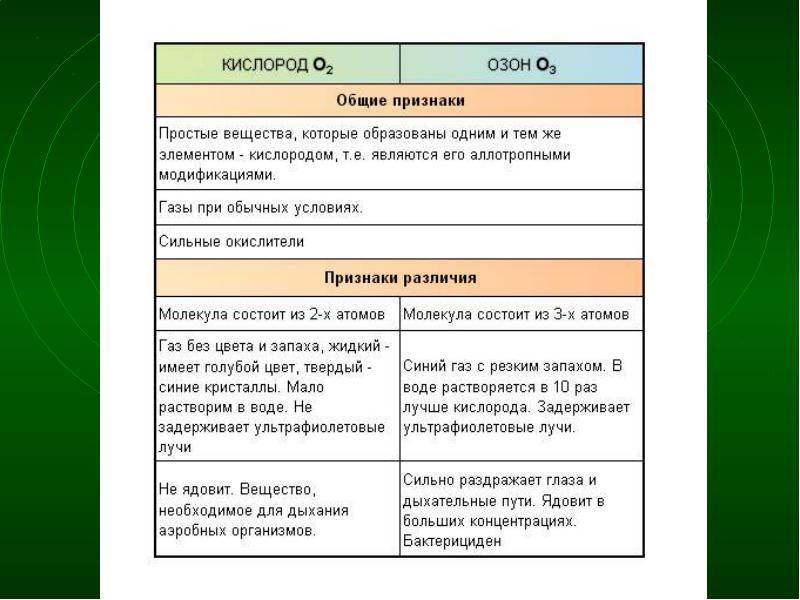
Озон (от др.-греч. ὄζω — пахну) — состоящая из трёхатомных молекул O3 аллотропная модификация кислорода. При нормальных условиях — голубой ядовитый газ. Запах — резкий специфический. При сжижении превращается в жидкость цвета индиго.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Кислород в природе встречается в виде двух простых веществ: кислорода
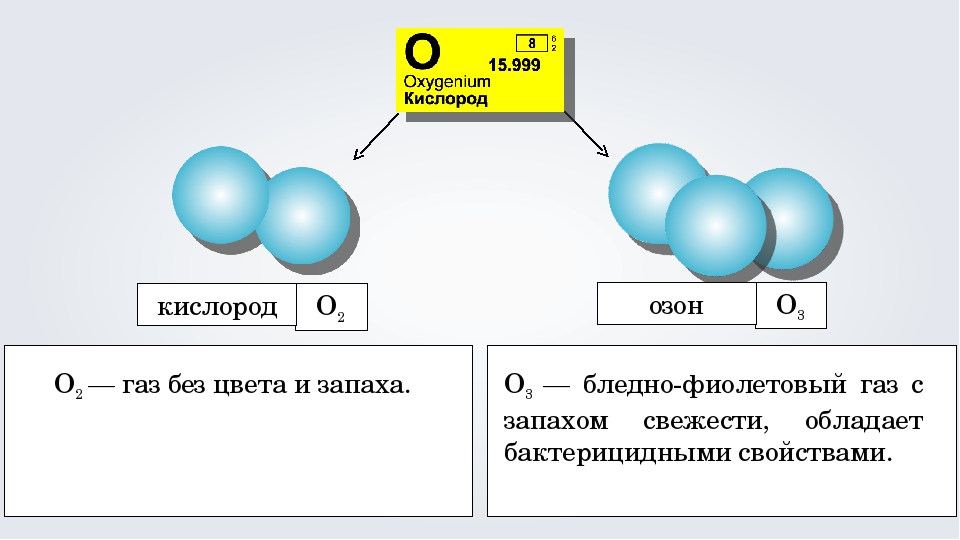
Явление образования нескольких простых веществ одним элементом называется аллотропией (рис. 37). Разные простые вещества, образованные одним и тем же химическим элементом, называются аллотропными видоизменениями (модификациями).
Формула озона
Химические свойства озона
Озон химически более активен, чем кислород, и может окислять благородные металлы: золото, серебро, платину:
Активность озона обусловлена его разложением на молекулярный и атомарный кислород:
Этим же объясняется свежесть воздуха после грозы в сосновом бору. Атомарный кислород – более сильный окислитель, чем молекулярный. Данное свойство применяется при обеззараживании питьевой воды и при отбеливании ткани, бумаги, соломы и т. д. Применение озона при обеззараживании вместо хлора экологически более выгодно. Озон, окисляя примеси сточных вод, превращается в кислород.
В верхних слоях атмосферы на высоте 25 км над землей (в стратосфере) образуется тонкий слой озона , который защищает Землю от чрезмерной дозы ультрафиолетовых лучей (УФО) Солнца (рис. 38). Этот слой разрушается под воздействием различных факторов («озоновые дыры»). Например, при запуске ракетоносителя космического корабля, а также двигатели самолетов выбрасывают в верхние слои атмосферы определенную массу оксидов азота (II).
Оксид азота (II) вступает в реакцию с озоном:
Это приводит к всевозможным природным катаклизмам (глобальное потепление, таяние ледников и айсбергов, цунами, тайфуны, сели, торнадо и т. д.).
Практическая работа №3 Получение кислорода и изучение его свойств
Цель: учащиеся самостоятельно проводят работу, изучают свойства кислорода. Знать свойства кислорода как окислителя.
Ход работы
1. Соберите прибор по рис. 30 (с. 88).
2. В колбу наберите немного раствора пероксида водорода с помощью капельной воронки.
3. Всыпьте в колбу заранее приготовленный диоксид марганца. Затем колбу закройте пробкой с газоотводной трубкой. Что наблюдаете?
4. Соберите выделившийся кислород в большие пробирки.
5. В железную ложку положите небольшой кусочек серы, зажгите его в пламени спиртовки и внесите в сосуд с кислородом, постепенно опуская ложечку.
6. После сжигания серы влейте в сосуд немного воды, закройте сосуд и хорошо взболтайте, затем подействуйте индикатором – метилоранжем.
Услуги по химии:
Лекции по химии:
Лекции по неорганической химии:
Лекции по органической химии:
Присылайте задания в любое время дня и ночи в ➔
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
Источник
Получение и применение озона
Получают озон при действии электрических разрядов на кислород в озонаторах.
Озон применяют для обеззараживания питьевой воды, для обезвреживания промышленных сточных вод, в медицине – в качестве дезинфицирующего средства. Также как и хлорирование, озонирование обладает обеззараживающим эффектом, но его плюсом является то, что при использовании озона в обработанной воде не образуется токсинов. Озон также эффективно борется с плесенью и бактериями.
Рис. 3. Озонирование.
При остром отравлении озон поражает органы дыхания, раздражает слизистые глаз, вызывает головную боль. Токсичность озона резко возрастает при одновременном воздействии оксидов азота.
Что мы узнали?
Озон – газ, который был обнаружен в конце XVIII века, а свое современное название получил только в середине XIX века. В отличие от кислорода этот газ имеет характерный запах и отличается светло-синим цветом.
/5
Вопрос 1 из 5
Атмосферный озон[править | править код]
Естественный атмосферный озонправить | править код
Озон является постоянным компонентом атмосферы Земли и играет важную роль для поддержания на ней жизни. В приземных слоях земной атмосферы концентрация озона чрезвычайно мала и составляет величину порядка 10-7 — 10-6%. Однако с увеличением высоты концентрация озона резко возрастает, проходя через максимум на высоте 20—30 км. Общее содержание озона в атмосфере может быть охарактеризовано слоем озона, приведённого к нормальным условиям (0°С, 1 атм), и составляет толщину около 0,4—0,6 см. Общее содержание озона в атмосфере переменное, и колеблется в зависимости от времени года и географической широты. Как правило, концентрация озона больше в высоких широтах и максимальна весной, а минимальна осенью. Известно, что атмосферный озон играет ключевую роль для поддержания жизни на земле, выступая в качестве защитной составляющей для живых организмов от жёсткого ультрафиолетового излучения Солнца. С другой стороны, озон является весьма эффективным парниковым газом, и, поглощая инфракрасное излучение поверхности Земли, препятствует её охлаждению. Установлено, что нахождение и перемещение масс озона в атмосфере Земли существенно влияет на метеорологическую обстановку на планете.
Так же существует теория, по которой, в соответствии с формулой “3O2 + 68 ккал (285 кДж) ←→ 2O3”, озон является не защитником планеты от жестких ультрафиолетовых излучений, а лишь побочным продуктом, т.е. жесткое ультрафиолетовое излучение (которое является видом солнечной энергии) поглощает кислород, отнимая от вредного излучения 68 ккал (285 кДж) с образованием озона, эта реакция идет в верхних слоях атмосферы и продолжается до тех пор пока жесткое ультрафиолетовое излучение не потеряет всю энергию достаточную для образования озона. Доказательством этой теории может служить и то что озон тяжелее кислорода, и другим образом, кроме как преобразование из кислорода под действием солнечной энергии, взяться в верхних слоях атмосферы озону неоткуда. Соответственно становится понятно почему над полюсами земли содержание озона минимально, солнечная активность над полюсами очень слаба, лучи идут под большими углами да и по пол года вообще не бывает света, энергии поглощается мало следовательно и озона образуется мало.
Техногенный озонправить | править код
В некоторых технологических процессах (работа с высокими напряжениями, электросварка, с источниками ультрафиолетового излучения) озон может образоваться в концентрациях, превышающих ПДК.
Так, появление озона на рабочем месте рабочего – ксерокопировальщика рассматривается как фактор профессиональной вредности.
Озон в питьевой водеправить | править код
Озонирование как метод обеззараживания воды используется чаще и чаще, однако повреждающий эффект свободных радикалов, образующихся при взаимодействии озона с биологическими материалами, сопоставим с повреждающим эффектом молекулярного хлора.
Ошибочная идентификация озонаправить | править код
В ряде случаев наличие озона в воздухе идентифицировалось по запаху и окисляющим свойствам атмосферы. Такая идентификация не всегда верна – за озон принимали оксиды азота, перекисные соединения и др. вещества со сходным запахом.
Физические свойства
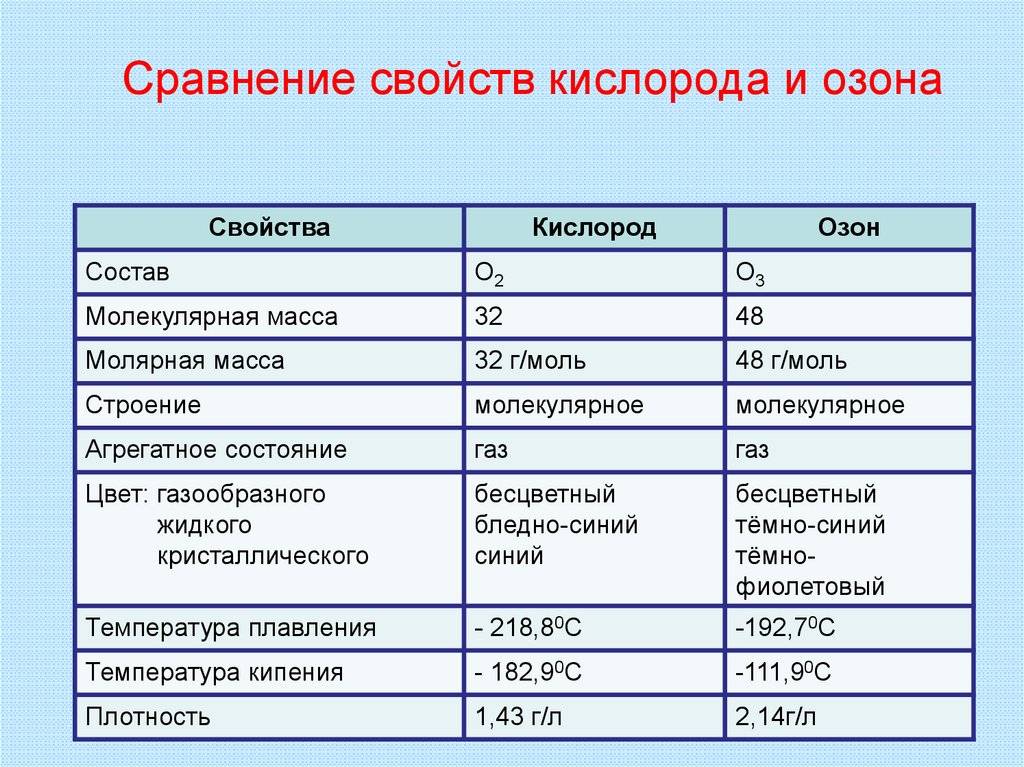
Озон и кислород являются газообразными химическими элементами и отличаются некоторыми физическими свойствами.
Одно из главных отличий между озоном и кислородом заключается в их агрегатном состоянии при обычных условиях. Кислород представлен в виде двухатомных молекул (O2), которые образуют газовую среду воздуха. Озон же обладает трехатомной молекулой (O3) и является газообразным веществом.
Еще одно отличие связано с цветом. Кислород не обладает цветом и прозрачен для глаз человека. Озон же имеет характерный бледно-голубой цвет, который можно наблюдать при его концентрации в атмосфере.
Также озон является сильным окислителем, в отличие от кислорода. Это свойство делает его непригодным для дыхания, поскольку его взаимодействие с тканями организма может привести к разрушительным последствиям.
Наконец, озон обладает характерным запахом, в отличие от кислорода, который не имеет выраженного запаха. Это свойство озона может помочь в его обнаружении в атмосфере или при его применении в определенных областях, таких как очистка воды или воздуха.
Кислород
Кислород и озон — два различных элемента, отличающихся своими свойствами и функциями. Кислород (O2) — это химический элемент, который находится в воздухе и необходим для дыхания живых организмов. Он играет важную роль в окислительных процессах, обеспечивая энергией клетки и поддерживая жизнь на Земле. Он не имеет запаха и цвета.
Озон (O3), с другой стороны, является газообразным аллотропным видом кислорода. Он образуется в атмосфере Земли при взаимодействии кислорода с ультрафиолетовым излучением от Солнца. Озон обладает специфическим запахом и имеет голубоватый цвет. Он ограждает Землю от вредного ультрафиолетового излучения и играет важную роль в защите живых организмов от его воздействия.
Кислород и озон также различаются по своим физическим свойствам. Кислород при комнатной температуре и давлении является газом, который легко растворяется в воде. Озон, с другой стороны, имеет более высокую плотность и образует голубоватые кристаллы при очень низких температурах.
Важно отметить, что хотя оба элемента — кислород и озон — играют важную роль в поддержании жизни на Земле, их использование и воздействие на окружающую среду сильно различаются. Кислород несомненно является жизненно важным для дыхания и обеспечения энергетических процессов в клетках, тогда как озон, является газом, который на высоких концентрациях может быть токсичным для живых организмов и вызывать проблемы здоровью
Озон
Озон — это особая разновидность кислорода, которая имеет молекулярную формулу O3. Он существенно отличается от обычного кислорода (O2) как по своим химическим свойствам, так и по своим физическим характеристикам.
Отличительной особенностью озона является его сильная окислительная активность. Благодаря этому свойству, озон широко применяется в промышленности и медицине для дезинфекции воздуха и воды, а также для лечения некоторых заболеваний.
Озон обладает довольно высокой токсичностью, поэтому его повышенные концентрации в атмосфере могут быть вредными для живых организмов. В то же время, озон в верхних слоях атмосферы выполняет важную задачу — он защищает нас от вредного ультрафиолетового излучения, благодаря чему играет ключевую роль в формировании озонового слоя Земли.
Озон образуется в атмосфере благодаря действию ультрафиолетовых лучей на кислородные молекулы. Поэтому его наиболее высокие концентрации наблюдаются в стратосфере, на высоте около 20-30 километров над поверхностью Земли. На нижних слоях атмосферы концентрация озона гораздо ниже.
Физические свойства
- Молекулярная масса — 48 а. е. м.
- Плотность газа при нормальных условиях 2,1445 г/дм³. Относительная плотность газа по кислороду 1,5; по воздуху 1,62 (1,658).
- Плотность жидкости при −188 °C (85,2 К) составляет 1,59(7) г/см³.
- Плотность твёрдого озона при −195,7 °С (77,4 К) равна 1,73(2) г/см3.
- Температура кипения −111,8(3) °C (161,3 К). Жидкий озон — тёмно-фиолетового цвета.
- Температура плавления −197,2(2) °С (75,9 К) Приводимая иногда т.пл. −251,4 °C (21,7 К) ошибочна, так как при её определении не учитывалась большая способность озона к переохлаждению. По другим сведениям Tпл = −192,5(4) °С (80,6 К). В твёрдом состоянии — чёрного цвета с фиолетовым отблеском.
- Критическая температура −12,0 °С (261,1 К).
- Критическое давление 51,6 атм.
- Коэффициент диффузии (при 300 К, 1 атм) 0,157 см2/с.
- Теплота плавления 2,1 кДж/моль.
- Теплота испарения при температуре кипения в различных источниках указывается от 11,17 до 15,19 кДж/моль; при 90 К от 15,27 до 16,6 кДж/моль.
- Растворимость в воде при 0 °С — 0,394 кг/м³ (0,494 л/кг), она в 10 раз выше по сравнению с кислородом. Кажущаяся растворимость сильно зависит от чистоты воды, поскольку примеси катализируют распад озона.
- Жидкий озон смешивается во всех отношениях с жидкими аргоном, азотом, фтором, метаном, углекислотой, тетрахлоруглеродом. Смешивается с жидким кислородом во всех отношениях при температуре выше 93 К, ниже этой температуры раствор расслаивается на две фазы.
- Хорошо растворяется в фреонах, образуя стабильные растворы (используется для хранения и перевозки).
- Потенциал ионизации молекулы 12,52 эВ.
- В газообразном состоянии озон диамагнитен, в жидком — слабопарамагнитен.
- Запах — резкий, специфический «металлический» (по Менделееву — «запах раков»). При больших концентрациях напоминает запах хлора. Запах ощутим даже при разбавлении 1:100000.
Применение озона
Применение озона обусловлено его свойствами:
- сильного окисляющего реагента:
- для стерилизации изделий медицинского назначения;
- при получении многих веществ в лабораторной и промышленной практике;
- для отбеливания бумаги;
- для очистки масел.
- сильного дезинфицирующего средства:
- для очистки воды и воздуха от микроорганизмов (озонирование);
- для дезинфекции помещений и одежды;
- для озонирования растворов, применяемых в медицине (как для внутривенного, так и для контактного применения).
Существенными достоинствами озонирования, по сравнению с хлорированием, является отсутствие токсинов (кроме формальдегида) в обработанной воде (тогда как при хлорировании возможно образование существенного количества хлорорганических соединений, многие из которых токсичны, например, диоксин) и лучшая, по сравнению с кислородом, растворимость в воде.
По заявлениям озонотерапевтов, здоровье человека значительно улучшается при лечении озоном (наружно, перорально, внутривенно и экстракорпорально), однако ни одно объективное клиническое исследование не подтвердило сколько-нибудь выраженный терапевтический эффект. Более того, при использовании озона в качестве лекарственного средства (особенно при непосредственном воздействии на кровь пациента) доказанный риск канцерогенного и токсического воздействия перевешивает любые теоретически возможные положительные эффекты, поэтому практически во всех развитых странах озонотерапия не признаётся лекарственным методом, а её применение в частных клиниках возможно исключительно с информированного согласия пациента.
В XXI веке многие фирмы начали выпуск так называемых бытовых озонаторов, предназначенных также для дезинфекции помещений (подвалов, комнат после вирусных заболеваний, складов, заражённых бактериями и грибками вещей), зачастую умалчивая о мерах предосторожности, необходимых при применении данной техники
Применение жидкого озона
Давно рассматривается применение озона в качестве высокоэнергетического и вместе с тем экологически чистого окислителя в ракетной технике. Общая химическая энергия, освобождающаяся при реакции сгорания с участием озона, больше, чем для простого кислорода, примерно на одну четверть (719 ккал/кг). Больше будет, соответственно, и удельный импульс. У жидкого озона большая плотность, чем у жидкого кислорода (1,35 и 1,14 г/см3 соответственно), а его температура кипения выше (−112 °C и −183 °C соответственно), поэтому в этом отношении преимущество в качестве окислителя в ракетной технике больше у жидкого озона. Однако препятствием является химическая неустойчивость и взрывоопасность жидкого озона с разложением его на O и O2, при котором возникает движущаяся со скоростью около 2 км/с детонационная волна и развивается разрушающее детонационное давление более 3·107 дин/см2 (3 МПа), что делает применение жидкого озона невозможным при нынешнем уровне техники, за исключением использования устойчивых кислород-озоновых смесей (до 24 % озона). Преимуществом подобной смеси также является больший удельный импульс для водородных двигателей, по сравнению с озон-водородными. На сегодняшний день такие высокоэффективные двигатели, как РД-170, РД-180, РД-191, а также разгонные вакуумные двигатели вышли по УИ на близкие к предельным параметры, и для повышения удельного импульса необходимо найти возможность перейти на новые виды топлива.
История открытия

Озон был открыт в 1785 году. Нидерландский физик Мартин Ван Марум обнаружил вещество во время проводимых им опытов. Учёный пропустил через воздух электрический ток, после чего возник незнакомый запах. В результате реакции получился неизвестный газ синеватого цвета. По окислительным свойствам вещество оказалось сильнее кислорода. Кроме того, неизвестный газ воздействовал на ртуть при нормальных условиях и заставлял её терять характерный блеск и прилипать к стеклу.
Ван Марум полагал, что это была некая электрическая материя. Но он не считал его открытие важным. Только через половину столетия этим газом снова заинтересовались учёные.
Немец Кристиан Фридрих Шенбейн тщательно изучил нераскрытую материю и её свойства. В 1840 году он дал веществу название «озон», что на греческом означает «пахнуть». Такое наименование было связано со специфическим запахом газа. По ошибке многие считают, что именно Шенбейн был первооткрывателем этой материи. Учёный провёл эксперимент, в ходе которого озон вытеснял иод из иодида калия. Эта качественная реакция позволяет определить наличие вещества при помощи иодкрахмальной бумаги, которая приобретает синий оттенок.
В 1880 году французские учёные Готфейль и Шаппюи смогли получить вещество из кислорода при температуре -23oC. Когда газ медленно сжимался, он постепенно приобретал тёмно-синий оттенок. Затем давление резко сбросили, а температура ещё понизилась, что привело к образованию фиолетовых капель жидкого озона. Если вещество не охлаждали или быстро сжимали, тогда оно переходило в кислород с мгновенной жёлтой вспышкой.