Что такое фермент
Фермент – это биологическая макромолекула, вырабатываемая живыми организмами для катализа биохимической реакции внутри клетки при температуре тела. Функция фермента незаменима для поддержания жизни. Все биохимические реакции, происходящие в живых организмах, зависят от катализаторов. До настоящего времени действие около 4000 ферментов хорошо известно. Ферменты действуют в мягких условиях, таких как температура тела и рН. Они катализируют реакции строительства и разрушения материалов внутри живых организмов. Функция ферментов очень специфична. Большинство ферментов состоят из глобулярных белков с высоким молекулярным весом. Глобулярные белки перестраиваются в мультибелковые комплексы. Некоторые ферменты требуют помощи кофакторов для их действия. Кофакторами являются неорганические ионы, такие как Mg2+Fe2+, Zn2+и Mn2+ или небольшие органические молекулы, называемые коферментами. Фермент может быть ингибирован или активирован путем связывания кофакторов с ферментом.
Рисунок 3: Фермент глюкозидаза
Ферменты подразделяются на шесть типов в зависимости от типа катализируемой ими реакции. Это оксидоредуктазы, трансферазы, лиазы, гидролазы, лигазы и изомеразы. Фермент гликозидаза, которая превращает мальтозу в две молекулы глюкозы, показан на рисунок 3.
Что нам известно о катализе
Катализ – это процесс изменения скорости химической реакции под влиянием различных веществ – катализаторов, участвующих в этом процессе и к концу реакции остающихся химически неизмененными. Если от добавления катализатора происходит ускорение химического процесса, то такое явление называют положительным катализом, а замедление реакции – отрицательным. Чаще всего приходится встречаться с положительным катализом. В зависимости от химической природы катализаторы разделяются на неорганические и органические. К последним относятся и биологические катализаторы – ферменты.
Для понимания действия катализаторов необходимо кратко остановиться на рассмотрении сущности катализа. Скорость любой химической реакции зависит от столкновений активных молекул реагирующих веществ. Активированной называется молекула, которая имеет определенный запас потенциальной энергии. Взаимодействие двух таких молекул произойдет только в том случае, если запас энергии этих молекул будет достаточным для преодоления сил сталкивания между ними – так называемого «энергетического барьера» реакции. Если реагирующие молекулы будут обладать большей величиной энергии, чем энергетический барьер, то реакция произойдет. Если же запаса энергии реагирующих тел недостаточно для преодоления энергобарьера, то они не будут взаимодействовать. В этом случае для протекания реакции необходимо активировать молекулы, т. е. сообщить им дополнительное количество энергии, которое в сумме с имеющейся потенциальной энергией в молекулах будет достаточным для преодоления энергетического барьера. Это дополнительное энергии называется «энергией активации!». Активировать молекулы можно путем нагревания, повышения давления, облучения др.
Сущность действия катализаторов заключается в том, что во-первых, они обладают способностью активировать молекулы реагирующих веществ, и, во-вторых, взаимодействие молекул (или веществ) происходит не в один, а в несколько этапов.
Таким образом, оказывается, что катализатор не только снижает энергические затраты на течение реакций, но и значительно повышает их скорость.
К основным характеристикам катализаторов относятся следующие: а) катализаторы могут ускорять только те химические реакции, которые вообще могут идти по своим термодинамическим законам, б) катализаторы не изменяют направление хода химической реакции, а только ускоряют достижение состояния равновесия.
Краткая история катализаторов, ферментов и катализа
Реакции катализа были известны людям на протяжении многих веков, но они не могли объяснить явления, которые они видели вокруг себя, такие как брожение вина до уксуса, закваска хлеба и т. Д. Именно в 1812 году русский химик Готтлиб Сигизмунд Константин Кирххоф изучал Разложение крахмала на сахар или глюкозу в кипящей воде в присутствии нескольких капель концентрированной серной кислоты. Серная кислота осталась неизменной после эксперимента и могла быть извлечена. В 1835 году шведский химик Йенс Якоб Берцелиус предложил название « катализ» от греческого термина «ката», означающий «вниз», и «лиин», означающий «ослабить».
Как только реакции катализа были поняты, ученые обнаружили много реакций, которые изменяли скорости в присутствии катализаторов . Луи Пастер обнаружил, что есть некоторый фактор, который катализировал его эксперименты по ферментации сахара и который был активен только в живых клетках. Этот фактор позже был назван «ферментом» немецким физиологом Вильгельмом Кюне в 1878 году. Фермент происходит от греческого слова, означающего «в закваске». В 1897 году Эдуард Бюхнер назвал фермент, сбраживающий сахарозу, зимазой. Его эксперименты также доказали, что ферменты могут функционировать вне живой клетки. В конце концов были обнаружены структура и функции различных ферментов, катализирующих важные функции.
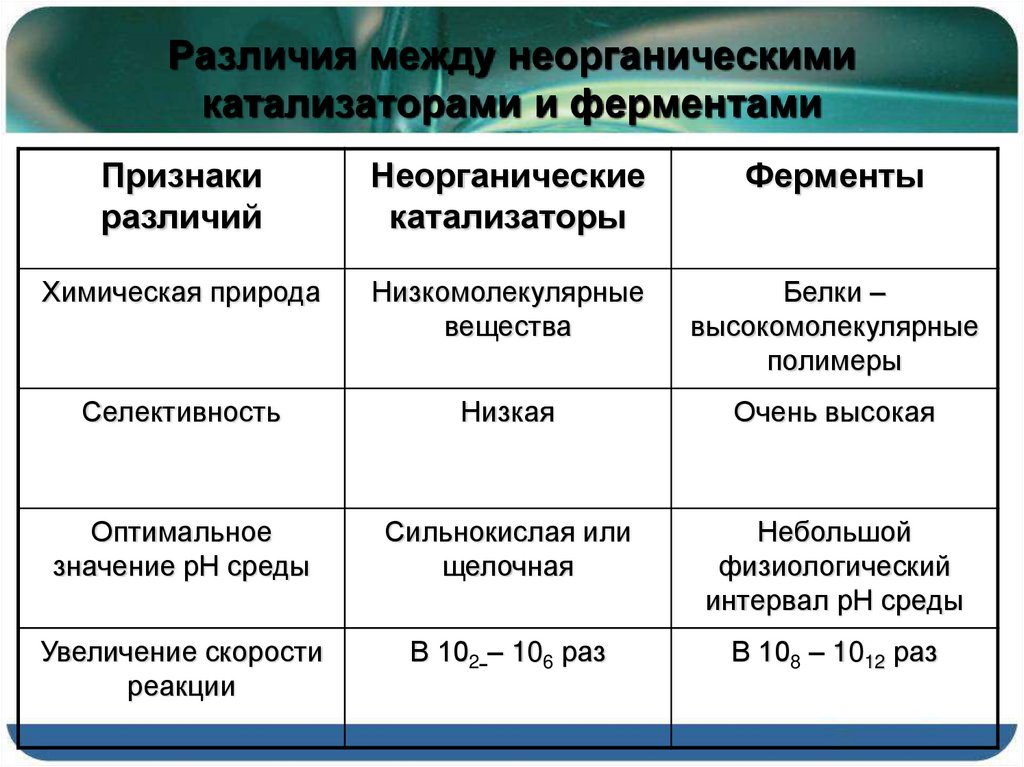
Сравнительная таблица
| Ферменты | Неорганические катализаторы |
| Глобулярные белки называются ферментами. | Маленькие молекулы или минеральные ионы называются неорганическими катализаторами. |
| Размер | |
| Ферменты представляют собой сложные макромолекулы и также имеют трехмерную структуру. | Неорганические катализаторы имеют молекулы небольшого размера. |
| Сравнение с субстратом | |
| Размер фермента довольно велик по сравнению с размером молекул субстрата. | Разница между размерами молекул неорганического катализатора и субстрата очень мала. |
| регулирование | |
| Конкретный тип молекул отвечает за регуляцию ферментов. | Ни одна из регуляторных молекул не может регулировать неорганические катализаторы. |
| Ускорение Реакции | |
| Ферменты могут ускорять определенную реакцию субстрата. | Разнообразные реакции могут быть ускорены неорганическими катализаторами. |
| Синтез | |
| Рибосомы, присутствующие в живых клетках, ответственны за синтез ферментов. | Живые клетки не играют никакой роли в синтезе неорганических катализаторов. |
| температура | |
| Ферменты более чувствительны к температуре. | Неорганические катализаторы отвечают за менее чувствительное поведение к температуре. |
| pH | |
| Ферменты проявляют более чувствительное поведение к рН. | Неорганические катализаторы менее чувствительны к рН. |
| давление | |
| Ферменты осуществляют свою деятельность при нормальном давлении. | Считается, что неорганические катализаторы работают при высоком давлении. |
| КПД | |
| Ферменты очень эффективны. | Неорганические катализаторы менее эффективны. |
| Молекулярный вес | |
| Высокая молекулярная масса показана ферментами. | Неорганические катализаторы имеют низкую молекулярную массу. |
| Белковые Яды | |
| Многие химические вещества отравляют ферменты и называются белковыми ядами. | Неорганические катализаторы не подвергаются неблагоприятному воздействию белковых ядов. |
| Лучи с меньшей длиной волны | |
| Ферменты денатурируются лучами с меньшей длиной волны. | Коротковолновое излучение не оказывает большого влияния на неорганические катализаторы. |
| использование | |
| Они опосредуют биохимические реакции и происходят из биологического мира. | Неорганические катализаторы действуют в физическом или неживом мире. |
Сравнительная таблица
| катализатор | энзим | |
|---|---|---|
| функция | Катализаторы – это вещества, которые увеличивают или уменьшают скорость химической реакции, но остаются неизменными. | Ферменты – это белки, которые увеличивают скорость химических реакций, превращая субстрат в продукт. |
| Молекулярный вес | Низкомолекулярные соединения. | Высокомолекулярные глобулярные белки. |
| Типы | Есть два типа катализаторов – положительные и отрицательные катализаторы. | Есть два типа ферментов – ферменты активации и ингибирующие ферменты. |
| Природа | Катализаторы представляют собой простые неорганические молекулы. | Ферменты являются сложными белками. |
| Альтернативные условия | Неорганический катализатор. | Органический катализатор или биокатализатор. |
| Скорость реакции | Как правило, медленнее | В несколько раз быстрее |
| специфичность | Они не являются конкретными и, следовательно, в конечном итоге производят остатки с ошибками | Ферменты являются высокоспецифичными производящими большое количество хороших остатков |
| условия | Высокая температура, давление | Мягкие условия, физиологический рН и температура |
| Облигации CC и CH | нет на месте | настоящее время |
| пример | оксид ванадия | амилаза, липаза |
| Энергия активации | Опускает | Опускает |
Для чего используются ферменты?
Ферменты участвуют практически во всех биологических процессах, протекающих в живых организмах. Их основным назначением, является оказание каталитического эффекта, иными словами – ускорение химической реакции. Они играют важную роль позволяя проводить реакции на более низком энергетическом уровне. Схожего эффекта можно добиться путем повышения температуры среды, влияющей на тепловое движение молекул внутри нее.
При прохождении реакции катализатор взаимодействует с реагентом в результате чего образуется новое соединение. После распада соединения образуется новое вещество и свободный катализатор, способный к повторному воспроизведению процесса, образуя цикличную реакцию.
Их особенностью является то, что они способны воздействовать на реакции в двух направлениях, как значительно ускоряя их ход, так и существенно замедляя.
Кроме того, отличие ферментов от катализаторов неорганического типа сводится к большей эффективности при участии в биохимических процессах. Они способны производить до нескольких миллиардов реакций, в отличие от неорганических веществ, вступающих в реакции сотни тысяч раз при тех же равных условиях.
Ключевые отличия
- Глобулярные белки называются ферментами, тогда как малые молекулы или минеральные ионы называются неорганическими катализаторами.
- Ферменты называют сложными макромолекулами, которые содержат трехмерную структуру, в то время как считается, что неорганические катализаторы имеют молекулы небольшого размера.
- Размер фермента довольно велик по сравнению с размером молекул субстрата; с другой стороны, разница между размером молекул неорганического катализатора и субстрата очень мала.
- Ферменты могут ускорять определенную реакцию субстрата; с другой стороны, неорганические катализаторы могут ускорять разнообразную реакцию.
- Конкретный тип молекул отвечает за регуляцию ферментов. И наоборот, ни одна из регуляторных молекул не может регулировать неорганические катализаторы.
- Рибосомы, присутствующие в живых клетках, отвечают за синтез ферментов, с другой стороны, живые клетки не играют никакой роли в синтезе неорганических катализаторов.
- Ферменты более чувствительны к температуре; с другой стороны, неорганические катализаторы менее чувствительны к температуре.
- Ферменты более чувствительны к рН, в то время как неорганические катализаторы менее чувствительны к рН.
- Ферменты осуществляют свою деятельность при нормальном давлении; с другой стороны, неорганические катализаторы обычно работают при высоком давлении.
- Ферменты высокоэффективны, тогда как неорганические катализаторы менее эффективны.
- Ферменты имеют высокую молекулярную массу; с другой стороны, неорганические катализаторы показывают очень низкую молекулярную массу.
- Большое количество химических веществ отравляют ферменты, которые называются белковыми ядами; с другой стороны, неорганические катализаторы не подвергаются неблагоприятному воздействию белковых ядов.
- Ферменты денатурируются лучами с более короткой длиной волны, с другой стороны, неорганические катализаторы не сильно подвержены влиянию коротковолнового излучения.
- Они опосредуют биохимические реакции и происходят из биологического мира, в то время как неорганические катализаторы действуют в физическом или неживом мире.
TheDifference.ru определил, что отличие ферментов и неорганических катализаторов заключается в следующем:
Ферменты – высокомолекулярные белковые тела, они довольно специфичны. Ферменты способны катализировать всего лишь один-единственный тип реакции. Они являются катализаторами биохимических реакций. Неорганические катализаторы ускоряют разные реакции.
Ферменты могут действовать в конкретном узком температурном интервале, определенном давлении и кислотности среды.
Ферментативные реакции обладают высокой скоростью.
Дата создания: 2015/04/30
Материальную основу всех жизненных процессов организма составляют тысячи химических реакций, катализируемых ферментами. Значение ферментов очень правильно и образно определил И. П. Павлов, назвав их «возбудителями жизни». Нарушение синтеза какого-либо фермента в стройной системе обменных реакций в организме приводит к развитию заболеваний, которые часто оканчиваются смертью. Например, недостаток у детей фермента, который превращает галактозу в глюкозу, является причиной галактоземии. При этом заболевании дети отравляются избытком галактозы и погибают в первые месяцы жизни. Повышение активности ксантин-оксидазы является причиной подагры. Таких примеров можно привести очень много. Вот почему ферменты представляют собой движущую силу всего того бесконечного разнообразия химических превращений, которые в своей совокупности составляют лежащий в основе жизни обмен веществ. Поэтому изучению ферментов придается такое большое значение. Наука о ферментах составляет важный раздел биохимии, а в медицине отчетливо выявляется направление – медицинская ферментология.
Ферментология или, иначе, энзимология является учением о ферментах (энзимах) – биологических катализаторов белковой природы, образуемых любой живой клеткой и обладающих способностью активировать различные химические реакции, происходящие в организме.
Ферменты нашли широкое применение во многих областях науки и промышленности. За последние годы с помощью высокоочищенных препаратов ферментов удалось расшифровать структуру сложных соединений, входящих в состав организма, в том числе некоторых белков и нуклеиновых кислот.
Ферменты имеют большое практическое значение, так как многие области промышленности – виноделие, хлебопечение, производство спирта, чая, аминокислот, витаминов, антибиотиков – основаны на использовании различных ферментативных процессов. Поэтому изучение свойств и механизма действия ферментов позволяет химикам создать новые, более совершенные катализаторы для химической промышленности. Действие различных физиологически активных соединений, применяемых в медицине и сельском хозяйстве, – лекарственных веществ, стимуляторов роста растений и др., в конечном счете сводится к тому, что эти вещества активируют или подавляют в организме то или иное звено в обмене веществ, тот или иной ферментативный процесс. Несомненно, изучение закономерностей действия ферментов и влияния на них различных стимуляторов или парализаторов имеет первостепенное значение для медицины и сельского хозяйства.
Круг вопросов, изучаемых ферментологией, весьма широк. Разработка методов выделения и очистки ферментов с целью установления их структуры, исследование процессов образования ферментов в живой клетке, регулирование из действия, роль ферментов в осуществлении различных физиологических функций – вот далеко не полный перечень важнейших биологических проблем, интенсивно изучаемых в настоящее время.
Разница между катализатором и ферментом
Определение
Катализатор: Катализатор – это вещество, которое увеличивает скорость химической реакции без каких-либо постоянных химических изменений.
Фермент: Фермент – это биологическая молекула, вырабатываемая живыми организмами, которая катализирует специфическую биохимическую реакцию при температуре тела.
корреляция
Катализатор: Катализатором могут быть неорганические катализаторы или ферменты.
Фермент: Ферменты являются типом катализатора.
Тип
Катализатор: Неорганические катализаторы представляют собой минеральные ионы или небольшие молекулы.
Фермент: Ферменты – это глобулярные белки.
Разница в размерах
Катализатор:Неорганические катализаторы по размеру аналогичны молекулам субстрата.
Фермент: Ферменты значительно крупнее молекул субстрата.
Молекулярный вес
Катализатор: Неорганические катализаторы имеют низкую молекулярную массу.
Фермент: Ферменты имеют высокую молекулярную массу.
действие
Катализатор: Неорганические катализаторы действуют на физические реакции.
Фермент: Ферменты действуют на биохимические реакции.
Катализатор: Неорганические катализаторы менее эффективны.
Фермент: Ферменты очень эффективны.
специфичность
Катализатор: Неорганические катализаторы могут увеличить скорость разнообразных реакций.
Фермент: Ферменты могут только увеличить скорость конкретной реакции.
Регулятор Молекул
Катализатор: Функция неорганических катализаторов не контролируется молекулами регулятора.
Фермент: Функция ферментов может регулироваться связыванием молекул регулятора с ферментом.
температура
Катализатор: Неорганические катализаторы функционируют при высоких температурах. Они не чувствительны к небольшим изменениям температуры.
Фермент: Ферменты работают при определенной температуре. При низких температурах они неактивны, а при высоких – денатурируются.
pH
Катализатор: Неорганические катализаторы не чувствительны к небольшим изменениям рН.
Ферменты: Ферменты работают только в определенном диапазоне рН.
давление
Катализатор: Как правило, неорганические катализаторы работают при высоком давлении.
Фермент: Ферменты работают при нормальном давлении.
Белковые Яды
Катализатор: Белковые яды не влияют на неорганические катализаторы.
Ферменты: Ферменты могут быть отравлены белковыми ядами.
Коротковолновое излучение
Катализатор: Коротковолновое излучение не влияет на неорганические катализаторы.
Ферменты: Ферменты могут быть денатурированы коротковолновым излучением.
Примеры
Катализатор: Оксид ванадия (V), железо и платина являются примерами неорганических катализаторов.
Фермент: Амилаза, липаза, глюкозо-6-фосфатаза, алкогольдегидрогеназа и аминотрансфераза являются примерами ферментов.
Заключение
Катализатор и фермент – это вещества, которые увеличивают скорость химической реакции за счет снижения энергии активации. Тем не менее, они не влияют или не изменяются в результате реакции. Катализаторы могут быть неорганическими катализаторами или ферментами. Неорганические катализаторы представляют собой ионы металлов или небольшие молекулы, которые катализируют химические реакции живых организмов. Ферменты – это биологические макромолекулы, которые катализируют специфические биохимические реакции внутри живых организмов. Ферменты работают только в мягких условиях. Основное различие между катализатором и ферментом заключается в форме катализаторов, субстратов и способе их каталитических реакций.
Типы ферментативных реакций
1. Тип
“пинг-понг”
–
фермент сначала взаимодействует с
субстратом А, отбирая у него какие либо
химические группы и превращая в
соответствующий продукт. Затем к ферменту
присоединяется субстрат В, получающий
эти химические группы. Примером являются
реакции переноса аминогрупп от аминокислот
на кетокислоты – трансаминирование.
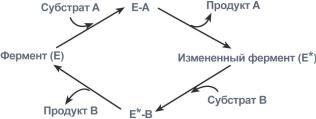
Ферментативная
реакция по типу “пинг-понг”
2. Тип
последовательных реакций
–
к ферменту последовательно присоединяются
субстраты А и В, образуя “тройной
комплекс”, после чего осуществляется
катализ. Продукты реакции также
последовательно отщепляются от фермента.
Ферментативная
реакция по типу “последовательных
реакций”
3. Тип
случайных взаимодействий
–
субстраты А и В присоединяются к ферменту
в любом порядке, неупорядоченно, и после
катализа так же отщепляются.
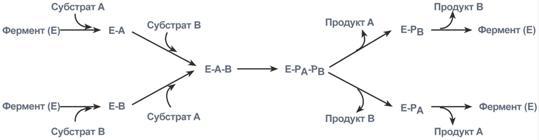
Ферментативная
реакция по типу “случайных взаимодействий”
Ферменты
имеют белковую природу
Давно
выяснено, что все ферменты являются
белками и обладают всеми свойствами
белков. Поэтому подобно белкам ферменты
делятся на простые и сложные.
Простые
ферменты
состоят
только из аминокислот –
например, пепсин
, трипсин
, лизоцим
.
Сложные
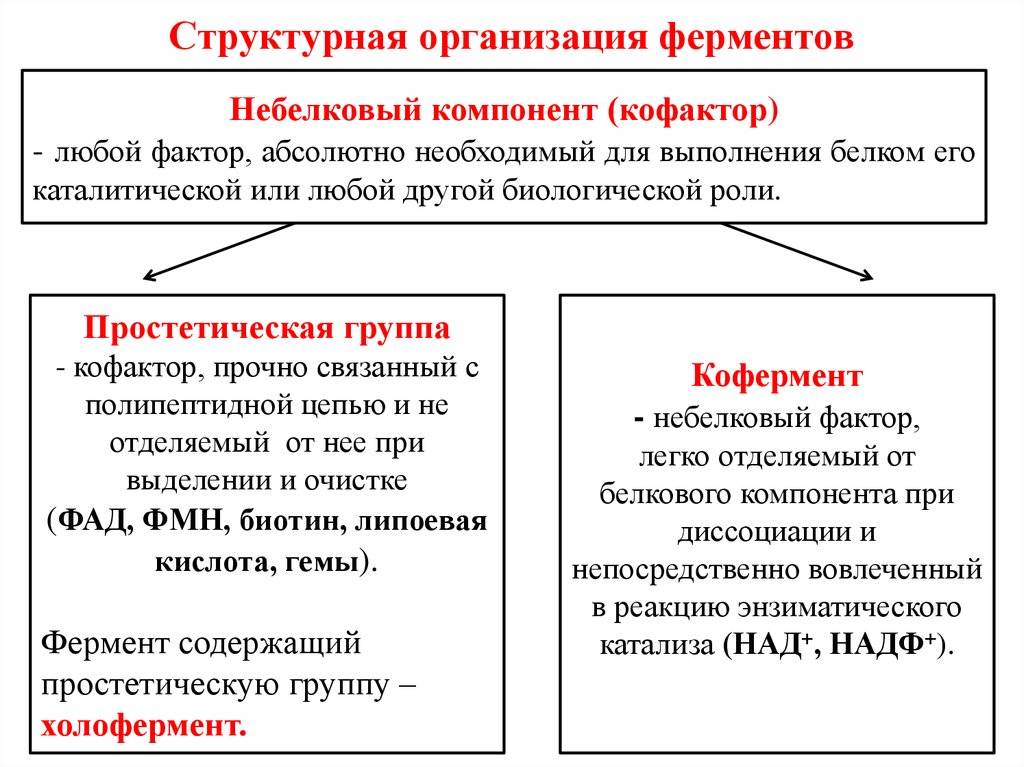
ферменты
(холоферменты)
имеют в своем составе белковую часть,
состоящую из аминокислот –апофермент
,
и небелковую часть – кофактор
.
Кофактор, в свою очередь, может
называться коферментом
или простетической
группой.
Примером могут быть сукцинатдегидрогеназа
(содержит
ФАД) (в цикле трикарбоновых
кислот), аминотрансферазы
(содержат
пиридоксальфосфат) (функция), пероксидаза
(содержит
гем). Для осуществления катализа необходим
полноценный комплекс апобелка и
кофактора, по отдельности катализ они
осуществить не могут.
Как
многие белки, ферменты могут быть мономерами
,
т.е. состоят из одной субъединицы,
и полимерами
,
состоящими из нескольких субъединиц.
Основу всех жизненных процессов составляют тысячи химических реакций, катализируемых ферментами. Значение ферментов точно и образно определил И.П.Павлов, назвав их “возбудителями жизни”
. Нарушения в работе ферментов ведут к возникновению тяжелых заболеваний – фенилкетонурия , гликогенозы , галактоземия , тирозинемия или существенному снижению качества жизни – дислипопротеинемии , гемофилия.
Известно, что для осуществления химической реакции необходимо, чтобы реагирующие вещества имели суммарную энергию выше, чем величина, называемая энергетическим барьером
реакции. Для характеристики величины энергетического барьера Аррениус ввел понятие энергии активации
. Преодоление энергии активации в химической реакции достигается либо увеличением энергии взаимодействующих молекул, например нагреванием, облучением, повышением давления, либо снижением требуемых для реакции затрат энергии (т.е. энергии активации) при помощи катализаторов.
Величина энергии активации с ферментом и без него
По своей функции ферменты являются биологическими катализаторами. Сущность действия ферментов, так же как неорганических катализаторов, заключается:
- в активации молекул реагирующих веществ,
- в разбиении реакции на несколько стадий, энергетический барьер каждой из которых ниже такового общей реакции.
Однако энергетически невозможные реакции ферменты катализировать не будут, они ускоряют только те реакции, которые могут идти в данных условиях.
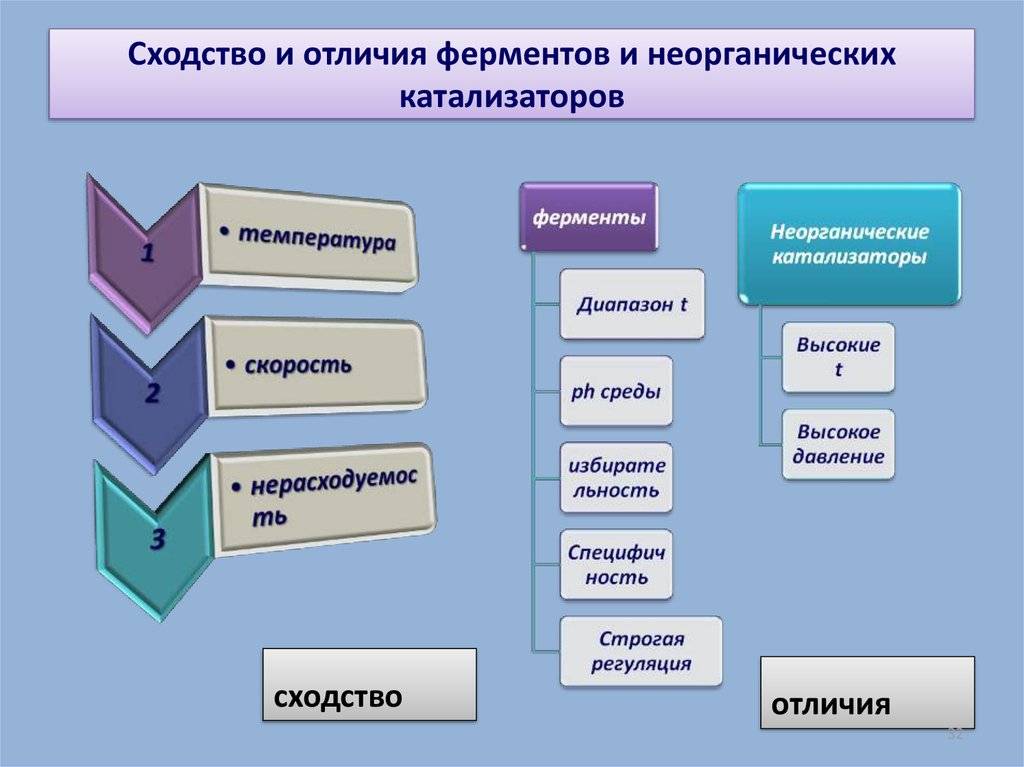
Сходство и отличия ферментов и неорганических катализаторов
Ускорение реакций при помощи ферментов весьма значительно, например:
А. Уреаза ускоряет реакцию разложения вполне устойчивой мочевины до аммиака и воды в 10 13 раз, поэтому при инфекции мочевых путей (появление бактериальной уреазы) моча приобретает аммиачный запах.
Б. Рассмотрим реакцию разложения пероксида водорода:
2Н 2 О 2 → О 2 + 2Н 2 О
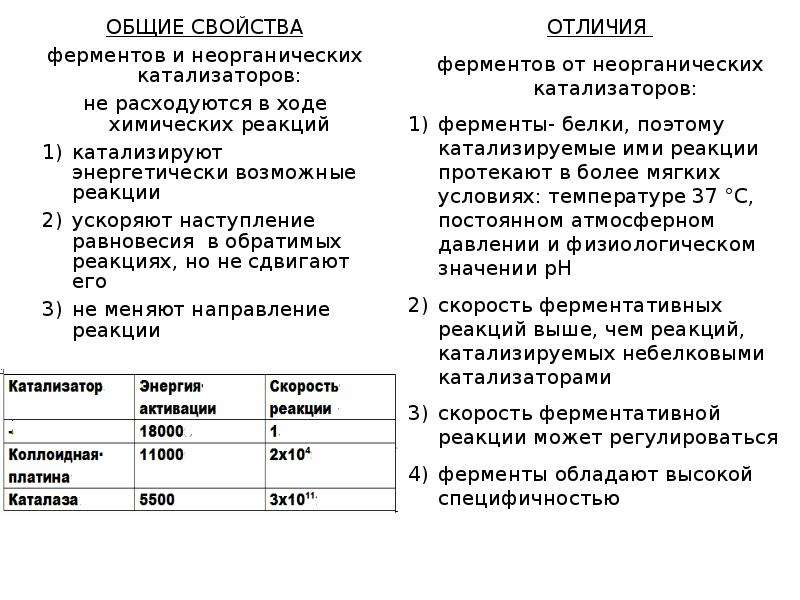
Если скорость реакции без катализатора принять за единицу, то в присутствии платиновой черни скорость реакции увеличивается в 2×10 4 раза и энергия активации снижается с 18 до 12 ккал/моль, в присутствии фермента каталазы скорость реакции возрастает в 2×10 11 раза с энергией активации 2 ккал/моль.
Неорганические катализаторы и ферменты (биокатализаторы), не расходуясь сами, ускоряют течение химических реакций и их энергетические возможности. В присутствии любых катализаторов энергия в химической системе сохраняет постоянство. В процессе катализа направление химической реакции остается неизменным.
Об истории изучения ферментов
История ферментов уходит в далекое прошлое. Еще на развитии человеческого общества люди сталкивались с различными ферментативными процессами и использовали их в жизни. Спиртовое и молочнокислое брожение, применение заквасок при приготовлении хлеба, использование сычуга для изготовления сыров и др. – все эти ферментативные процессы хорошо известны с незапамятных времен.
Одним из первых последователей, занимавшихся изучением ферментативных процессов, были Реомюр и Спалланцани. В своих опытах, по перевариванию мяса в желудке птиц они впервые поставили вопрос о необходимости изучения химического состава пищеварительного сока. Русский ученый К. С. Кирхгоф (1814)
Показал, что в вытяжке из проросшего ячменя содержится вещество, которое вызывает превращение крахмала в сахар. Таким образом, Кирхгофом впервые был получен ферментный препарат амилазы (фермент, расщепляющий крахмал) и эту дату мы с полным правом можем считать датой возникновения ферментологии. Изучая процессы брожения, голландский ученый Ван Гельмонт впервые ввел в науку термин « ферменты» (fermentum – закваска). Слово «энзим» происходит от древнегреческого слова « эн зюме», что означает в «дрожжах».
К середине 50-хгодов ХIХ века понятие о ферментах как о биологических катализаторах прочно утвердилось в науке. К этому времени и относится большой спор двух крупнейших ученых мира Луи Пастера и Либиха Ю о месте локализации ферментов в клетке – спор, который по своему существу явился борьбой двух мировоззрений в науке-идеализма и материализма и затормозил развитие учения о ферментах без малого на 50 лет. Луи Пастер, доказывая, что деятельность ферментов неотделима от структуры клетки и с ее разрушением прекращается, прочно стоял на позициях вирховианства- одной из разновидностей идеализма в биологии. Либих утверждал, что действие ферментов не связано со структурой клетки. Этот спор практически продолжался более 100 лет и снова, и который раз, утвердил необходимость материалистического подхода к изучению биологических закономерностей. Первой подтвердила правильность точки зрения Ю.Либиха русский исследователь М.М.Манассеина в 1871 г. Растирая дрожжевые клетки с кварцевым песком, т.е. полностью разрушая структуру клетки, она доказала, что клеточный сок обладает способностью сбраживать крахмал. Однако, как это очень часто бывало в царской России, исследования М.М.Манассеиной остались без внимания и пальма первенства, в этом вопросе была отдана немецким ученым братьям Бухнер, которые через 26 лет проделали аналогичный опыт (они разрушали клетки путем высокого давления) и получили такие же результаты. В последующем работами А.Н.Лебедева, И.П.Павлова, М.Дюкло, Э.Фишера, Л.Михаэлиса и многих других ученых окончательно была опровергнута точка зрения идеалистов. Именно материалистический подход в научных исследованиях дал возможность Дж. Самнеру в 1927г. впервые получить фермент уреазу, а Дж.Нортропу в 1931г.- кристаллические трипсин и пепсин.
В настоящее время работами большой армии ученых, как в нашей стране, так и за рубежом учение о ферментах успешно развивается. В настоящее время известно около 1000 ферментов. Работы академика А.Е.Браунштейна, В.А.Энгельгарда, А.И.Опарина, С.Е.Северина, В.Н.Ореховича, А.А.Покровского и многих других отечественных ученых в области изучения ферментов в человеческом организме имеют большое значение в медицине. Постановка диагноза, выбор правильного лечения и профилактики, разработка и применение различных лекарственных препаратов и т. д.основываются на изучении ферментов.
Общие черты свойств катализаторов и ферментов
Неорганические катализаторы и ферменты обладают рядом общих черт, которые позволяют им выполнять функцию катализа в химических реакциях.
1. Активность
Как катализаторы, так и ферменты способны ускорять химические реакции, не затрачивая себя. Они оперируют на атомарном или молекулярном уровне, вступая во взаимодействие с реагентами и образуя переходные состояния, которые снижают энергию активации реакции. Активность катализаторов и ферментов зависит от их структуры и конформации, а также от условий реакции, таких как температура и pH-среда.
2. Специфичность
Катализаторы и ферменты обладают способностью действовать только на определенные типы реакций и молекулярные соединения. Это свойство называется специфичностью. Катализаторы могут быть селективными и способными катализировать только одну конкретную реакцию, или они могут быть более общими и действовать на несколько реакций. Ферменты также обладают высокой степенью специфичности, так как они работают в биологических системах и должны точно распознавать свои субстраты.
3. Регенерация
Катализаторы и ферменты способны быть использованы неоднократно, поскольку они не расходуются в ходе реакции. Они могут быть восстановлены после реакции и использованы вновь. Регенерация катализаторов может требовать дополнительных химических реагентов или условий, в то время как ферменты могут регенерироваться в рамках биологических процессов, таких как синтез белков.
4. Концентрация
Катализаторы и ферменты включаются в реакцию в низких концентрациях. Они могут быть эффективными при очень низких концентрациях, что делает их обычно экономически выгодными и удобными для использования.
5. Отдельные функции
Помимо общих черт, катализаторы и ферменты также имеют отдельные функции, свойственные только им.
- Катализаторы широко используются в промышленных процессах, таких как производство удобрений или пластиков, для увеличения скорости химических реакций и повышения выхода продуктов.
- Ферменты являются ключевыми участниками биохимических реакций, происходящих в живых организмах. Они помогают разлагать пищу, регулировать обмен веществ, синтезировать биологически активные молекулы и выполнять другие жизненно важные функции.
В целом, катализаторы и ферменты имеют много общих черт, но в то же время они также различаются в своей природе и применении. Это позволяет им выполнять разные функции в химических и биологических реакциях.