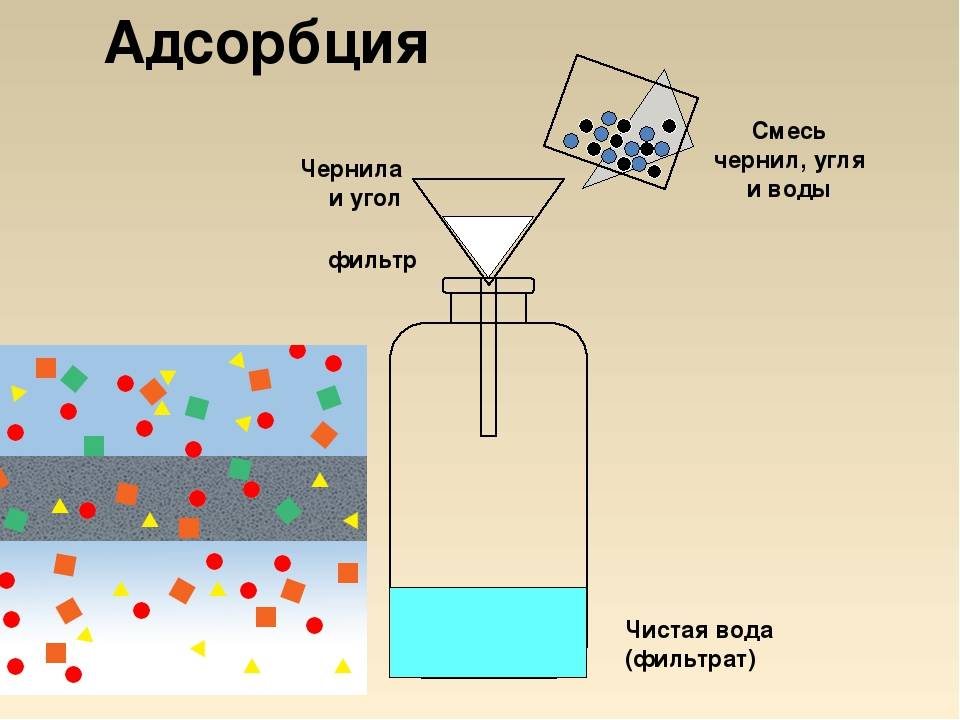
Введение
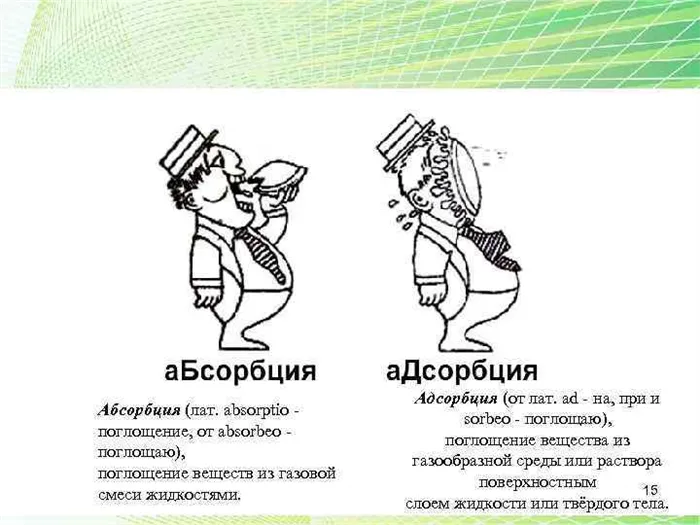
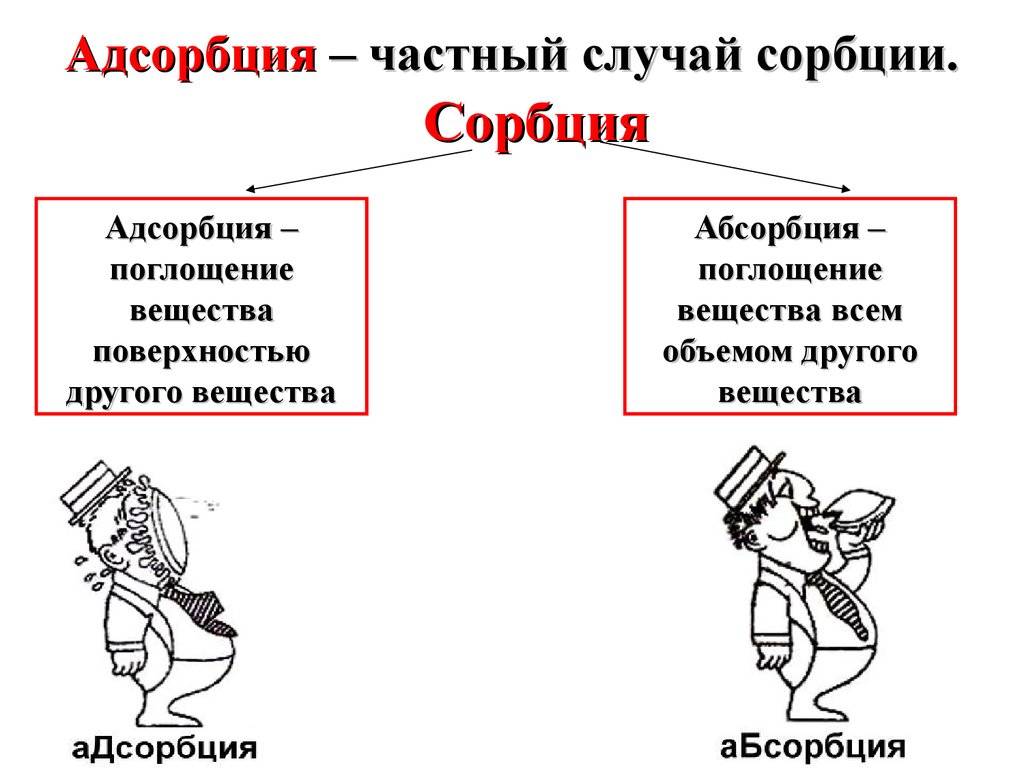
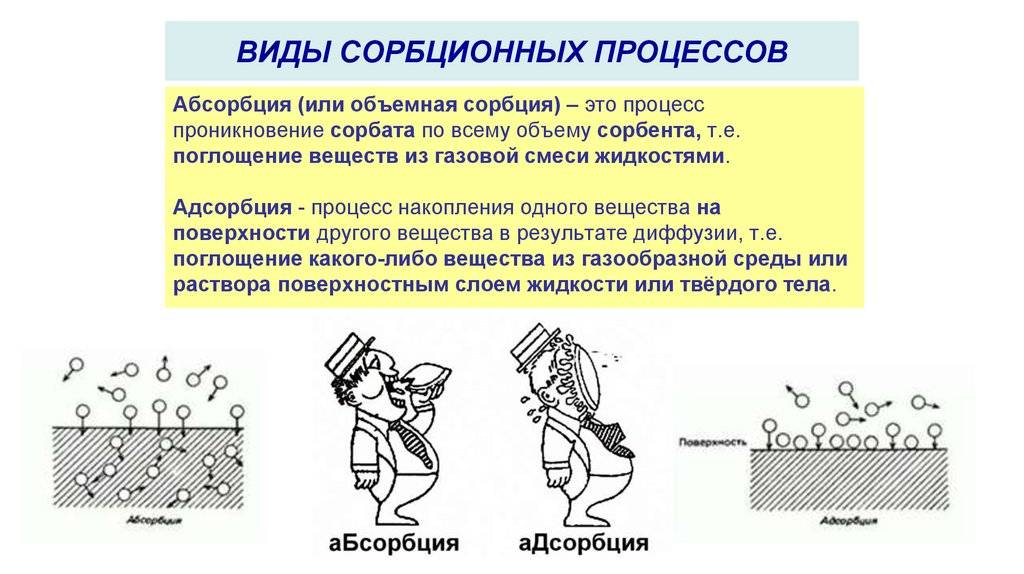
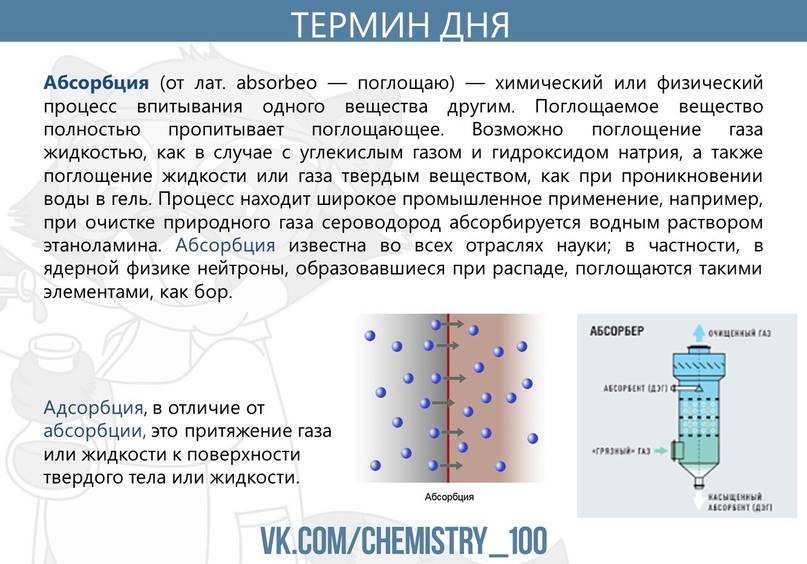
Адсорбцией называют процесс поглощения вещества из смеси газов, паров или растворов поверхностью или объемом пор твердого тела — адсорбента.
Явление адсорбции известно очень давно. Такие природные материалы, как песок и почва, использовали для очистки воды еще на заре человеческого общества. В конце XVIII века К. Шееле и одновременно Фонтана обнаружили способность свежепрокаленного древесного угля поглощать различные газы в объемах, в несколько раз превышающих его собственный объем. Вскоре выяснилось, что величина поглощенного объема зависит от типа угля и природы газа. Т.Е. Ловиц в 1785 году открыл явление адсорбции углем в жидкой среде, подробно исследовал его и предложил использовать уголь для очистки фармацевтических препаратов, спирта, вина, органических соединений. Ловиц показал, что древесный уголь способен быстро очищать испорченную воду и делать ее пригодной для питья. И сейчас основным действующим началом фильтров для воды служат углеродные материалы, конечно более современные, чем природные угли. Адсорбция отравляющих веществ из воздуха была использована Н.Д. Зелинским при создании противогаза во время первой мировой войны.
Адсорбция газов на твердых поверхностях используется в некоторых отраслях пищевой промышленности, а именно масложировой (например, в производстве маргарина) и в бродильной (например, в производстве дрожжей) для очистки технологических газовых потоков с целью предотвращения выбросов вредных веществ в атмосферу. Поглощение паров воды происходит на пористых веществах, которые выполняют роль твердого адсорбента. Подобные процессы наблюдаются в отношении сахара, соли и сухарей.
Main Differences Between Absorption and Adsorption
- An absorbent spreads the substance it catches throughout the structure, whereas an adsorbent distributes it on the surface.
- Absorbing materials may be split into distinct phases depending on the biochemical mechanisms of the phases; they can be divided into separate phases. On the other hand, adsorbed materials can be separated by passing a fresh substance through the adsorbent’s interface and substituting the formerly adsorbed substance.
- In absorption, materials are taken into an absorbent depending on the provided space and particle composition. Substances are absorbed onto an adsorbent’s surface because the adsorbent includes unoccupied areas that enhance particle attachment.
- Depending on the chemical interactions with the phases, absorbent substances can be sorted into various phases. On the other hand, adsorbed materials could be detached by moving a fresh substance across the adsorbent’s surface, replacing the previously adsorbed item.
- The temperature and pressure do not affect absorption. Adsorption, on the other hand, is a temperature-reliant process.
Что такое адсорбция
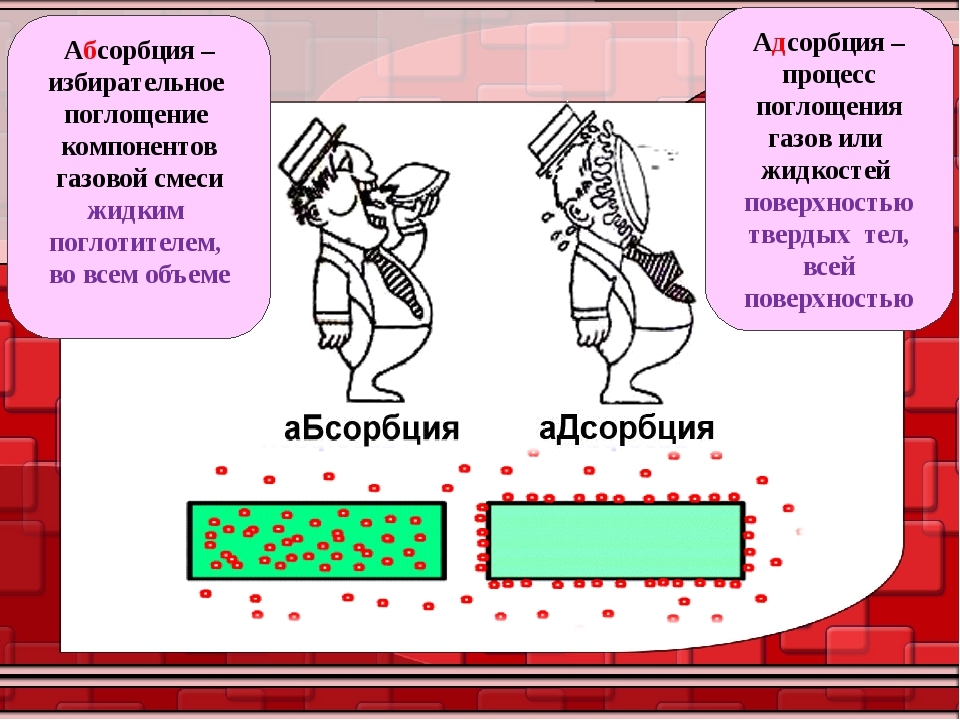
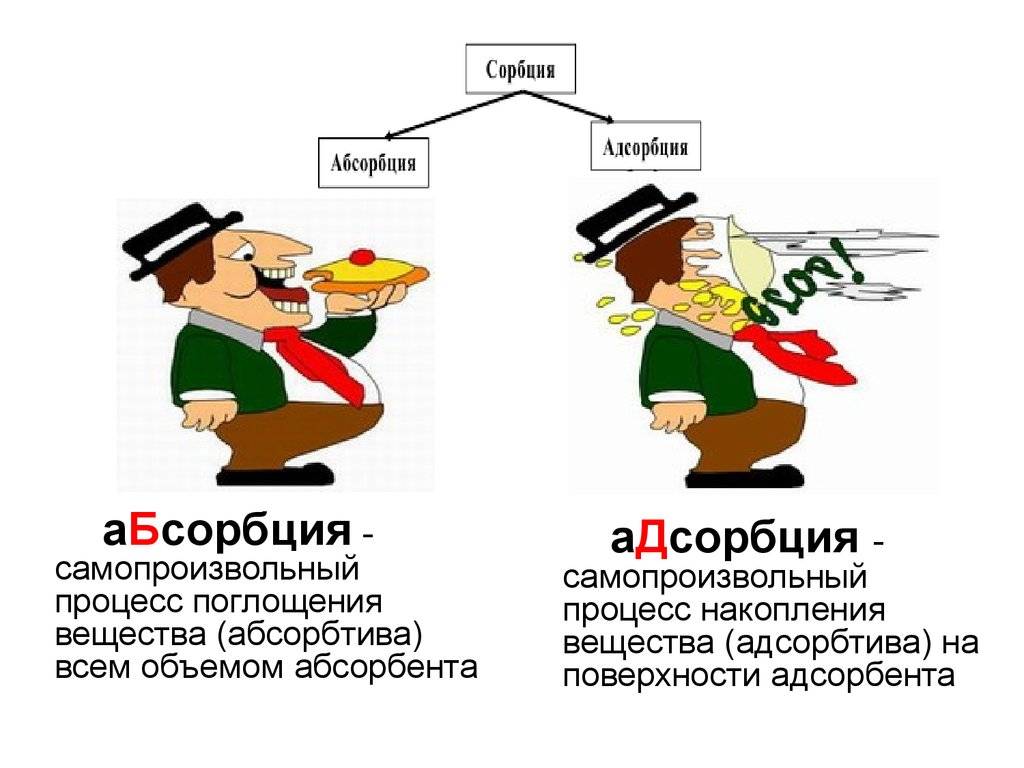
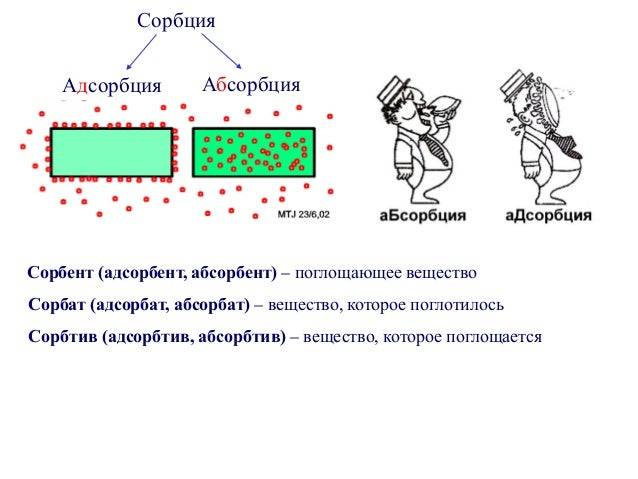
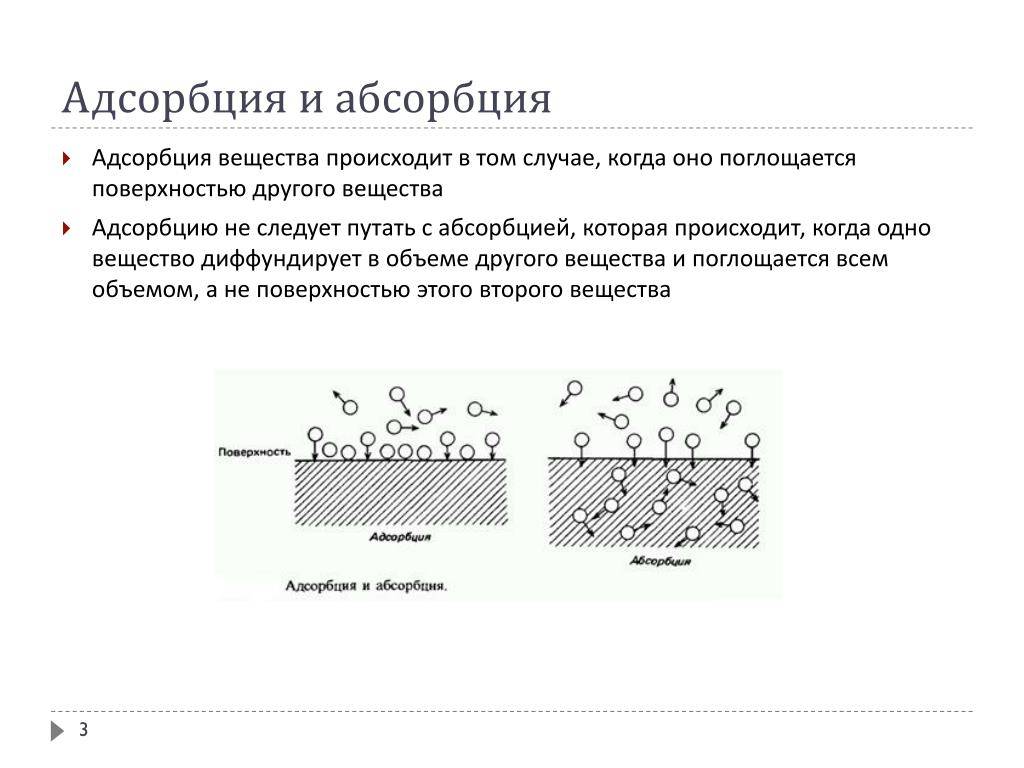
Главным отличием адсорбции от абсорбции является то, что при адсорбции адсорбат переходит в поверхностный слой адсорбента и остается на его поверхности, тогда как при абсорбции адсорбат проникает внутрь абсорбента.
Адсорбция имеет важное практическое значение в различных областях, включая химию, физику, биологию и промышленность. Она применяется, например, для очистки воды и воздуха от загрязнений, а также для разделения смесей веществ
Определение и понятие адсорбции
В процессе адсорбции молекулы вещества, называемого адсорбатом, перемещаются из объемной фазы в поверхностный слой адсорбента, где они прилипают к поверхности и образуют адсорбционный слой. Адсорбция может происходить на различных поверхностях, включая твердые материалы, пористые структуры и жидкости.
Адсорбция является важным процессом во многих областях науки и техники. Она широко применяется в различных технологических процессах, таких как очистка воды, фильтрация газов, каталитические реакции, сорбционные методы анализа и другие. Адсорбция также играет важную роль в биологии, фармакологии и медицине, где она используется для извлечения и концентрации различных веществ.
Основными характеристиками адсорбции являются адсорбционная емкость, которая определяет количество адсорбата, которое может быть поглощено адсорбентом, и адсорбционная способность, которая характеризует степень привлекательности адсорбента к адсорбату.
Механизм адсорбции
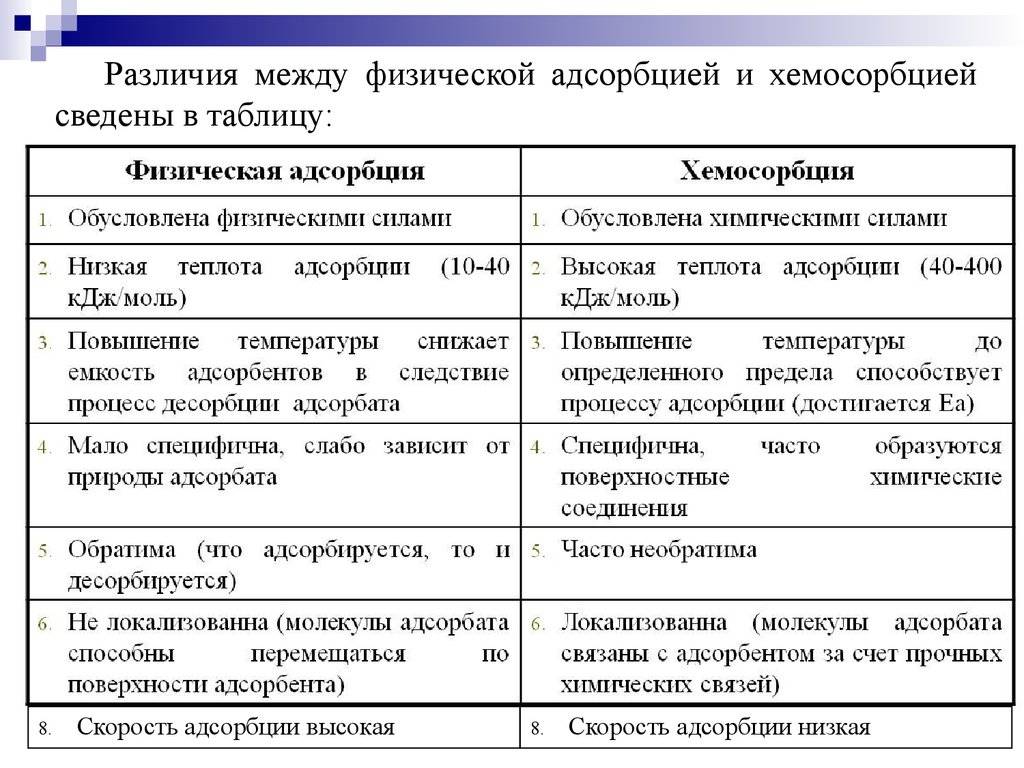
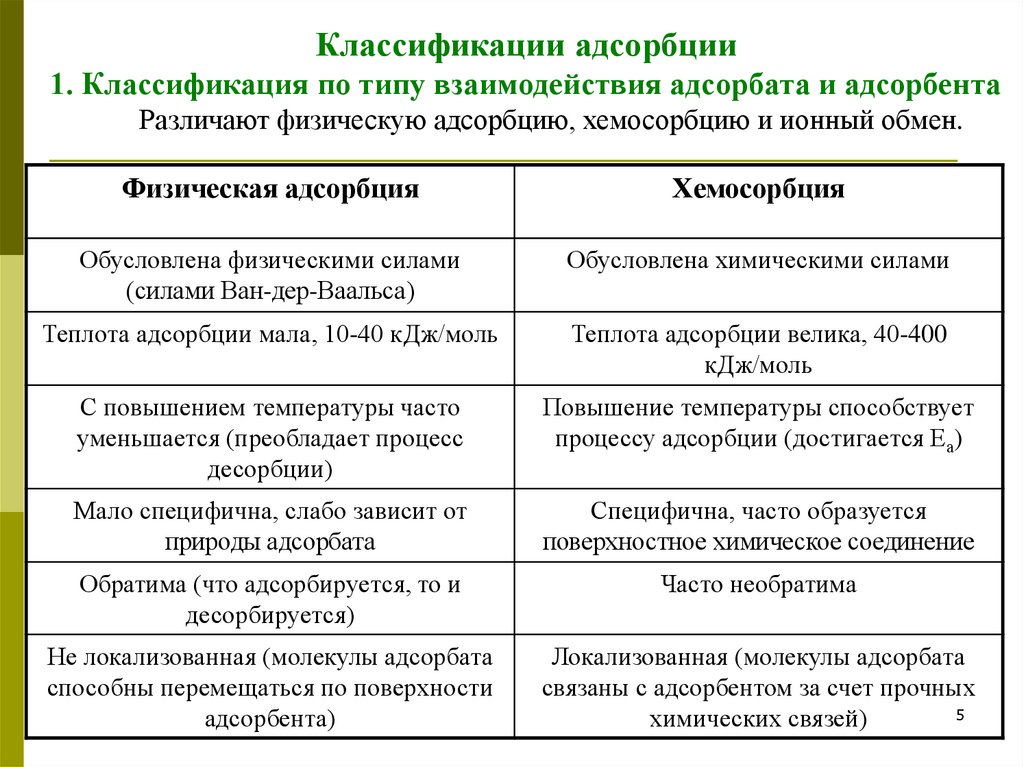
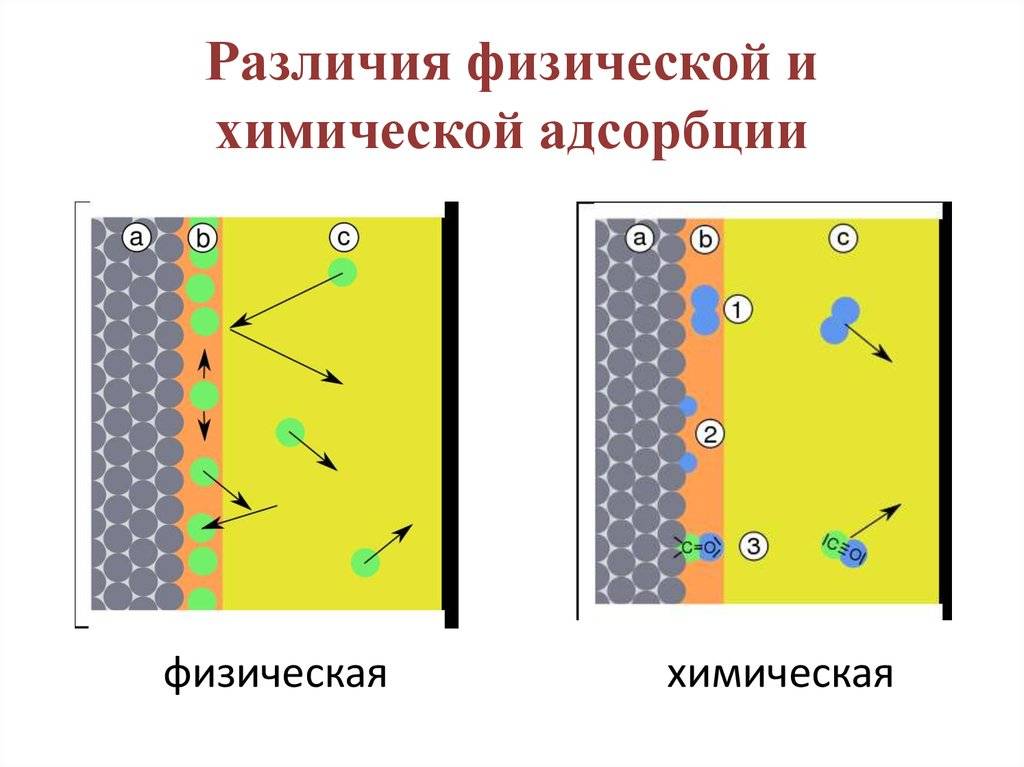
Вначале происходит физическое взаимодействие адсорбата и адсорбента. Поверхности адсорбента обладают различными силами притяжения, такими как ван-дер-ваальсова сила или ионо-дипольное взаимодействие. Эти силы притяжения привлекают адсорбат к поверхности адсорбента.
Затем происходит адгезия, или сцепление, между адсорбатом и адсорбентом. Это происходит на молекулярном уровне, когда атомы, молекулы или ионы адсорбата образуют химические связи с поверхностными атомами адсорбента. Адгезия может быть физической (слабой) или химической (сильной).
Конечным результатом механизма адсорбции является образование мономолекулярного слоя адсорбата на поверхности адсорбента. Этот слой может быть очень тонким и состоять из одного или нескольких слоев адсорбата.
Механизм адсорбции может быть различным в зависимости от типа адсорбата и адсорбента, а также условий окружающей среды. Он может быть поверхностным (адсорбат находится только на поверхности адсорбента) или объемным (адсорбат проникает внутрь адсорбента). Также механизм адсорбции может быть реверсивным (адсорбат может легко отсоединиться от адсорбента) или ирреверсивным (адсорбат прочно связан с адсорбентом).
Важно отметить, что адсорбция отличается от абсорбции тем, что в процессе абсорбции адсорбат проникает внутрь адсорбента и образует раствор, тогда как в процессе адсорбции адсорбат остается на поверхности адсорбента. Механизм адсорбции играет важную роль в многих процессах, таких как фильтрация, очистка воды, хроматография и каталитические реакции
Понимание механизма адсорбции позволяет оптимизировать эти процессы и создавать новые материалы и технологии
Механизм адсорбции играет важную роль в многих процессах, таких как фильтрация, очистка воды, хроматография и каталитические реакции. Понимание механизма адсорбции позволяет оптимизировать эти процессы и создавать новые материалы и технологии.
Что такое абсорбция
Основным механизмом абсорбции является образование взаимодействия между молекулами веществ, в результате которого происходит проникновение молекул одного вещества внутрь молекул другого вещества. Этот процесс может происходить как в газообразной фазе (например, при абсорбции газов), так и в жидкой или твердой фазе (например, при абсорбции жидкостей или растворов).
Абсорбция имеет ряд особенностей, которые отличают ее от других процессов взаимодействия веществ:
1. Выборочность: абсорбция может быть выборочной, то есть некоторые вещества легче и быстрее впитываются другими веществами, чем другие.
2. Обратимость: абсорбция может быть обратимой, то есть процесс может происходить в обоих направлениях — как восприятие и удержание вещества, так и его выделение из среды поглощения.
3. Изменение свойств: абсорбция может приводить к изменению характеристик вещества, в результате может происходить адсорбционное окрашивание или изменение физических и химических свойств вещества.
4. Зависимость от условий: абсорбция зависит от различных факторов, таких как температура, давление, концентрация вещества, химическая природа веществ, их физическое состояние.
Абсорбция широко используется в различных отраслях промышленности и научных исследований. Например, в медицине абсорбция используется для адсорбции лекарственных препаратов в организме, а также для очистки и фильтрации воды от вредных примесей. В пищевой промышленности абсорбция применяется для улучшения вкусовых свойств продуктов и сохранения пищевых добавок. В экологии абсорбция используется для очистки загрязненных водных и воздушных сред, а также для улавливания и утилизации вредных веществ.
Различия между адсорбцией и абсорбцией
1. При адсорбции вещество (адсорбат) притягивается и сосредотачивается на поверхности другого вещества (адсорбента). В то же время, при абсорбции одно вещество (абсорбат) полностью проникает внутрь другого вещества (абсорбента).
2. Адсорбция является поверхностным явлением, т.е. происходит только на поверхности адсорбента. В отличие от этого, абсорбция происходит как на поверхности, так и внутри абсорбента.
3. При адсорбции сила притяжения между адсорбатом и адсорбентом слабая взаимодействие Ван-дер-Ваальса, электростатические силы или химические связи. В случае абсорбции, силы взаимодействия между абсорбатом и абсорбентом значительно выше.
4. В адсорбции может участвовать множество адсорбатов, которые могут конкурировать за поверхность адсорбента. В случае с абсорбцией, обычно присутствует только один абсорбат, который полностью поглощается абсорбентом.
5. Адсорбция можно обратить путем изменения условий окружающей среды (температуры, давления). Абсорбцию нельзя обратить без воздействия внешней энергии.
Вот основные отличия между адсорбцией и абсорбцией. Оба процесса имеют свои уникальные характеристики и находят широкое применение в различных областях науки и техники.
Физический процесс
Адсорбция является процессом, при котором молекулы или ионы одного вещества (адсорбата) прилипают к поверхности другого вещества (адсорбента). Во время адсорбции, адсорбат остается на поверхности адсорбента, образуя адсорбционную оболочку или мономолекулярный слой. Этот процесс происходит преимущественно на поверхностях твердых тел или жидкостей.
Абсорбция, с другой стороны, представляет собой процесс поглощения одного вещества другим веществом. Для абсорбции свойственно проникновение абсорбата внутрь абсорбента. В отличие от адсорбции, абсорбция может происходить как в твердых телах, так и в жидкостях.
Одним из ключевых отличий между адсорбцией и абсорбцией является механизм взаимодействия. Во время адсорбции, происходит притяжение адсорбата к поверхности адсорбента на основе различных физических сил, таких как ван-дер-ваальсовы силы или химические связи. В случае абсорбции, абсорбат проникает внутрь абсорбента благодаря различным процессам диффузии.
Использование адсорбции и абсорбции имеет широкий спектр применения в различных областях. Например, процесс адсорбции используется в каталитических процессах, фильтрации и очистке воздуха и воды. Абсорбция, с другой стороны, находит применение в различных химических процессах, таких как абсорбция газов или абсорбция ионов.
Адсорбция
Процесс адсорбции происходит в результате взаимодействия между адсорбентом (поверхностью твердого или жидкого тела) и адсорбатом (атомами, ионами или молекулами, которые поглощаются). Адсорбат может быть поглощен внутри пор или на поверхности адсорбента.
Основное отличие адсорбции от абсорбции заключается в том, что адсорбция происходит на поверхности твердого или жидкого тела, а абсорбция — внутри материала. В процессе абсорбции адсорбат проникает внутрь материала, покидая поверхность и насыщая объем материала. В отличие от этого, в процессе адсорбции адсорбат существует только на поверхности адсорбента.
Процесс адсорбции может быть обратимым или необратимым. Обратимая адсорбция означает, что адсорбат может поглощаться и высвобождаться адсорбентом. В случае необратимой адсорбции адсорбат поглощается и остается навсегда на поверхности адсорбента.
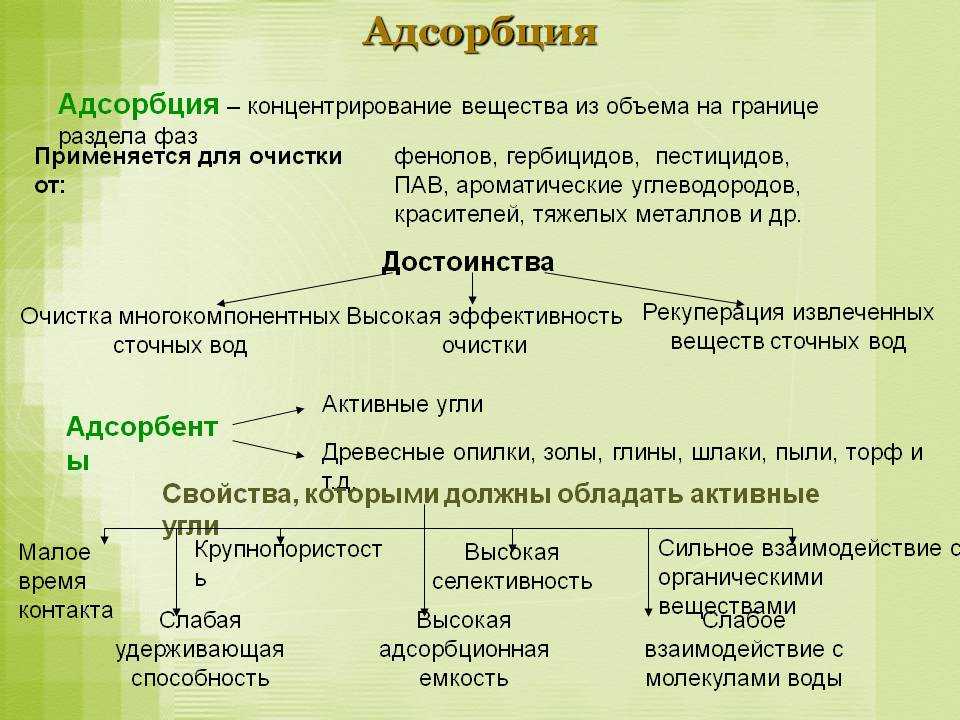
Понимание адсорбции играет важную роль в различных областях науки и технологии. Изучение кинетики и термодинамики адсорбции позволяет оптимизировать процессы, связанные с разработкой новых материалов, улучшением сорбентов и разработкой методов очистки воды и газов от загрязнителей. Улучшение и эффективное использование процессов адсорбции имеет широкие применения в промышленности, медицине и окружающей среде.
| Преимущества адсорбции | Недостатки адсорбции |
|---|---|
| Высокая специфичность адсорбции позволяет селективно удалять определенные загрязнители из растворов или газов | Необходимость регенерации адсорбента после насыщения |
| Возможность эффективной очистки воды и газов с высокой эффективностью | Необходимость использования значительных количеств адсорбента |
| Возможность использования адсорбционных процессов для разработки новых материалов | Возможность развития необратимой адсорбции |
Абсорбция
Абсорбция может происходить как в газообразной, так и в жидкой фазе. В газообразной фазе абсорбцию можно наблюдать, например, когда газ поглощается жидкостью. В жидкой фазе абсорбцию можно наблюдать, например, когда раствор поглощает вещество.
Основными факторами, влияющими на процесс абсорбции, являются температура, давление, концентрация абсорбата и абсорбента. Величина абсорбции может быть описана различными кинетическими и термодинамическими моделями, которые учитывают эти факторы.
Абсорбция широко используется в различных областях, включая химическую промышленность, фармацевтику, пищевую промышленность, окружающую среду и др. Процессы абсорбции используются для очистки газовых и жидких потоков от различных загрязнений, а также для разделения смесей веществ.
Абсорбционная очистка газов
Абсорбционный метод очистки газов чаще всего используется в тех сферах, на которых происходит большой выброс всевозможных вредных веществ и пыли в воздух.
Абсорбер для очистки газов — устройство, в котором происходит поглощение примесей газовых компонентов жидкой фазой.
Широкое применения абсорберы получили благодаря своей высокой эффективности.
Самым популярным абсорбером является скруббер. Выделяют несколько типов скрубберов:
Подбирать тип скруббера может только специалист. В противном случае вы можете получить абсолютно неработающую установку, просто потому что неправильно подобрали абсорбент, например.
Равновесная адсорбция
Если скорости А. и десорбции равны, то это свидетельствует об установлении адсорбц. равновесия. Кривые зависимости равновесной А. от концентрации или давления адсорбтива при постоянной темп-ре называются изотермами А. Наиболее простая изотерма А. представляет собой прямую, выходящую из начала координат, где на оси абсцисс отложено давление адсорбтива $p$ (или концентрация $c$), по оси ординат – величина адсорбции $a$. Эта область А. называется областью Генри: $a=Γp, Γ$ – коэф. Генри.
И. Ленгмюром была предложена (1914–1918) теория мономолекулярной локализов. А. (молекулы адсорбата не передвигаются по поверхности) при следующих допущениях: поверхность однородна, т. е. все адсорбц. центры имеют одинаковое сродство к молекулам адсорбтива; молекулы адсорбата не взаимодействуют друг с другом. Уравнение Ленгмюра имеет вид: $a=a_{макс}bp/(1+bp)$ или $p=a/b(a_{макс}-a)$, где $a$ – количество адсорбиров. вещества, $a_{макс}$ – предельная величина А. в плотном монослое, $p$ – давление адсорбтива, $b$ – адсорбц. коэф. Полимолекулярная, или многослойная, А., при которой молекулы пара, адсорбируясь, образуют плёнку толщиной в неск. монослоёв, описывается уравнением Брунауэра – Эммета – Теллера (уравнение БЭТ, 1938):$$a=\frac{a_{макс}Cp/p_0}{(1-p/p_0)[1+(C-1)p/p_0},$$где $p_0$ – давление насыщенного пара при темп-ре А., $C$ – константа. Уравнение БЭТ применяют для определения удельной поверхности адсорбентов.
В 1914 М. Полани предложена потенциальная теория А., согласно которой вблизи поверхности адсорбента существует потенциальное адсорбц. поле, убывающее с расстоянием от поверхности; давление адсорбтива, равное вдали от поверхности $p$, вблизи неё возрастает и на некотором расстоянии достигает значения $p_0$, при котором адсорбтив конденсируется.
Адсорбенты обычно разделяют на непористые (радиусы кривизны поверхностей которых весьма велики и стремятся к бесконечности) и пористые. Пористые адсорбенты содержат микро-, супермикро-, мезо- и макропоры (см. Пористость). В макропорах А. крайне мала, её обычно не учитывают при оценке адсорбц. свойств адсорбентов. Характерная особенность А. в микро- и супермикропорах – повышение энергии А. по сравнению с поглощением вещества на непористом адсорбенте той же химич. природы. Этот эффект является результатом наложения полей поверхностных сил противоположных стенок пор. В микро- и супермикропорах А. происходит объёмно, в мезопорах – по механизму послойного заполнения, завершаемого капиллярной конденсацией.
Для микропористых адсорбентов М. М. Дубинин разработал теорию объёмного заполнения микропор (ТОЗМ). Введя представление о функции распределения объёмов пор по значениям химич. потенциала адсорбата в них, Дубинин и Л. В. Радушкевич получили (1947) уравнение изотермы А., которое записывается в виде: $W/W_0=exp[–(A/βE_0)^2]$, где $W$ и $W_0$ – текущая и предельная величины А. пара в единице объёма, $A$ – дифференциальная мольная работа адсорбции, $A=RT\ln(p_0/p)$, $R$ – универсальная газовая постоянная, $T$ – абсолютная темп-ра, $E_0$ – характеристич. энергия адсорбции стандартного пара (обычно бензола или азота), $β$ – коэф. подобия, аппроксимируемый отношением парахоров адсорбируемого и стандартного веществ.
Уравнение Дубинина – Радушкевича применимо для описания изотерм А. в интервале относит. равновесных давлений от 5·10–4 до 0,4 на адсорбентах с однородной микропористой структурой, т. е. адсорбентах, в которых отсутствуют супермикропоры. Т. к. в адсорбц. технике микропористые адсорбенты получили наибольшее распространение, ТОЗМ применяется не только в физико-химич. исследованиях, но и в инженерных расчётах.
Сорбционная очистка
НЕОСМЕКТИН – АДСОРБЕНТ НОВОГО ПОКОЛЕНИЯ
Современный препарат Неосмектин способствует устранению диареи различного происхождения, метеоризма, изжоги, вздутия и тяжести в животе. Неосмектин действует в двух направлениях.
СПОСОБСТВУЕТ УСТРАНЕНИЮ ФАКТОРОВ, ПРОВОЦИРУЮЩИХ РАССТРОЙСТВА ПИЩЕВАРЕНИЯ
Патогенная микрофлора, кишечные газы, токсины иногда являются причиной расстройства пищеварения. Неосмектин адсорбирует их, способствуя их выведению из организма. Таким образом, препарат способствует устранению не симптомов, а самих факторов, которые могут провоцировать проблемы с пищеварением.
защищает слизистую желудочно-кишечного тракта
Неосмектин стабилизирует слизистый барьер желудочно-кишечного тракта, создавая на его поверхности защитную пленку, которая предохраняет слизистую от повреждения болезнетворными микроорганизмами и дает ей возможность быстрее восстановиться.

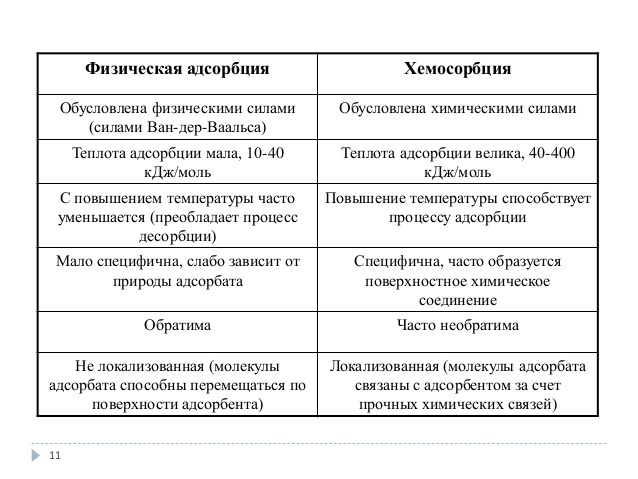
Механизмы и характеристики химической сорбции
Химическая сорбция представляет собой процесс адсорбции, при котором поглощаемые вещества взаимодействуют с поверхностью адсорбента, образуя химические связи. Этот механизм отличается от физической сорбции, при которой поглощаемые вещества просто адсорбируются на поверхности без образования химических связей.
При химической сорбции взаимодействие между поглощаемым веществом и поверхностью адсорбента осуществляется по принципу химической реакции, в результате которой образуются новые химические связи. Эти связи могут быть ковалентными или ионными, в зависимости от природы поглощаемых веществ и поверхности адсорбента.
Характеристики химической сорбции включают следующие элементы:
Селективность: некоторые адсорбенты могут предпочитать поглощать некоторые вещества из смеси, основываясь на их химической природе. Это позволяет использовать химическую сорбцию для селективной очистки или разделения смесей.
Емкость: характеризует способность адсорбента удерживать поглощаемое вещество на своей поверхности. Чем выше емкость, тем больше вещества может быть поглощено.
Кинетика: описывает скорость процесса химической сорбции. Изучение кинетики позволяет определить оптимальные условия для проведения процесса.
Равновесие: достигается, когда скорость адсорбции равна скорости десорбции, то есть поглощаемые и выделяемые вещества находятся в равновесии
Установление равновесия важно для определения емкости адсорбента и его эффективности.
Химическая сорбция является одним из важных процессов в различных областях, включая промышленность, экологию и медицину. На основе понимания механизмов и характеристик химической сорбции можно разрабатывать новые методы и технологии для улучшения процессов поглощения веществ и применения их в практике.
Absorption vs Adsorption
rong>The main difference between absorption and adsorption is that absorption occurs when a liquid or solid dissolves a fluid. Adsorption, conversely, is the adhesion of molecules, particles, or compounds from a material to the adsorbent’s surface.
Absorption can occur either with or without energy use (diffusion). Several factors influence absorption, including particle sizes, particle density, and the quantity of emitted photons.
Adsorption arises as a result of interfacial area, with attaching assisted by either Van der Wall’s force or chemical bonding, due to the nature of the substance being tested. Stress, heat, contact surfaces, and potential interactions between the adsorbate and adsorbent can all affect adsorption.
Разница между абсорбцией и адсорбцией
Главное отличие
На первом месте абсорбция и адсорбция, абсорбция — это стратегия, при которой жидкость растворяется каждым твердым веществом или жидкостью. В качестве альтернативы адсорбция — это стратегия, при которой ионы, молекулы или атомы такого вещества, как бензин, прочное или жидкое, прилипают к покрытию адсорбента.
Абсорбция
Поглощение — это процесс, при котором одно вещество полностью входит в совершенно другое вещество. Это процесс, при котором один атом или молекула всасывается в некоторое количество различных молекул. Он должен быть частью субстанции, полностью входя в нее. Это вполне могло быть химическое или телесное течение. Например, углекислый газ вполне может быть поглощен карбонатом калия. Это случай химического поглощения, поскольку имеет место реакция. Другой случай — растворение воздуха в воде. Это поглощение телом, поскольку воздух попадает внутрь воды под действием равновесного давления. Когда какое-либо вещество или запасы впитывают некоторое количество жидкости или бензина внутри, то предполагается, что эти запасы поглотили альтернативные запасы. Следовательно, при поглощении один фактор воздействует на материал.
Адсорбция
Адсорбция — это стратегия, при которой бензин или жидкость просто не абсорбируются, тем не менее, они просто образуются над землей. Для синтетических причин и очистки воды явление адсорбции также используется в промышленности. Это влечет за собой адгезию. Вещество просто цепляется за альтернативное вещество на этом пути, не проникая внутрь. Например, углекислый газ находится на основании адсорбента внутри блока адсорбента с переменным давлением, он находится на основании прочного адсорбента.