СОДЕРЖАНИЕ
- 1 Физические свойства
- 1.1 Марки серной кислоты
- 1.2 Полярность и проводимость
- 2 Химические свойства
- 2.1 Реакция с водой и обезвоживание
- 2.2 Кислотно-основные свойства
- 2.3 Реакции с металлами
- 2.4 Реакции с углеродом
- 2.5 Реакция с хлоридом натрия
- 2.6 Электрофильное ароматическое замещение
- 3 Возникновение
- 3.1 Стратосферный аэрозоль
- 3.2 Внеземная серная кислота
- 4 Производство
- 4.1 Контактный процесс
- 4.2 Обработка мокрой серной кислоты
- 4.3 Другие методы
- 5 применений
- 5.1 Промышленное производство химикатов
- 5.2 Серно-йодный цикл
- 5.3 Промышленное чистящее средство
- 5.4 Катализатор
- 5.5 Электролит
- 5.6 Бытовое использование
- 6 История
- 7 Безопасность
- 7.1 Лабораторные опасности
- 7.2 Опасность разбавления
- 7.3 Промышленные опасности
- 8 Правовые ограничения
- 9 См. Также
- 10 Ссылки
- 11 Внешние ссылки
Интересные опыты с серной кислотой
Мы предлагаем вам видеоподборку интересных опытов с серной кислотой.
Рассмотрим реакцию серной кислоты при ее заливании в сахар. На первых секундах попадания серной кислоты в колбу с сахаром происходит потемнение смеси. После нескольких секунд субстанция приобретает черный цвет. Далее происходит самое интересное. Масса начинает стремительно расти и вылазить за пределы колбы. На выходе получаем гордое вещество, похоже на пористый древесный уголь, превышающий первоначальный объем в 3-4 раза.
https://youtube.com/watch?v=Ymc-MdrrhXo
Автор видео предлагает сравнить реакцию кока-колы с соляной кислотой и серной кислотой. При смешивании Кока-колы с соляной кислотой никаких визуальных изменений не наблюдается, а вот при смешивании с серной кислотой Кока-кола начинает закипать.
Интересное взаимодействие можно наблюдать при попадании серной кислоты на туалетную бумагу. Туалетная бумага состоит из целлюлозы. При попадании кислоты молекулы целлюлозы мгновенно разрушайся с выделением свободного углерода. Подобное обугливание можно наблюдать при попадании кислоты на древесину.
В колбу с концентрированной кислотой добавляю маленький кусочек калия. На первой секунде происходит выделение дыма, после чего металл мгновенно вспыхивает, загорается и взрывается, разделаясь на кусочки.
В следующем опыте при попадании серной кислоты на спичку происходит ее вспыхивание. Во второй части опыта погружают алюминиевую фольгу с ацетоном и спичкой внутри. Происходит мгновенное нагревание фольги с выделением огромного количества дыма и полное ее растворение.
Интересный эффект наблюдается при добавлении пищевой соды в серную кислоту. Сода мгновенно окрашивается в желтый цвет. Реакция протекает с бурным кипением и увеличением объема.
Все вышеприведенные опыты мы категорически не советует проводить в домашних условиях. Серная кислота очень агрессивное и токсичное вещество. Подобные опыты необходимо проводить в специальных помещениях, которые оборудованы принудительной вентиляцией. Газы, выделяемые в реакциях с серной кислотой, очень токсичны и могут вызвать поражение дыхательных путей и отравление организма. Кроме того, подобные опыты проводятся в средствах индивидуальной защиты кожных покровов и органов дыхания. Берегите себя!
Опасные свойства серной кислоты для человека
Серная кислота представляет повышенную опасность для человеческого организма. Ее токсическое действие наступает не только при непосредственном контакте с кожей, но при вдыхании ее паров, когда происходит выделение сернистого газа. Опасное воздействие распространяется на:
- Дыхательную систему;
- Кожные покровы;
- Слизистые оболочки.
Интоксикацию организма может усилить мышьяк, который часто входит в состав серной кислоты.
Важно! Как вы знаете, при соприкосновении кислоты с кожей происходят сильнейшие ожоги. Не меньшую опасность представляет и отравление парами серной кислоты
Безопасная доза содержания серной кислоты в воздухе равняется всего 0,3 мг на 1 квадратный метр.
Если на слизистые покровы или на кожу попадает серная кислота, появляется сильный ожог, плохо заживающий. Если по масштабу ожог внушительный, у пострадавшего развивается ожоговая болезнь, которая может привести даже к смертельному исходу, если своевременно не будет оказана квалифицированная медицинская помощь.
Важно! Для взрослого человека смертельная доза серной кислоты равняется всего 0,18 см на 1 литр.
Безусловно, «испытать на себе» токсическое действие кислоты в обычной жизни проблематично. Чаще всего отравление кислотой происходит из-за пренебрежения техникой безопасности на производстве при работе с раствором.
Может случиться массовое отравление парами серной кислоты вследствие технических неполадок на производстве или неосторожности, и происходит массивный выброс в атмосферу. Для предотвращения таких ситуаций работают специальные службы, задача которых контролировать функционирование производства, где используется опасная кислота
Какие симптомы наблюдаются при интоксикации серной кислотой
Если кислота была принята внутрь:
- Боль в области пищеварительных органов.
- Тошнота и рвота.
- Нарушение стула, как итог сильных кишечных расстройств.
- Сильное выделение слюны.
- Из-за токсического воздействия на почки, моча становится красноватой.
- Отек гортани и горла. Возникают хрипы, осиплость. Это может привести к летальному исходу от удушья.
- На деснах появляются бурые пятна.
- Кожные покровы синеют.
При ожоге кожных покровов могут быть все осложнения, присущие для ожоговой болезни.
При отравлении парами наблюдается такая картина:
- Ожог слизистой оболочки глаз.
- Носовое кровотечение.
- Ожог слизистых оболочек дыхательных путей. При этом пострадавший испытывает сильный болевой симптом.
- Отек гортани с симптомами удушения (нехватка кислорода, кожа синеет).
- Если отравление сильное, то может быть тошнота и рвота.
Важно знать! Отравление кислотой после приема внутрь намного опасней, чем интоксикация от вдыхания паров
Первая помощь и терапевтические процедуры при поражении серной кислотой
Действуйте по следующей схеме при контакте с серной кислотой:
- Первым делом вызовите скорую помощь. Если жидкость попала внутрь, то сделайте промывание желудка теплой водой. После этого мелкими глотками понадобится выпить 100 граммов подсолнечного или оливкового масла. Вдобавок, следует проглотить кусочек льда, выпить молоко или жженую магнезию. Это нужно сделать для снижения концентрации серной кислоты и облегчения состояния человека.
- Если кислота попала в глаза, нужно промыть их проточной водой, а затем закапать раствором дикаина и новокаина.
- При попадании кислоты на кожу, обожженное место нужно хорошо промыть под проточной водой и наложить повязку с содой. Промывать нужно около 10-15 минут.
- При отравлении парами нужно выйти на свежий воздух, а также промыть по мере доступности пострадавшие слизистые водой.
В условиях стационара лечение будет зависеть от площади ожога и степени отравления. Обезболивание осуществляют только новокаином. Во избежание развития в области поражения инфекции, пациенту подбирают курс антибиотикотерапии.
При желудочном кровотечении вводится плазма или переливается кровь. Источник кровотечения могут устранять оперативным путем.
Серная кислота: общая информация
Серная кислота является сильным окислителем и реагентом. В обычных условиях она обладает высокой агрессивностью и коррозионными свойствами. Она способна растворять множество органических и неорганических веществ, в том числе металлы и многие сплавы.
Серная кислота может быть разбавленной или концентрированной. Разбавленная серная кислота обычно содержит около 10-15% H2SO4. Она менее агрессивна и более безопасна для использования, но все равно обладает значительной кислотностью.
| Тип кислоты | Содержание H2SO4 | Свойства |
|---|---|---|
| Разбавленная серная кислота | 10-15% | Меньшая агрессивность |
| Концентрированная серная кислота | Подавляющее большинство | Высокая кислотность, высокая коррозионная активность |
Концентрированная серная кислота, в отличие от разбавленной, обычно содержит подавляющее большинство H2SO4 и является намного более кислотной
Использование концентрированной серной кислоты требует особой осторожности и соблюдения мер безопасности
Серная кислота имеет широкое применение в промышленности, лабораторных и хозяйственных целях. Она используется в производстве удобрений, пластиков, красителей, взрывчатых веществ, а также в качестве реагента при проведении химических реакций и анализах.
Необходимо помнить, что использование серной кислоты требует осторожности и соблюдения мер безопасности. При работе с ней необходимо использовать защитные средства, такие как резиновые перчатки, защитные очки и хорошую вентиляцию помещения
Состав и свойства
Разбавленная серная кислота, также известная как слабая серная кислота, имеет низкую концентрацию активного вещества — H2SO4. Это делает ее менее опасной и коррозивной по сравнению с концентрированной серной кислотой.
Концентрированная серная кислота имеет высокую концентрацию H2SO4, что делает ее очень опасной и агрессивной веществом. Она обладает сильными коррозионными свойствами, способна вызывать ожоги при контакте с кожей и наносить серьезные повреждения материалам.
Оба типа серной кислоты обладают важными свойствами. Они являются сильными кислотами, способными действовать на многие виды веществ. Они также играют важную роль в промышленности, используясь в процессах химической синтеза и производства многих продуктов.
Свойства разбавленной и концентрированной серной кислоты различаются в зависимости от их концентрации
Разбавленная серная кислота слабее коррозивна и менее опасна для использования, в то время как концентрированная серная кислота обладает сильными коррозионными свойствами и требует особой осторожности при обращении
Использование должно быть согласовано с инструкциями и соответствовать безопасным стандартам и протоколам.
Применение и опасность
Разбавленная серная кислота широко используется в различных сферах промышленности и научных исследований. Она применяется как реагент в химическом синтезе, в процессах очистки воды и в производстве удобрений. Кроме того, разбавленную серную кислоту можно найти в домашнем использовании для очистки и дезинфекции различной посуды и поверхностей.
Однако, несмотря на широкое применение, разбавленная серная кислота является опасным веществом. Она может вызвать серьезные ожоги при контакте с кожей, глазами и дыхательными путями. При попадании в организм она может вызвать острой отравление и негативно повлиять на здоровье человека
Поэтому при работе с разбавленной серной кислотой необходимо соблюдать меры предосторожности, включая использование защитной одежды, очков и масок
Концентрированная серная кислота является еще более опасным веществом. Она может вызвать глубокие ожоги даже при кратковременном контакте с кожей и глазами. Кроме того, при нагревании она образует ядовитые пары, которые могут привести к серьезным проблемам с дыхательной системой
В связи с этим, работа с концентрированной серной кислотой требует особой осторожности и проведения в специально оборудованных помещениях
Важно помнить, что работа с серной кислотой требует профессиональной подготовки и соблюдения всех необходимых мер безопасности. При возникновении любых неприятных симптомов, необходимо незамедлительно обратиться за медицинской помощью
Интересные факты о серной кислоте
- Серная кислота в чистом 100%-ом виде встречается в природе. К примеру, в Италии на Сицилии в Мертвом море можно увидеть уникальное явление – серная кислота просачивается прямо из дна! А происходит вот что: пирит из земной коры служит в этом случае сырьем для ее образования. Это место еще называют Озером смерти, и к нему боятся подлетать даже насекомые!
- После больших извержений вулканов в земной атмосфере часто можно обнаружить капли серной кислоты, и в таких случаях «виновница» может принести негативные последствия для окружающей среды и стать причиной серьезных изменений климата.
- Серная кислота является активным поглотителем воды, поэтому ее используют в качестве осушителя газов. В былые времена, чтобы в помещениях не запотевали окна, эту кислоту наливали в баночки и ставили между стеклами оконных проемов.
- Именно серная кислота – основная причина выпадения кислотных дождей. Главная причина образования кислотного дождя – загрязнение воздуха диоксидом серы, и он при растворении в воде образует серную кислоту. В свою очередь двуокись серы выделяется при сжигании ископаемого топлива. В кислотных дождях, исследуемых за последние годы, возросло содержание азотной кислоты. Причина такого явления – снижение выбросов двуокиси серы. Несмотря на этот факт, основной причиной появления кислотных дождей так и остается серная кислота.
§ 35. Серная кислота
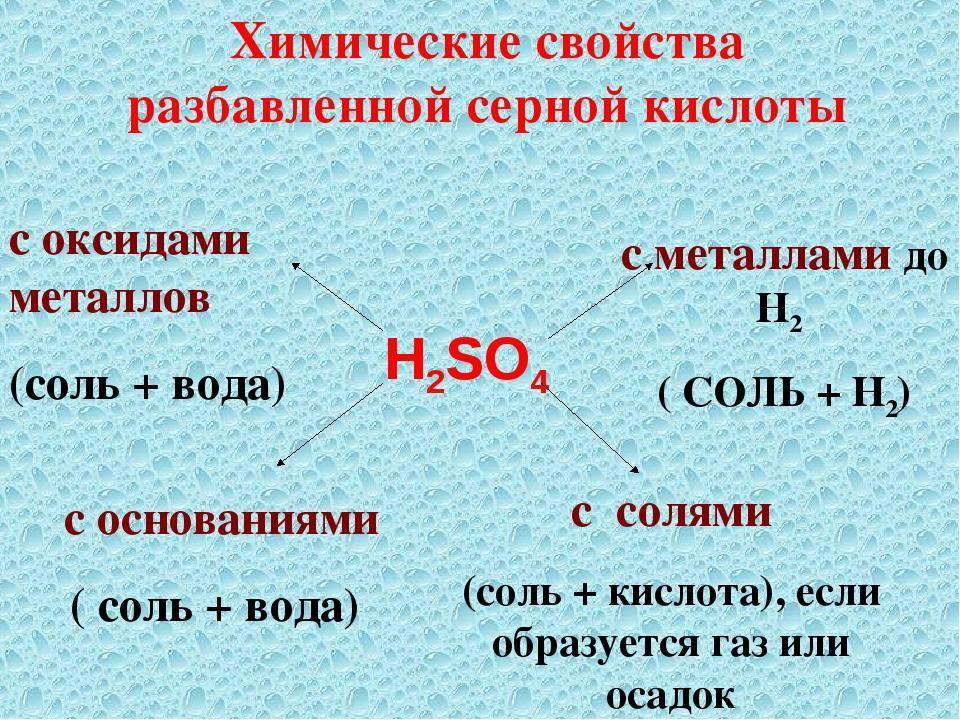
Химические свойства
Свойства разбавленной и концентрированной серной кислот существенно различаются.
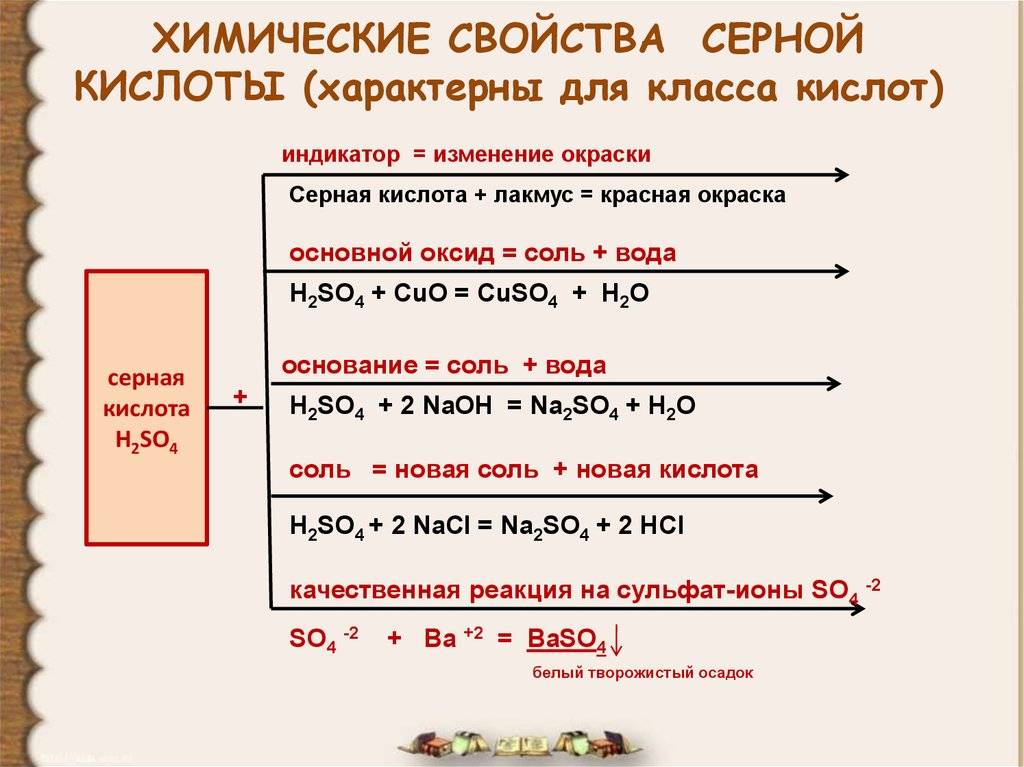
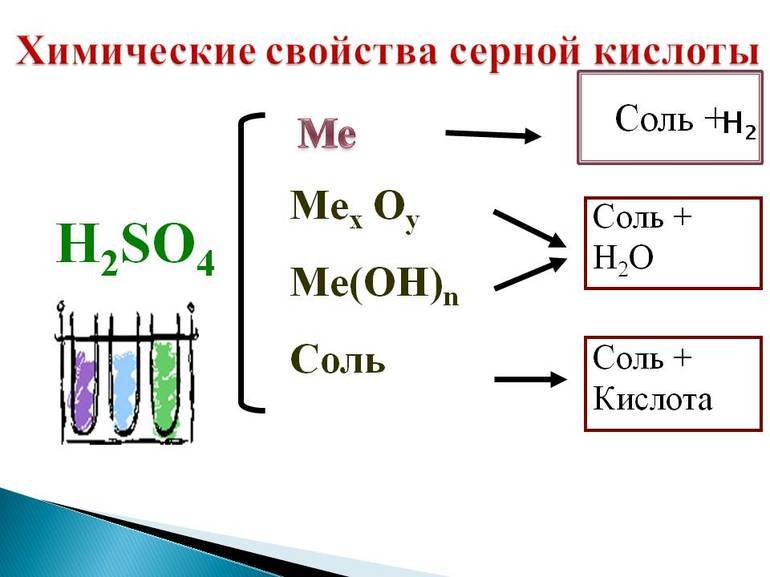
Химические свойства разбавленной серной кислоты. Разбавленная серная кислота — сильный электролит, она проявляет общие свойства кислот: меняет цвет индикаторов и образует соли в реакциях с металлами, основными и амфотерными оксидами, гидроксидами металлов, другими солями. Рассмотрим конкретные примеры.
1. Индикаторы лакмус и метилоранж окрашивают раствор серной кислоты в красный цвет. В разбавленных растворах серная кислота диссоциирует согласно схеме:
2. Образование солей:
а) металлы, расположенные в ряду активности до водорода, вытесняют его из разбавленных растворов серной кислоты:
б) реакции серной кислоты с основными и амфотерными оксидами, как правило, требуют небольшого нагревания для увеличения скорости:
СuO + Н2SO4 = CuSO4 + H2O; Al2O3 + 3Н2SO4 = Al2(SO4)3 + 3H2O;
в) в реакциях со щелочами и нерастворимыми основаниями образуются соли и вода (нейтрализация):
2NaOH + Н2SO4 = Na2SO4 + 2H2O или NaOH + Н2SO4 = NaНSO4 + H2O; Сa(OH)2 + Н2SO4 = СаSO4↓ + 2H2O.
Отметим, что при мольном соотношении щёлочи NaOH и кислоты Н2SO42 : 1 или избытке NaOH образуется средняя соль (сульфат), а при их соотношении 1 : 1 — кислая соль (гидросульфат). Следовательно, избыток многоосновной (двухосновной) кислоты Н2SO4 приводит к образованию кислых солей;
г) реакции растворов серной кислоты с солями протекают в полном соответствии с условиями реакций ионного обмена:
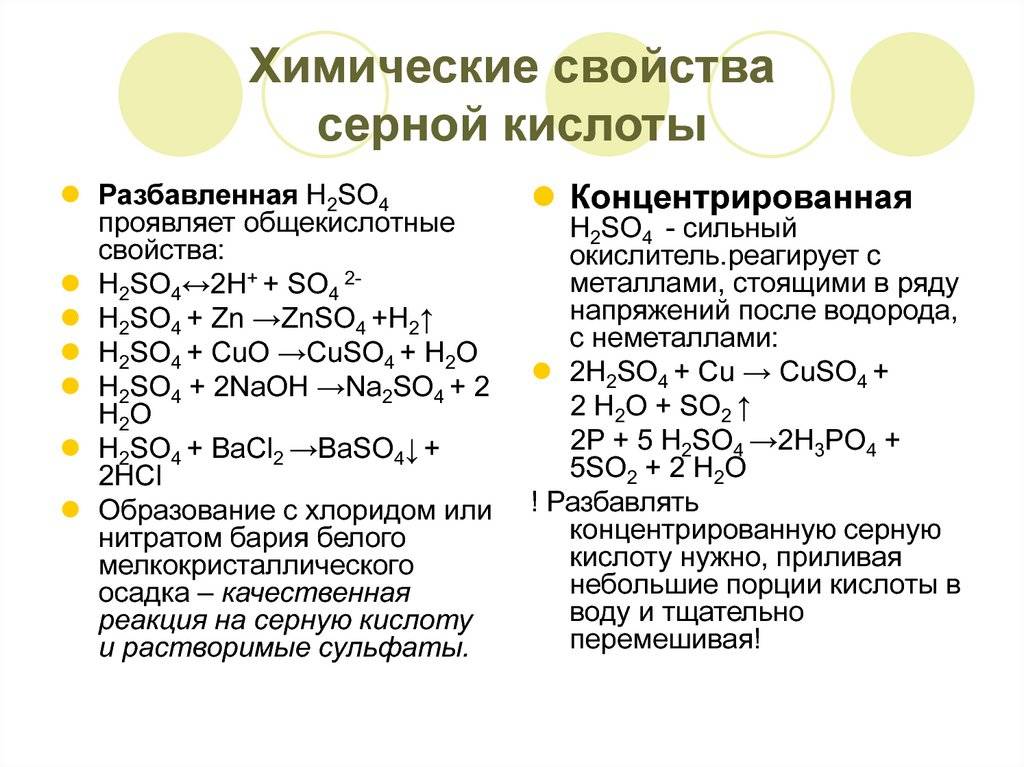
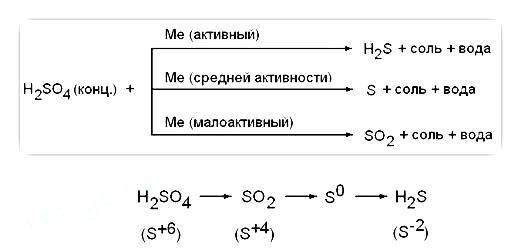
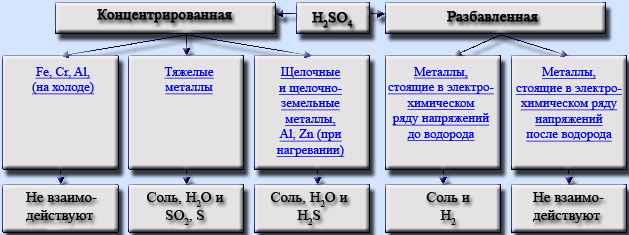
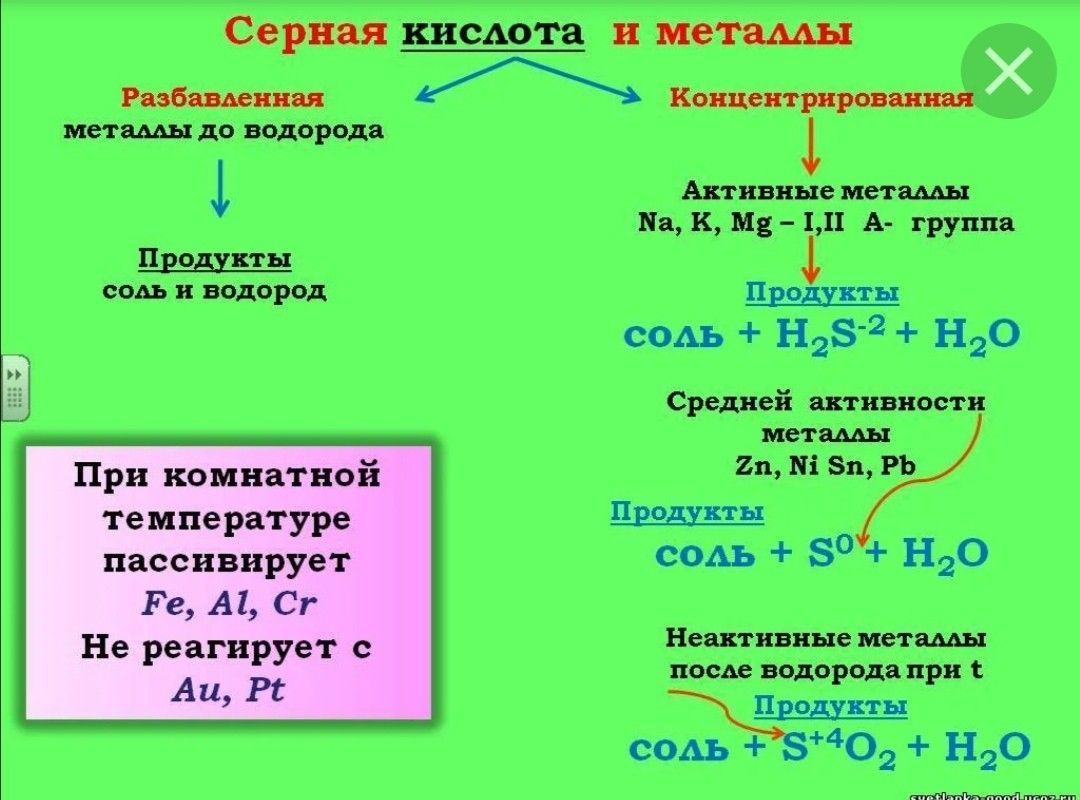
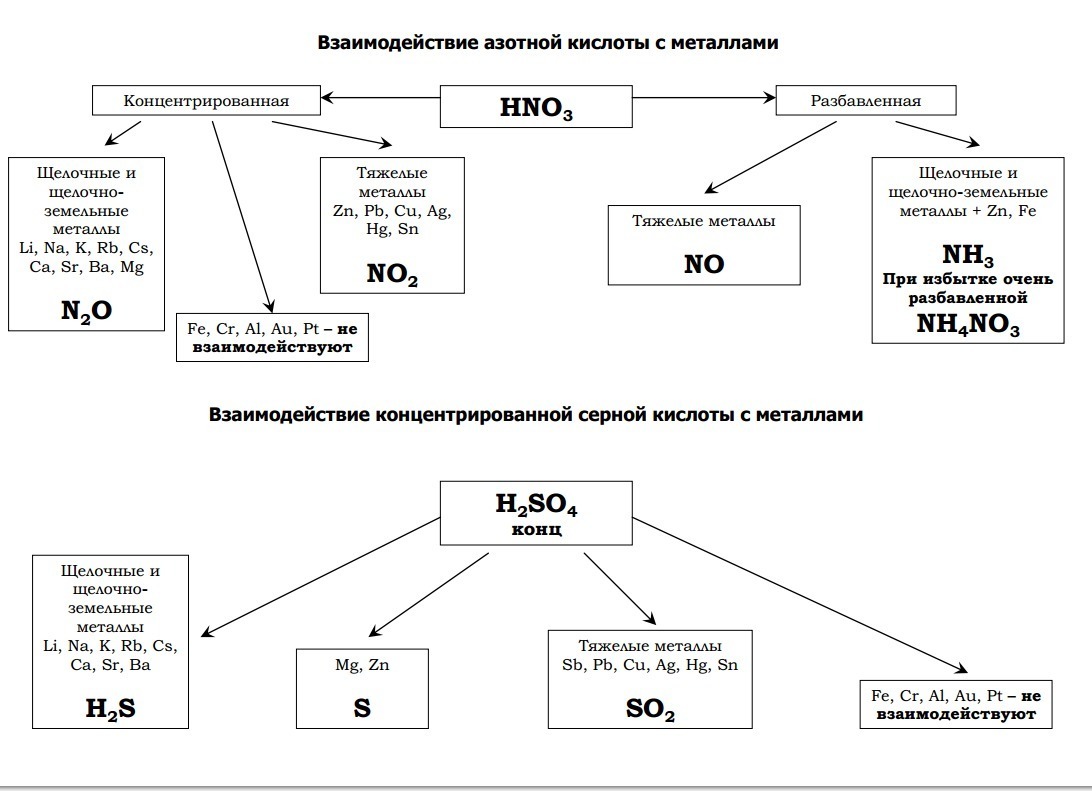
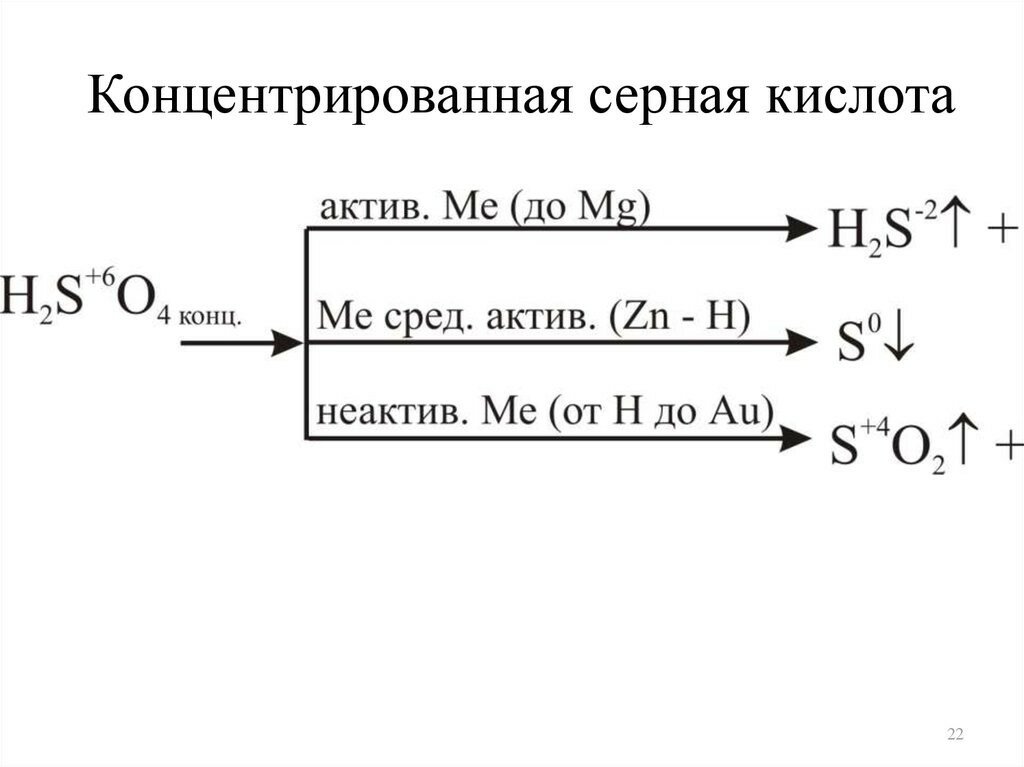
Химические свойства концентрированной серной кислоты. В сильно концентрированных растворах диссоциация серной кислоты протекает лишь по первой ступени: . Концентрированная серная кислота — более сильный окислитель, чем разбавленная. Её окислительные свойства проявляются прежде всего в реакциях с металлами. Отметим несколько важных моментов.
Во-первых, происходит восстановление не водорода, а атомов серы. Продуктами восстановления являются SO2, S и Н2S. Состав преимущественно образующихся продуктов зависит как от концентрации кислоты, так и от активности металла как восстановителя. Чем меньше концентрация кислоты и выше активность металла, тем сильнее восстанавливаются атомы серы. В общем виде взаимодействие концентрированной серной кислоты с металлами можно представить схемой:

Так, в реакции с металлами, находящимися в ряду активности после водорода (кроме золота и платины), образуется оксид серы(IV) SO2, например:
В реакциях с металлами, расположенными в ряду активности до водорода, могут образовываться и SO2, и S, и Н2S. Например, cхемы реакций, протекающих при взаимодействии цинка с серной кислотой по мере увеличения её концентрации, выглядят так:
Во-вторых, некоторые сравнительно активные металлы (например, железо, алюминий, хром) концентрированной серной кислотой при комнатной температуре пассивируются: на поверхности металла образуется плотная оксидная плёнка. Благодаря пассивации железа возможна перевозка кислоты в стальных цистернах.
Среди других особенностей концентрированной серной кислоты можно отметить следующие. Она способна вытеснять менее сильные или более летучие кислоты (НСl, HNO3, H3PO4, CH3COOH) из их солей:
Концентрированная кислота окисляет сложные органические вещества: обугливает бумагу, древесину, кожу, поэтому необходимо крайне осторожное обращение. Из-за особенности концентрированной серной кислоты образовывать гидраты H2SO4 · nH2O её широко используют как сильное водоотнимающее средство, а также как катализатор в органическом синтезе
Из-за особенности концентрированной серной кислоты образовывать гидраты H2SO4 · nH2O её широко используют как сильное водоотнимающее средство, а также как катализатор в органическом синтезе.
Применение концентрированной серной кислоты как водоотнимающего средства и катализатора в органическом синтезе демонстрируют уравнения реакций:
Получение серной кислоты
Производство серной кислоты в промышленных масштабах было запущено в XV веке, но в то время ее называли “купоросное масло». Если раньше человечество потребляло всего лишь несколько десятков литров серной кислоты, то в современном мире исчисление идет на миллионы тонн в год.
https://youtube.com/watch?v=wvoX4R-kKxE
Производство серной кислоты осуществляется промышленным способом, и их существует три:
- Контактный способ.
- Нитрозный способ
- Другие методы
Поговорим подробно о каждом из них.
Контактный способ производства
Контактный способ производства – самый распространенный, и он выполняет следующие задачи:
- Получается продукт, удовлетворяющий потребности максимального количества потребителей.
- Во время производства сокращается вред для окружающей среды.
При контактном способе в качестве сырья используются такие вещества:
- пирит (серный колчедан);
- сера;
- оксид ванадия (это вещество вызывает роль катализатора);
- сероводород;
- сульфиды различных металлов.
Перед запуском процесса производства сырье предварительно подготавливают. Для начала в специальных дробильных установках колчедан подвергается измельчению, что позволяет, благодаря увеличению площади соприкосновения активных веществ, ускорить реакцию. Пирит подвергается очищению: его опускают в большие емкости с водой, в ходе чего пустая порода и всевозможные примеси всплывают на поверхность. В конце процесса их убирают.
Производственную часть разделяют на несколько стадий:
- После дробления колчедан очищают и отправляют в печь – там при температуре до 800 °C происходит его обжиг. По принципу противотока в камеру снизу идет подача воздуха, и это обеспечивает нахождение пирита в подвешенном состоянии. На сегодняшний день, на этот процесс тратится несколько секунд, а вот раньше на обжиг уходило несколько часов. В процессе обжига появляются отходы в виде оксида железа, которые удаляются, и в дальнейшем передаются на предприятия металлургической промышленности. При обжиге выделяются водные пары, газы O2 и SO2. Когда завершится очистка от паров воды и мельчайших примесей, получается чистый оксид серы и кислород.
- На второй стадии под давлением происходит экзотермическая реакция с использованием ванадиевого катализатора. Запуск реакции начинается при достижении температуры 420 °C, но ее могут повысить до 550 °C с целью увеличения эффективности. В процессе реакции идет каталитическое окисление и SO2 становится SO3.
- Суть третьей стадии производства такова: поглощение SO3 в поглотительной башне, в ходе чего образуется олеум H2SO4. В таком виде H2SO4 разливается в специальные емкости (она не вступает в реакция со сталью) и готова ко встрече с конечным потребителем.
В ходе производства, как мы уже говорили выше, образуется много тепловой энергии, которая используется в отопительных целях. Многие предприятия по производству серной кислоты устанавливают паровые турбины, которые использую выбрасываемый пар для вырабатывая дополнительной электроэнергии.
Нитрозный способ получения серной кислоты
Несмотря на преимущества контактного способа производства, при котором получается более концентрированная и чистая серная кислота и олеум, достаточно много H2SO4 получают нитрозным способом. В частности, на суперфосфатных заводах.
Для производства H2SO4 исходным веществом, как в контактном, так и в нитрозном способе выступает сернистый газ. Его получают специально для этих целей посредством сжигания серы или обжигом сернистых металлов.
Переработка сернистого газа в сернистую кислоту заключается в окислении двуокиси серы и присоединении воды. Формула выглядит так:
SO2 + 1|2 O2 + H2O = H2SO4
Но двуокись серы с кислородом не вступает в непосредственную реакцию, поэтому при нитрозном методе окисление сернистого газа осуществляют при помощи окислов азота. Высшие окислы азота (речь идет о двуокиси азота NO2, трехокиси азота NO3) при данном процессе восстанавливаются до окиси азота NO, которая впоследствии опять окисляется кислородом до высших окислов.
Получение серной кислоты нитрозным способом в техническом плане оформлено в виде двух способов:
- Камерного.
- Башенного.
Нитрозный способ имеет ряд достоинств и недостатков.
Недостатки нитрозного способа:
- Получается 75%-ная серная кислота.
- Качество продукции низкое.
- Неполный возврат оксидов азота (добавление HNO3). Их выбросы вредны.
- В кислоте присутствуют железо, оксиды азота и прочие примеси .
Достоинства нитрозного способа:
- Себестоимость процесса более низкая.
- Возможность переработки SO2 на все 100%.
- Простота аппаратурного оформления.
Основы химии: Разница между концентрированной и разбавленной кислотой
Концентрированная кислота содержит как можно больше активных молекул кислоты, что делает ее очень сильной. Она имеет высокую концентрацию кислотных ионов и может вызвать серьезные ожоги или коррозию веществ, с которыми она взаимодействует
Это означает, что необходимы специальные меры предосторожности при работе с концентрированными кислотами
Разбавленная кислота, как следует из ее названия, имеет более низкую концентрацию кислотных ионов. Она получается путем добавления воды к концентрированной кислоте. В результате, разбавленная кислота менее опасна для обращения и более безопасна при использовании. Она может использоваться в таких областях, как научные исследования или образование, где не требуется очень сильная кислота.
Разница между разбавленной и концентрированной кислотой заключается в их концентрации и силе. Концентрированная кислота имеет более высокую концентрацию кислотных ионов и может вызывать серьезные вредные последствия при неправильном обращении. Разбавленная кислота содержит меньшее количество кислотных ионов и используется в местах, где требуется менее сильная реакция
При работе с кислотами всегда следует соблюдать меры предосторожности и использовать соответствующие защитные средства
Разбавленная и концентрированная серная кислота: сравнение
Концентрированная серная кислота имеет высокую концентрацию вещества, обычно около 98%. Это делает ее очень сильным и опасным окислителем, который может причинить серьезные ожоги при контакте с кожей или слизистыми оболочками. Кроме того, она является крайне реакционной и может вызвать взрывоопасные реакции при смешивании с некоторыми другими веществами.
Разбавленная серная кислота, в отличие от концентрированной, имеет низкую концентрацию, обычно около 3-5%. Она менее опасна для человека и не вызывает такие сильные ожоги при контакте
Однако она все еще может быть опасной и требует соблюдения мер предосторожности при обращении с ней.
Концентрированная серная кислота чаще используется в промышленности для производства различных химических соединений, в том числе для производства удобрений, пластмасс, красителей и других продуктов. Разбавленная серная кислота, в свою очередь, широко применяется в лабораторных условиях и в медицине.
Концентрация и растворимость
Разбавленная серная кислота (H2SO4) обладает различными свойствами по сравнению с концентрированной серной кислотой. Эти различия обусловлены разными значениями их концентраций и растворимостей.
Концентрация кислоты характеризует количество ее растворенных молекул в единице объема раствора. Разбавленная серная кислота имеет низкую концентрацию, так как содержит малое количество кислотных молекул в большом объеме раствора. Это делает ее менее активной и менее опасной для использования в химических процессах.
С другой стороны, концентрированная серная кислота имеет высокую концентрацию, так как содержит большое количество кислотных молекул в малом объеме раствора. Из-за этого она обладает более сильной кислотностью и может проявлять агрессивные химические свойства, такие как высокая коррозионная активность и способность обжигать кожу и ткани.
Растворимость кислоты определяет ее способность распадаться на ионы в растворе. Разбавленная серная кислота имеет высокую растворимость, что позволяет ей легко диссоциировать на ионы в воде. Это обуславливает ее повышенную текучесть и хорошую растворимость в других растворителях.
В отличие от этого, концентрированная серная кислота имеет низкую растворимость, так как ее молекулы сильно притягиваются друг к другу и могут образовывать агрегаты. Это делает ее менее текучей и более сложной для диссоциации на ионы в растворе.
Таким образом, различия в концентрации и растворимости разбавленной и концентрированной серной кислоты определяют их разные свойства и применение в химических процессах и промышленности.
Опасность и хранение
Концентрированную серную кислоту следует хранить в специальных химических контейнерах, которые обладают высокой устойчивостью к её действию. Контейнеры должны быть хорошо закрытыми и помещеными в хорошо проветриваемое помещение, далеко от источников тепла или огня.
Разбавленную серную кислоту также следует хранить в хорошо закрытых контейнерах, но она менее опасна в обращении
Однако, даже разбавленная кислота может вызывать раздражение кожи и глаз, поэтому необходимо соблюдать все меры предосторожности при хранении и использовании