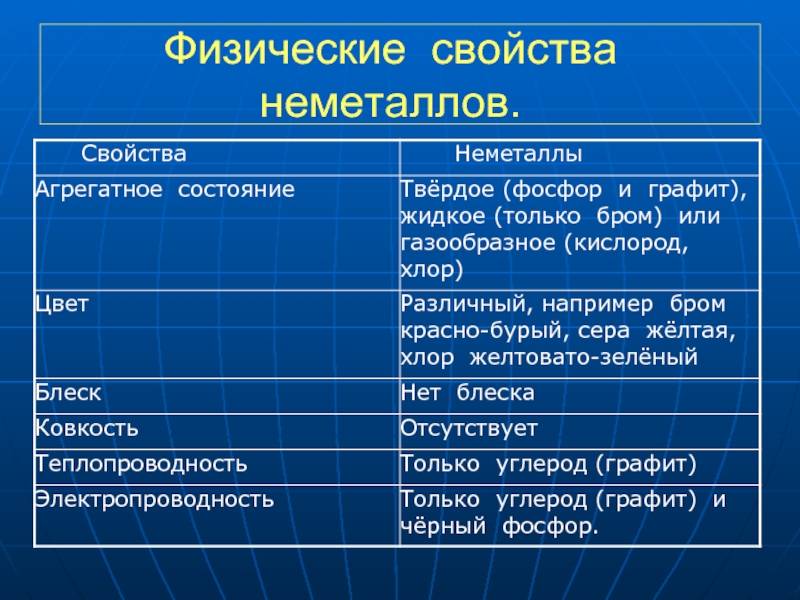
Физические свойства неметаллов
Неметаллы обладают рядом характеристик, которые отличают их от металлов:
- Отсутствие блеска: В отличие от металлов, неметаллы не обладают блестящей поверхностью.
- Тепло- и электропроводность: Неметаллы плохо проводят тепло и электричество. Это связано с их особенностями строения атомов и молекул.
- Избирательная прозрачность: Некоторые неметаллы, такие как сера или фосфор, могут быть прозрачными только в определенных формах, например, в виде аморфных или однородных кристаллов.
- Хрупкость: Неметаллы обычно являются хрупкими и легко разрушаются при повреждении. Зато металлы обычно обладают деформационной способностью.
- Низкая плотность: Неметаллы имеют меньшую плотность по сравнению с металлами. Это делает их легче и более подвижными.
- Низкая температура плавления: Большинство неметаллов обладает низкой температурой плавления по сравнению с металлами, что делает их менее жароустойчивыми.
Эти физические свойства неметаллов определяют многие их химические и технические характеристики, а также их применение в различных отраслях промышленности.
Проводимость электричества и тепла
Неметаллы, в отличие от металлов, имеют низкую проводимость электричества и тепла. Они являются плохими проводниками и сопротивляются протеканию электрического тока. Более того, некоторые неметаллы могут быть диэлектриками, то есть иметь очень низкую электрическую проводимость.
Это различие в проводимости электричества и тепла обусловлено особенностями строения молекул и атомов неметаллов. В металлах электроны свободно движутся по всей структуре, что обеспечивает их высокую проводимость. В неметаллах электроны сильно связаны с атомами и не могут свободно двигаться.
Проводимость тепла также связана с проводимостью электричества, поскольку тепло является формой энергии и может передаваться через движение электронов. Поэтому ненметаллы, не обладая высокой проводимостью электричества, также обладают низкой теплопроводностью.
Из-за низкой электрической и тепловой проводимости неметаллы широко применяются в изоляционных материалах и термических защитных покрытиях, таких как пенопласт, стекловолокно и керамические материалы.
Твердость и пластичность
Твердость — это способность материала сопротивляться деформации под действием внешних усилий. Металлы обычно обладают высокой твердостью, что позволяет им сохранять свою форму и структуру при механическом воздействии. Например, сталь имеет высокую твердость и может быть использована для создания прочных и прочностных конструкций.
В отличие от металлов, неметаллы обычно обладают низкой твердостью. Они могут быть хрупкими и легко разрушаться под воздействием механических сил. Например, стекло — это неметаллический материал с низкой твердостью, который может легко разбиться при ударе.
Пластичность — это способность материала изменять свою форму без разрушения под действием механических сил. Металлы характеризуются высокой пластичностью, что позволяет им быть формованными и обрабатываемыми. Например, алюминий — это металл с высокой пластичностью, который легко поддается прокатке и литью.
Неметаллы, напротив, обычно обладают низкой пластичностью. Они трудно поддаются формовке и обработке, так как могут быть хрупкими и легко разрушаться. Например, керамика — это неметаллический материал с низкой пластичностью, который сложно обрабатывать и формировать.
| Свойство | Металлы | Неметаллы |
|---|---|---|
| Твердость | Высокая | Низкая |
| Пластичность | Высокая | Низкая |
Плотность и легкость
Наиболее известные примеры таких легких неметаллов включают в себя карбон, кислород, азот и водород. Карбон представлен такими формами, как графит и алмаз, и используется в различных областях человеческой деятельности, от производства карандашей до изготовления алмазных украшений. Кислород и азот являются важными газами, составляющими атмосферу Земли, и необходимы для поддержания жизни. Водород, в свою очередь, является самым легким элементом в периодической таблице и часто используется в процессах химической синтеза.
Кроме того, неметаллы обычно обладают более низкой плотностью, что делает их легкими и удобными для использования в различных областях, например, в строительстве, электронике и авиационной промышленности. Некоторые классы неметаллов, такие как полимеры, обладают особенно низкой плотностью, что делает их идеальными для создания легких, но прочных материалов.
Таким образом, плотность и легкость являются важными физическими свойствами неметаллов, которые отличают их от металлов и обуславливают их широкое применение в различных отраслях промышленности и науки.
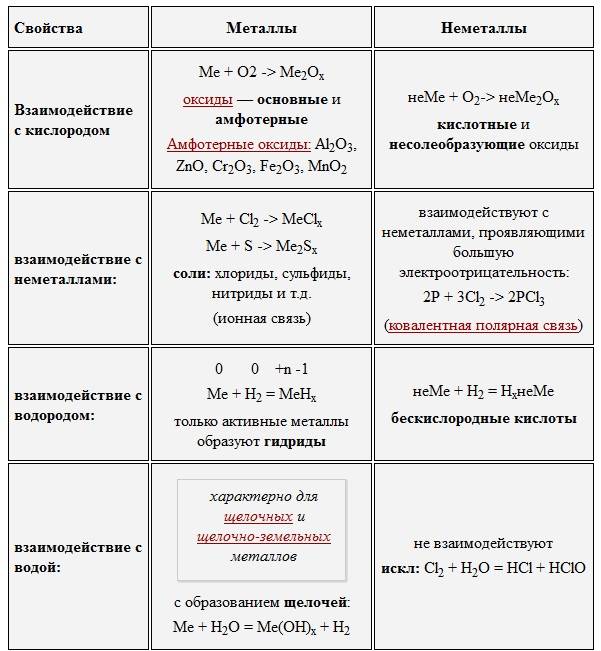
Чем металлы отличаются от неметаллов по химическим свойствам?
У элементов, представляющих разные группы, атомы вещества устроены по-разному. Металлы отличаются от неметаллов свойствами, основанными именно на этих различиях.
Внешняя орбита атома может нести до восемнадцати электронов. У металлов на ней обычно вращаются всего лишь от одной до трех (в редких случаях – четырех) частиц. Поэтому металлы легко окисляются и подвергаются коррозии.
Кроме того, их электроны могут легко оторваться от своего ядра и перейти в другие атомы. В химических реакциях металлы чаще всего проявляют восстановительные свойства, отдавая электроны соседним элементам.
У неметаллов внешние орбиты заполнены гораздо плотнее, поэтому они могут быть как восстановителями, так и окислителями. При вступлении в реакцию вещество, у которого электроны связаны сильнее (окислитель), забирает частицы у вещества с более слабой связью электронов (восстановитель).
Оксиды и гидроксиды типичных металлов представляют собой щелочи (основания). Исключение – амфотерные (переходные) металлы вроде алюминия, цинка, германия и др., соединения которых могут также обладать кислотными свойствами. Неметаллы же способны образовывать множество газообразных и жидких соединений (в основном, кислотных по свойствам).
Элементы таблицы Менделеева
Существует также класс «металлоподобных» полупроводников с неопределенным состоянием. Благородные газы, не вступающие в реакции, находятся отдельно.
Часть элементов с номерами больше 100 были обнаружены сравнительно недавно, их принадлежность к какой-либо группе является лишь предположением.
Щелочные и щелочноземельные элементы
Представители групп 1 (IA) и 2 (IIA) таблицы Менделеева — металлы с плохой стабильностью и высокой степенью растворимости.
Щелочные металлы имеют серебристый блеск и легко ломаются и режут. Из всех помещенных на столе металлов они активнее других реагируют с молекулами других веществ, отдавая единственный свободный электрон. При контакте с водой образуются гидроксиды – щелочи:
2Na + 2H2O = 2NaOH + H2
Щелочноземельные металлы более твердые и тугоплавкие, с бледно-серым оттенком.
Большинство из них способны создавать щелочь, но их не так легко отделить от двух незанятых электронов. Они заменяют другие металлы, но бессильны против щелочных металлов и вытесняются ими из молекул.
Галогены и благородные газы
Галогены и благородные газы сгруппированы в группы 17 и 18 периодической таблицы. Галогены — неметаллические элементы, все они имеют семь электронов на внешней оболочке. В благородных газах все электроны находятся на внешней оболочке, поэтому практически не участвуют в образовании соединений. Эти газы называются «благородными», потому что они редко реагируют с другими элементами; то есть относится к членам благородной касты, которые традиционно избегали других людей в обществе.
| Галогены | Благородные газы |
| Фтор F 9 | Гелий он 2 |
| Хлор Cl 17 | Неон Неон 10 |
| Бром Бр 35 | Аргон Ар 18 |
| Йод I 53 | Криптон Кр 36 |
| Астатин в 85 лет | Ксенон Хе 54 |
| — | Радоновый р-н 86 |
Лантаниды (редкоземельные элементы) и актиниды
Лантаниды представляют собой группу элементов, изначально обнаруженных в редких минералах; отсюда и название «редкоземельные элементы». Впоследствии оказалось, что эти элементы не так редки, как считалось сначала, и поэтому редкоземельным элементам было дано название лантаноиды. Лантаниды и актиноиды занимают два блока, которые расположены ниже основной таблицы элементов. Обе группы включают металлы; все лантаноиды (кроме прометия) не радиоактивны; актиниды, с другой стороны, радиоактивны.
| Лантаноиды | Актиниды |
| Лантан Ла 57 | Актиний Ac 89 |
| Церий Се 58 | Торий Th 90 |
| Празеодим Пр 59 | Протактиний Па 91 |
| Неодим Nd 60 | Уран U 92 |
| Прометий Pm 61 | Нептуний Np 93 |
| Самарий См 62 | Плутоний Pu 94 |
| Европий Eu 63 | Америций Ам 95 |
| Гадолиний Бог 64 | Кюриум см 96 |
| Тербий Тб 65 | Берклиум Бк 97 |
| Диспрозий Dy 66 | Калифорния cf 98 |
| Гольмий Хо 67 | Эйнштейний 99 |
| Эрбий Er 68 | Ферми FM 100 |
| Тулий Тм 69 | Менделевий Мд 101 |
| Иттербий Yb 70 | Нобелий № 102 |
Неметаллы
Из всех элементов, отнесенных к неметаллам, водород принадлежит к первой группе таблицы Менделеева, а остальные к группам 13-18. Неметаллы не являются хорошими проводниками тепла и электричества. Обычно они находятся в газообразном (водород или кислород) или твердом (углерод) состоянии при комнатной температуре).
| Нет металлов |
| Водород H1 |
| C6 углерод |
| Азот №7 |
| Кислород О8 |
| Фосфор Р 15 |
| Сера S16 |
| Селен Se 34 |
| Флеровиум Фл 114 |
| Унунсептиус Уус 117 |
Металлоиды
Металлоиды занимают 13-16 группы периодической таблицы. Металлоиды, такие как бор, германий и кремний, являются полупроводниками и используются для изготовления компьютерных микросхем и печатных плат.
| Металлоиды |
| Бор B5 |
| Кремний Да 14 |
| Германий Ge 32 |
| Мышьяк As 33 |
| Сурьма Sb 51 |
| Теллур Те 52 |
| Полоний Ро 84 |
Переходные металлы
Переходные металлы занимают группы 3-12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (через которые они соединяются с другими элементами) находятся в нескольких электронных оболочках.
| Переходные металлы |
| Скандий Sc 21 |
| Титан Ти 22 |
| Ванадий V 23 |
| Хром Cr 24 |
| Марганец марганец 25 |
| Железо Fe 26 |
| Кобальт Co27 |
| Никель Ni 28 |
| Медь Cu29 |
| Цинк Zn 30 |
| Иттрий Y 39 |
| Цирконий Zr40 |
| Ниобий Nb 41 |
| Молибден Мо 42 |
| Технеций Tc 43 |
| Рутений Ru 44 |
| Родий Rh45 |
| Палладий Pd 46 |
| Серебро Ag 47 |
| Кадмий Cd 48 |
| Лютеций Лу 71 |
| Гафний Hf 72 |
| Тантал Та 73 |
| Вольфрам W74 |
| Рений Ре 75 |
| Осмий Ос 76 |
| Иридий Ир 77 |
| Платина, часть 78 |
| Au 79 Золото |
| Меркурий ртутного столба 80 |
| Лоуренсио Lr 103 |
| Резерфордий Rf 104 |
| Дубний Дб 105 |
| Сиборгиум Sg 106 |
| Бори Бх 107 |
| Хассиум Hs 108 |
| Мейтнериум гора 109 |
| Дармштадт Дс 110 |
| Рентген Рг 111 |
| Коперник Cn 112 |
Постпереходные металлы
Они тоже «легкие». Отличаются от переходных аналогов меньшей твердостью и весом. У них разные температуры плавления и кипения. Для соединений электроны отдаются только с внешней оболочки. По степени восстановления они превосходят полуметаллы. Легкий металл выглядит как вещество с матовым покрытием, а не блестящим.
Определение металлов
Металлы – это вещества, которые в нормальных условиях обладают такими металлическими свойствами:
- находятся в твердом кристаллическом состоянии (за исключением ртути и иногда франция);
- выглядят блестящими (за редким исключением);
- хорошо проводят электрический ток;
- хорошо передают тепло;
- под воздействием ударов, сжатий, изгибов обычно не разрушаются, но изменяют форму, т.е. являются пластичными, особенно при повышенной температуре (это значит, что металлы можно ковать, раскатывать в листы, вытягивать в тонкие проволоки).
Легко увидеть разницу между металлами и неметаллами можно в периодической таблице. Граница между двумя этими группами проходит через водород, бор, кремний, мышьяк, теллур, астат, оганесон. Металлами являются элементы, расположенные ниже и левее линии (их большинство из ныне открытых наукой).
Кроме того, элементы на самой границе считаются металлоидами, или полуметаллами, потому что проявляют смешанные свойства обеих групп. А со следующего ряда (ячейки вправо и вверх от линии) начинаются неметаллы.
Большинство металлов в природе встречаются в виде руд и разнообразных химических соединений (оксидов, карбонатов, сульфидов и т.п.). Для удобства использования их нужно выделить из руды и очистить. Но и абсолютно чистые металлы практически не применяются – в таком виде они нестойки и часто теряют свои полезные качества.
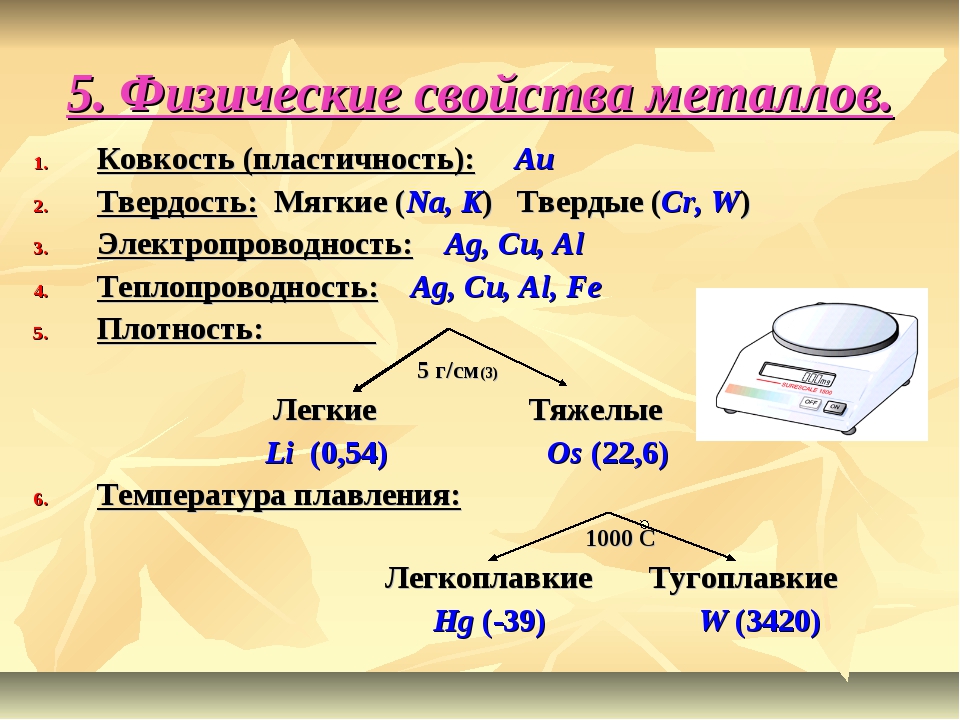
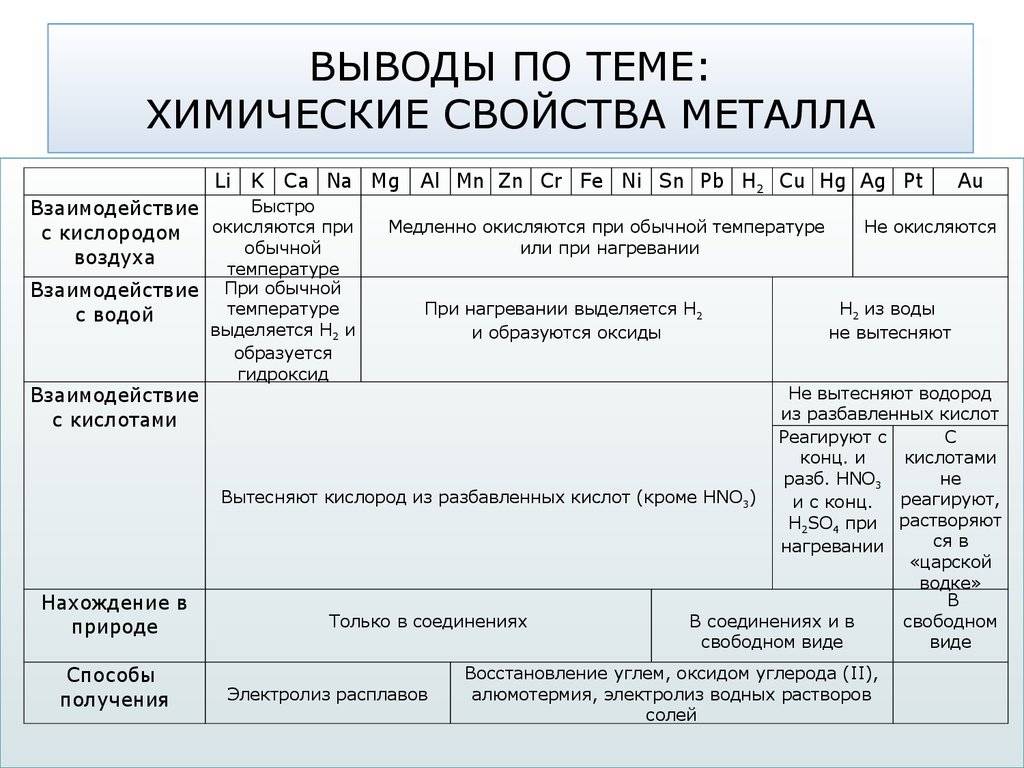
Общая характеристика химических свойств металлов
В настоящее время известно 109 химических элементов, 86 из которых являются металлами.
К металлам относятся все элементы побочных подгрупп, а также элементы главных подгрупп, расположенные ниже диагонали «бериллий — астат».
Для металлов характерны низкие значения электроотрицательности и восстановительные свойства. Практически все металлы имеют сравнительно большие радиусы и малое число электронов (от 1 до 3) на внешнем энергетическом уровне.
Металлы свободно реагируют с окислителями, так как сами являются восстановителями.
Химические свойства металлов
При взаимодействии металлов с галогенами результатом реакции будет являться галогенид.
При такой реакции взаимодействия хлора и калия восстановителем будет являться калий, так как два его атома будут отдавать по одному электрону хлору. Тем временем хлор будет играть роль окислителя, так как его степень будет понижаться.
При взаимодействии металлов с кислородом результатом будет оксид. Рассмотрим на примере взаимодействия кальция и кислорода.
При такой реакции кальция и кислорода кальций будет являться окислителем, а кислород — восстановителем.
Очень много металлов реагируют с серой, в результате чего образуется сульфид. При реагировании серы с металлами, сера выступает окислителем, а металл восстановителем.
При реагировании с водой без нагревания взаимодействуют только активные металлы, например щелочные. В результате этих реакций образуется щелочь и выделяется газообразный водород.
Менее активные металлы, такие как железо (Fe) и цинк (Zn), взаимодействуют с водой при нагревании, образуя оксид водорода и металла.
Водород в данной реакции будет играть роль окислителя в составе воды.
Реагирование металлов с кислотами. В таких реакциях металлы будут восстановителями. Окислитель — катион водорода, который образуется в растворах кислот.
Реакция с концентрированной серной кислотой:
Реакция с азотной кислотой:
Взаимодействие с солями: металл может реагировать с раствором соли, если он активнее, чем металл, входящий в состав соли.
В данной реакции катион меди будет окислителем, а металл восстановителем.
Физические свойства неметаллов
Неметаллы обладают определенными физическими свойствами, которые отличают их от металлов. Вот основные характеристики неметаллов:
1. Неметаллы не обладают металлическим блеском: В отличие от металлов, которые имеют характерный блеск, неметаллы обладают матовой поверхностью. Это связано с их структурой и электронными свойствами.
2. Неметаллы обладают низким теплопроводностью и электропроводностью: Неметаллы не передают тепло или электричество так же хорошо, как металлы. Они слабо проводят тепло и ток. Это связано с их атомной структурой и отсутствием свободных электронов.
3. Неметаллы обычно являются хрупкими: Неметаллы в большинстве своем обладают хрупкой структурой и легко ломаются при воздействии механической силы. Это происходит из-за слабости межатомных связей в их структуре.
4. Неметаллы обычно имеют низкую плотность: Плотность неметаллов обычно невысокая по сравнению с металлами. Исключение составляет некоторые неметаллы, например, иод, который обладает высокой плотностью.
5. Неметаллы имеют низкую температуру плавления и кипения: Большинство неметаллов имеют низкую температуру плавления и кипения по сравнению с металлами. Они обычно плавятся и кипят ниже 1000 градусов Цельсия.
Именно эти физические свойства позволяют отличить неметаллы от металлов и определить их природу в химических соединениях и структурах.
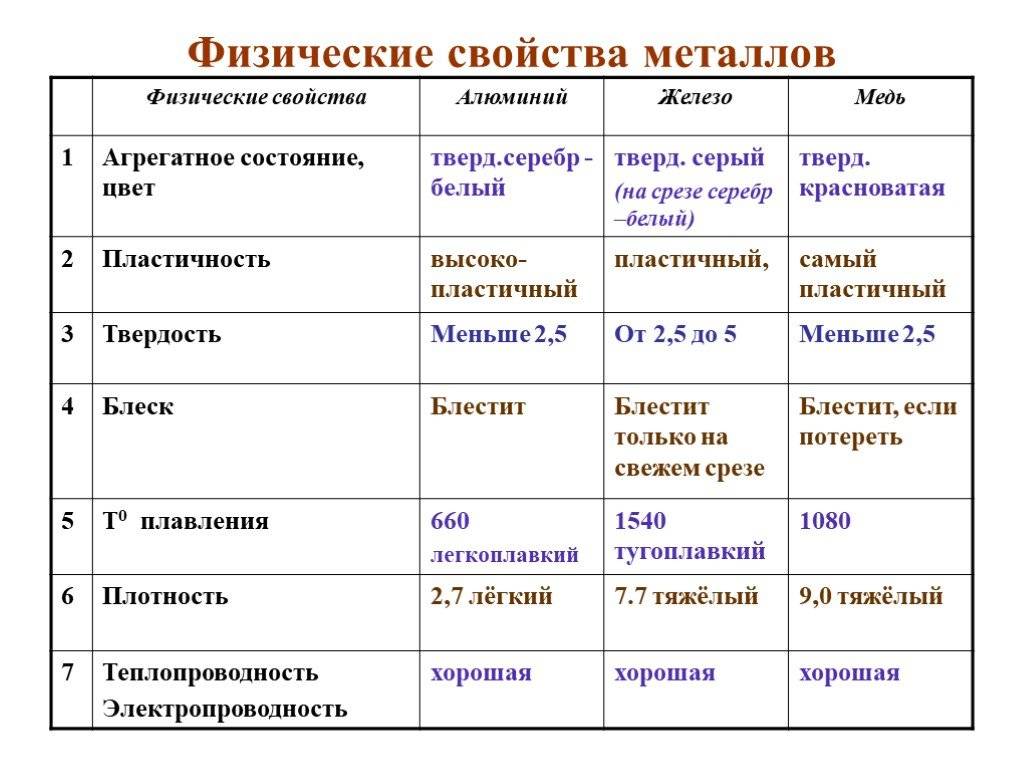
Определение металла и его свойства
Каждый день мы имеем дело с металлами и это неспроста. Большинство элементов таблицы Менделеева являются ими. Все они имеют свои характеристики и свойства.
Как правило, металлы — это такие элементы, которые хорошо проводят тепло и электричество. Также металлы очень пластичны, что позволяет изменять их форму путем ковки, еще они имеют высокий коэффициент твердости. Отличительной особенностью этого элемента является блеск, который называется металлическим. Свойства металла делятся на две основные фракции, такие как:
- Физические свойства.
- Химические свойства.
Чем металлы отличаются от металлов по физическим характеристикам? К физическим свойствам относится:
- Цвет. Металлы, как правило, имеют плотную структуру, которая не пропускает сквозь себя свет. А их цвет определяется отражением света от его поверхности. Так, металлы в большинстве случаев имеют расцветку от серого до серебристого. Но есть и исключения, как, например, медь, которая имеет красный цвет, и золото, имеющее желтый окрас.
- Состояние формы, твердость и плотность. Сами по себе металлы имеют твердое агрегатное состояние, но способны переходить в жидкое при высоких температурах. Так, металлы плавятся при температуре от 40 до 3400 градусов по Цельсию. Но встречаются металлы, чье основное агрегатное состояние — жидкое. К таким элементам относят ртуть.
- Электропроводимость. Особенностью является ее снижение при повышении температуры вещества.
- Теплопроводность и температура кипения/плавления.
Чем металлы отличаются от металлов по химическим свойствам? В этой группе выделяют:
- Окисляемость. Также металлы окисляются, и оксидная пленка на поверхности может придать им другой оттенок.
- Вступление в реакцию с неметаллами, кислотами, водой, солями.
Почему неметаллические свойства слабеют «сверху вниз»
Идем дальше. Период в таблице показывает количество уровней (тех самых орбит), по которым летают электроны.
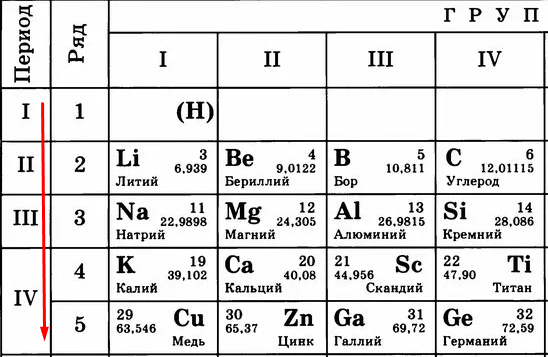
Чем больше период, тем больше этих орбит и тем дальше оказываются электроны от ядра. Сравните:
Кому сложнее удерживать электроны на последнем уровне? Меди, конечно, потому что эти электроны в два раза дальше от ядра, чем, например, у лития. Их проще становится отдать, чем пытаться удерживать.
Следовательно, «сверху вниз» количество уровней, по которым движутся электроны, растет, удерживать их становится сложнее, поэтому металлические свойства усиливаются, а неметаллические – слабеют.
Да, заряд атома тоже растет, но все-таки расстояние перевешивает. Чем больше уровней, тем труднее становится держать электроны, даже несмотря на то, что заряд увеличивается.
Обобщаю:
- Слева направо в таблице металлические свойства слабеют, неметаллические усиливаются из-за того, что ядро сильнее тянет к себе электроны.
- Сверху вниз металлические свойства усиливаются, неметаллические слабеют, потому что уровней становится больше, и удерживать электроны на последних уровнях становится труднее.
Из этих двух положений следует, что в правом углу таблицы Менделеева будут сосредоточены неметаллы, а в левом – металлы.
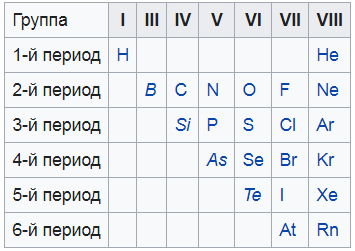
Я нашел вам вот такую картинку, на ней показаны все неметаллы. То, что выделено курсивом – это так называемые металлоиды – вроде и не совсем металлы, и в то же время не неметаллы. Нечто среднее.
Влияние на окружающую среду
Физические свойства неметаллов отличаются от физических свойств металлов и могут иметь влияние на окружающую среду
Важно учитывать, что некоторые неметаллы могут быть токсичными и вредными для живых организмов и окружающей среды
- Ряд неметаллов, таких как сера и фосфор, могут вызывать загрязнение атмосферы при сжигании или использовании в производстве.
- Хлор используется во многих процессах и может приводить к загрязнению воды и почвы, а также создавать опасные отходы.
- Фтор, хотя и не токсичен в небольших количествах, может быть опасным для окружающей среды при неправильном использовании и хранении.
- Некоторые неметаллы, такие как фосфор и кремний, могут накапливаться в почве и воде, что может иметь негативные последствия для растений, животных и людей.
Неметаллы также могут влиять на климатические процессы и озоновый слой. Например, хлорфторуглероды, широко использовавшиеся в прошлом в качестве холодильников и аэрозольных спреев, были определены как главные причины разрушения озонового слоя.
Учитывая эти факторы, важно разрабатывать и использовать методы и технологии, которые минимизируют воздействие неметаллов на окружающую среду. Внедрение более экологически чистых альтернатив и правильное использование неметаллов могут помочь уменьшить негативное влияние нашей деятельности на окружающую среду
Микроскопическое строение[]
Характерные свойства металлов можно понять, исходя из их внутреннего строения. Все они имеют слабую связь электронов внешнего энергетического уровня (другими словами, валентных электронов) с ядром. Благодаря этому созданная разность потенциалов в проводнике приводит к лавинообразному движению электронов (называемых электронами проводимости) в кристаллической решётке. Совокупность таких электронов часто называют электронным газом. Вклад в теплопроводность, помимо электронов, дают фононы (колебания решётки). Пластичность обусловлена малым энергетическим барьером для движения дислокаций и сдвига кристаллографических плоскостей. Твёрдость можно объяснить большим числом структурных дефектов (междоузельные атомы, вакансии и др.).
Из-за лёгкой отдачи электронов возможно окисление металлов, что может приводить к коррозии и дальнейшей деградации свойств. Способность к окислению можно узнать по стандартному ряду активности металлов. Этот факт подтверждает необходимость использования металлов в комбинации с другими элементами (сплав, важнейшим из которых является сталь), их легирование и применение различных покрытий.
Для более корректного описания электронных свойств металлов необходимо использовать квантовую механику. Во всех твёрдых телах с достаточной симметрией уровни энергии электронов отдельных атомов перекрываются и образуют разрешённые зоны, причём зона, образованная валентными электронами, называется валентной зоной. Слабая связь валентных электронов в металлах приводит к тому, что валентная зона в металлах получается очень широкой, и всех валентных электронов не хватает для её полного заполнения.
Принципиальная особенность такой частично заполненной зоны состоит в том, что даже при минимальном приложенном напряжении в образце начинается перестройка валентных электронов, т. е. течёт электрический ток.
Та же высокая подвижность электронов приводит и к высокой теплопроводности, а также к способности зеркально отражать электромагнитное излучение (что и придаёт металлам характерный блеск).
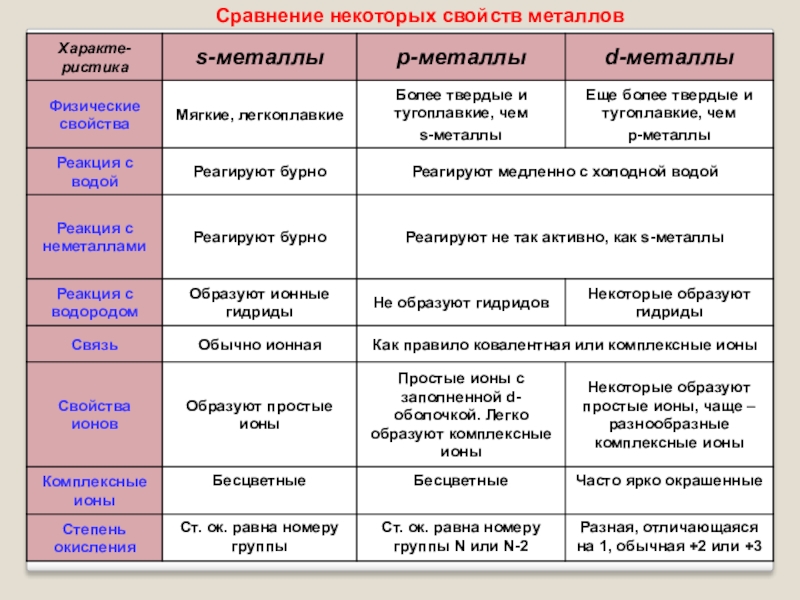
Некоторые металлы
- Щелочные:
- Литий
- Натрий
- Калий
- Щёлочноземельные:
- Бериллий
- Магний
- Кальций
- Переходные
- Железо
- Платина
- Другие:
- Алюминий
- Свинец
- Медь
- Цинк
Положение в таблице Менделеева
Металлы занимают I-II группы и побочные подгруппы III-VIII групп. Металлические свойства, т.е. способность отдавать валентные электроны или окисляться, увеличиваются сверху вниз по мере увеличения количества энергетических уровней. Слева направо металлические свойства ослабевают, поэтому наиболее активные металлы находятся в I-II группах, главных подгруппах. Это щелочные и щелочноземельные металлы.
Определить степень активности металлов можно по электрохимическому ряду напряжений. Металлы, стоящие до водорода, наиболее активны. После водорода стоят слабоактивные металлы, не вступающие в реакцию с большинством веществ.
Рис. 1. Электрохимический ряд напряжений металлов.
Металлы и неметаллы: основные свойства и отличия
Металлы и неметаллы представляют собой две основные группы элементов, существующих в химическом мире. Они имеют ряд значительных различий, определяющих их химические и физические свойства, а также их поведение в сочетании с другими элементами.
Основные свойства металлов:
- Проводимость электричества и тепла: металлы обладают высокой электропроводностью и теплопроводностью, что позволяет им быть отличными проводниками электрического тока и тепла.
- Металлический блеск: многие металлы обладают характерным металлическим блеском, который проявляется при отражении света с их поверхности.
- Пластичность и формоизменяемость: металлы могут быть легко расплавлены и отлиты в различные формы, а также подвергнуты механической обработке, включая прокатку, прессование и тягу.
- Электродность и коррозионная стойкость: многие металлы могут быть использованы в качестве электродов и обладают хорошей коррозионной стойкостью, особенно некоторые металлы, такие как золото и платина.
Основные свойства неметаллов:
- Непроводимость электричества и тепла: неметаллы имеют низкую электропроводность и теплопроводность, что делает их плохими проводниками электрического тока и тепла.
- Отсутствие металлического блеска: неметаллы обычно не обладают металлическим блеском, а могут иметь различные цвета в зависимости от своей структуры.
- Хрупкость и ломкость: большинство неметаллов характеризуется хрупкостью и ломкостью, то есть они не могут быть легко подвергнуты пластической деформации или обработке.
- Реактивность и способность образовывать ковалентные связи: неметаллы обычно обладают высокой реактивностью и образуют ковалентные связи, то есть они могут обмениваться электронами с другими элементами для образования стабильных молекул.
Эти основные свойства помогают отличить металлы от неметаллов и дают представление о том, как они ведут себя в химических реакциях и в различных приложениях. Несмотря на свои различия, металлы и неметаллы играют важную роль в различных областях человеческой деятельности и являются неотъемлемой частью нашего мира.