Строение
Молекулы жидкости не имеют строго упорядоченной структуры как в твёрдом веществе и могут перескакивать с одного места на другое, что объясняет текучесть жидкости. Расстояние между молекулами жидкого вещества близкое, но не такое большое, как между молекулами газов. Частицы жидкости не отрываются и не перемещаются свободно и хаотично.
Рис. 1. Молекулярное строение жидкости.
Притяжение между молекулами достаточно сильное, чтобы сохранять межмолекулярное расстояние, но достаточно слабое, чтобы держать молекулы в статичном положении.
Жидкость держит объём, но не держит форму, совершая колебательные движения.
ru.natapa.org
Твердое тело, жидкость, газ и плазма — это четыре основных состояния материи, в которых объекты могут быть найдены на Земле.
Почти все вещества могут быть найдены в любом из этих четырех состояний. Вода — лучший пример, который можно использовать для описания состояний вещества, поскольку его можно найти в изобилии в трех из четырех состояний: лед (твердое тело), ??вода (жидкость) и пар (газ).
В то время как освещение или неоновые газы образуют плазму.
Жидкость — это состояние вещества, которое не имеет фиксированной формы, но имеет определенный объем.
Жидкость состоит из крошечных частиц вещества, таких как атомы и молекулы, которые удерживаются вместе химическими связями. Жидкость имеет много общих характеристик с твердым и газообразным состояниями.
Подобный газу, он свободно течет и может принимать форму контейнера, в котором он находится, однако в отличие от газа он не может заполнить все пространство контейнера. Плотность жидкости ближе к твердому, чем к газу, и оба они называются конденсированными.
Отличительной особенностью жидкого состояния является поверхностное натяжение, которое приводит к смачиванию предметов при погружении в него.
Жидкие частицы связаны прочно, но не жестко, что дает ему возможность течь.
Они также могут свободно перемещаться, ограничивая подвижность частиц. Превращение жидкости в другие состояния связано с ее молекулами; когда жидкость нагревается, молекулы увеличивают вибрации и движения, заставляя их создавать большие расстояния между ними.
По мере увеличения расстояния жидкость через некоторое время превращается в газ. Во время затвердевания, когда жидкость охлаждается, молекулы собираются вместе и образуют определенный порядок, известный как кристаллизация.
Связи между ними становятся более жесткими и прочными и в конечном итоге объединяются, чтобы стать прочными. Вода является самой распространенной жидкостью на Земле и считается необходимостью для поддержания жизни.
Газ — это состояние материи, которое не имеет определенной формы или объема. Газы состоят либо из атома одного типа, либо из сложных молекул, состоящих из множества атомов.
В отличие от жидкости или твердого тела, эти атомы или молекулы не удерживаются вместе посредством сильных связей или притяжения. Следовательно, атомы и молекулы свободно перемещаются с большим пространством между частицами.
Из-за этого промежутка между молекулами большинство газов кажется бесцветным невооруженным глазом. Следовательно, по сравнению с твердым веществом или жидкостью очень трудно измерить давление, объем, количество частиц и / или температуру газа.
Тем не менее, это все еще возможно.
Кроме того, способность атомов и молекул газа распространяться друг от друга позволяет газу заполнять все пространство контейнера, в котором он находится.
Ученые смогли использовать эту способность для измерения массы и объема газа.
По сравнению с другими состояниями вещества газы имеют низкую плотность и вязкость. Кроме того, давление и температура влияют на частицы в определенном объеме газа.
Это означает, что вес, плотность и объем могут колебаться в зависимости от давления и температуры.
По мере увеличения давления и снижения температуры молекулы в газе будут сближаться друг с другом.
Через некоторое время молекулы будут настолько близки друг к другу, что их связи позволят им стать жидкостью
Принимая во внимание, что если давление снижается, а температура увеличивается, то молекулы будут вынуждены двигаться дальше друг от друга и даже могут через некоторое время разорвать свои связи
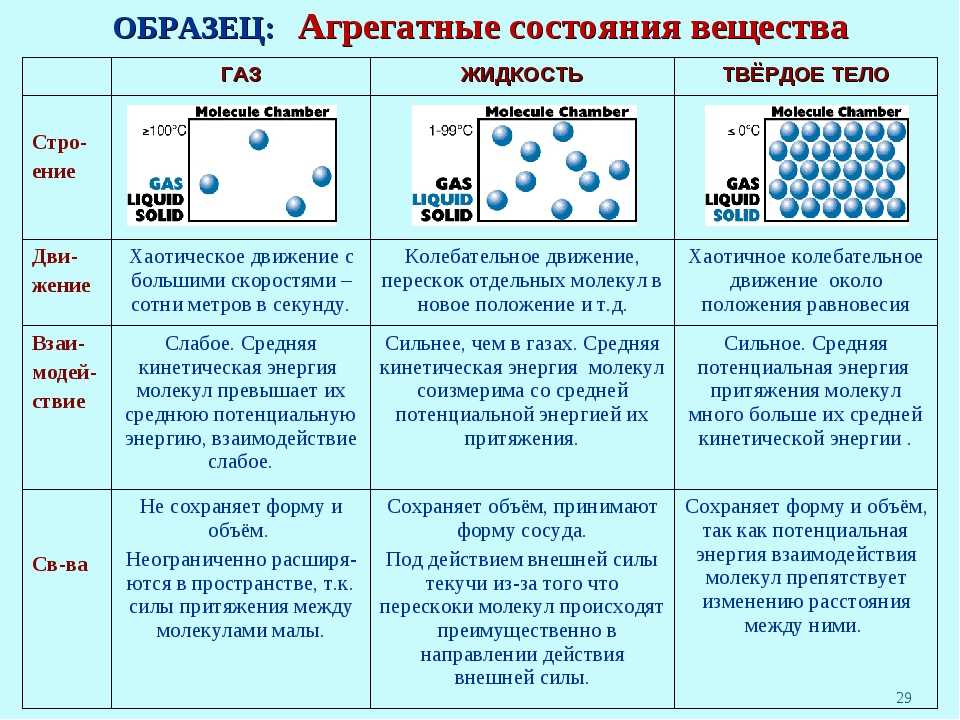
Основные различия между твердым веществом, жидкостью и газом
Разница между твердым веществом, жидкостью и газом может быть четко определена по следующим причинам:
- Вещество, обладающее структурной жесткостью и имеющее твердую форму, которую трудно изменить, называется твердым веществом. Водоподобная жидкость, которая течет свободно, имеет определенный объем, но не имеет постоянной формы, называется жидкостью. Газ относится к состоянию вещества, не имеет какой-либо формы, но полностью соответствует форме контейнера, в который он помещен.
- Хотя твердые вещества имеют определенную форму и объем, жидкости имеют только определенный объем, но не форму, газы не имеют ни формы, ни объема.
- Уровень энергии самый высокий в газах, средний в жидкости и самый низкий в твердых веществах.
- Сжатие твердых частиц затруднено, жидкости почти несжимаемы, но газы легко сжимаются.
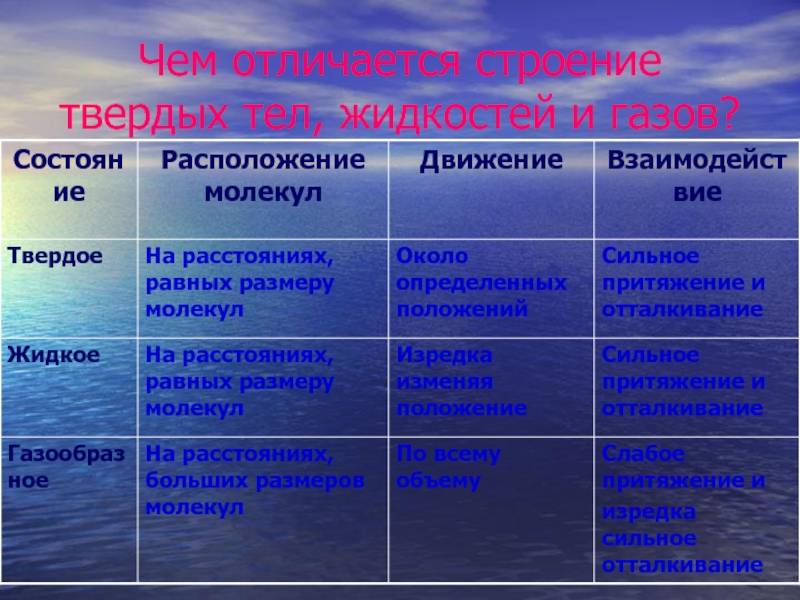
- Молекулярное расположение твердых веществ является регулярным и близким, но жидкости имеют неправильное и редкое молекулярное расположение, а газы также имеют случайное и более редкое расположение молекул.
- Молекулярное расположение в твердых телах хорошо организовано. Однако в случае жидкостей слои молекул скользят и скользят друг над другом. Напротив, частицы в газах совсем не организованы, из-за чего частицы движутся случайно.
- Когда дело доходит до текучести, твердые вещества не могут течь, однако жидкости могут течь, и это также от более высокого уровня до более низкого уровня. В отличие от этого газы текут во всех направлениях.
- Пространства между молекулами и кинетической энергией минимальны в твердых телах, средние в жидких и максимальные в газах. Таким образом, движение молекул незначительно в твердых телах, тогда как в жидкостях наблюдается беспорядочное, случайное движение молекул. В отличие от газов, которые имеют свободное, постоянное и случайное движение молекул.
- В твердых телах частицы плотно удерживаются сильным межмолекулярным притяжением, хотя в жидкостях притяжение между частицами является промежуточным. В отличие от этого частицы слабо удерживаются, потому что межмолекулярное притяжение слабое.
- Скорость звука самая высокая в твердых телах, а скорость немного ниже в жидкостях и минимальная в газах.
- Поскольку твердые вещества имеют определенную форму и размер, им не требуется контейнер для хранения. Жидкости нельзя хранить без контейнера. И наоборот, для хранения газов необходим закрытый контейнер.
Изменение в состоянии материи
Вещество меняет свое состояние от одной формы к другой, когда нагревается или охлаждается, что подпадает под физическое изменение. Итак, ниже приведены некоторые процессы, посредством которых состояние вещества может быть изменено:
- Плавление : процесс превращения твердого вещества в жидкость.
- Замораживание : процесс, который помогает в превращении жидкости в твердое вещество.
- Испарение : процесс, используемый для превращения жидкости в газ.
- Конденсация : процесс, при котором газ превращается в жидкость.
- Сублимация . Когда твердое вещество превращается в газ, оно называется сублимацией.
- Описание : процесс, посредством которого газ превращается в твердое вещество.
Заключение
Следовательно, в этой статье мы узнали, что вещество присутствует в трех состояниях: твердое тело, жидкость и газ. Кроме того, состояние вещества являются взаимозаменяемыми, то есть форма может быть изменена путем изменения температуры или давления.
Физические свойства жидкости и газа
Форма и объем: Основное отличие между жидкостью и газом состоит в их форме и объеме. Жидкость имеет определенную форму, которая приспосабливается к форме ее сосуда, но она может свободно течь и изменять свою форму. Газ, не имеет определенной формы и объема, он полностью заполняет свой сосуд.
Плотность: Жидкость имеет большую плотность по сравнению с газом. Это означает, что молекулы жидкости находятся ближе друг к другу и взаимодействуют сильнее, чем молекулы газа, что является причиной большей плотности жидкости.
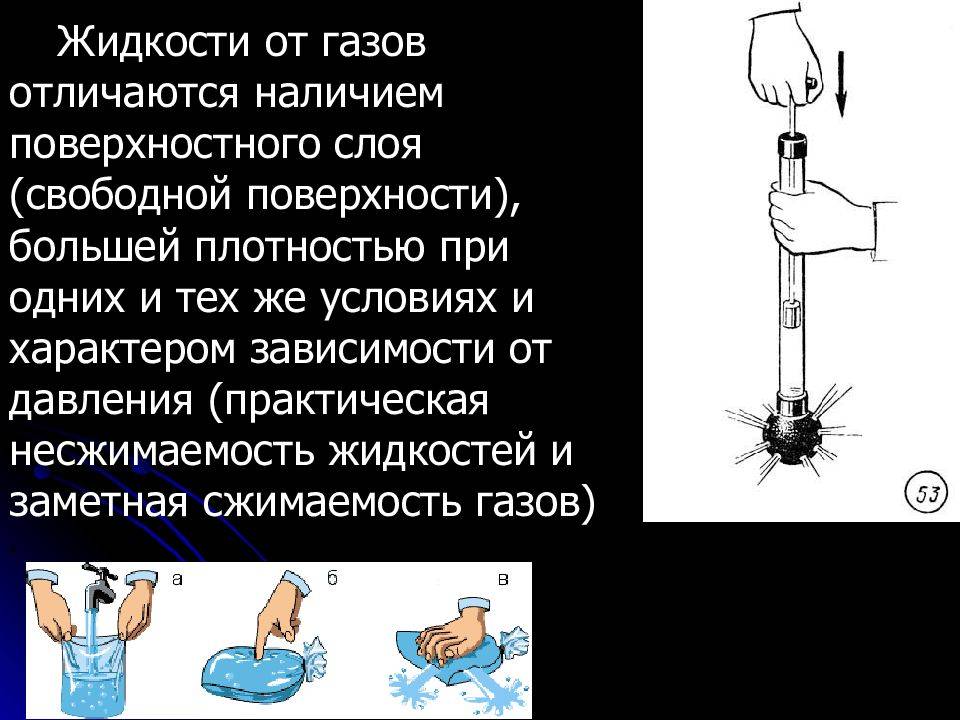
Сжимаемость: Жидкость практически несжимаема, то есть ее объем изменяется незначительно при изменении давления. Газ же обладает высокой сжимаемостью, что означает, что его объем может значительно изменяться при изменении давления.
Диффузия: Жидкость и газ также различаются в своей способности к диффузии. Диффузия — это процесс перемещения молекул вещества от области с высокой концентрацией к области с низкой концентрацией. Жидкость диффундирует сравнительно медленно, тогда как газ быстро и равномерно диффундирует.
Теплопроводность: Жидкость обладает более высокой теплопроводностью по сравнению с газом. Это означает, что жидкость способна передавать тепло более эффективно, чем газ.
Поверхностное натяжение: Еще одно отличие между жидкостью и газом состоит в поверхностном натяжении. Жидкость имеет поверхностное натяжение, которое позволяет ей образовывать капли или подниматься по поверхности. Газ не обладает поверхностным натяжением и не может образовывать капли на поверхности.
Таким образом, физические свойства жидкости и газа существенно отличаются друг от друга, хотя оба они являются флюидами и имеют много общих черт.
Состояние газообразного и жидкого вещества
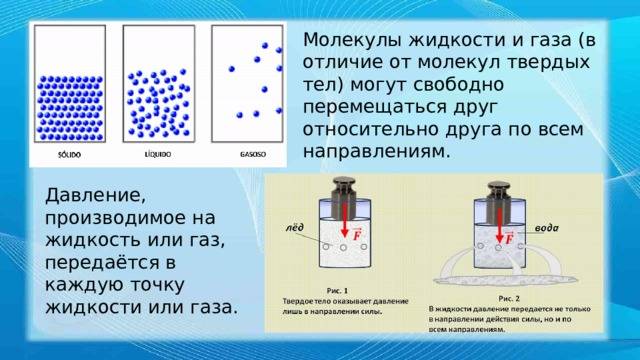
Главное отличие между газообразным и жидким состояниями заключается в том, как молекулы или атомы взаимодействуют друг с другом. В газообразном состоянии молекулы движутся в свободном состоянии и не соприкасаются между собой, в то время как в жидком состоянии молекулы более плотно упакованы и взаимодействуют друг с другом посредством сил притяжения.
Газы легко расширяются и заполняют всю доступную им область, не имея определенной формы или объема. Они могут заполнять контейнеры любой формы и проникать в малейшие щели. Жидкости же имеют определенный объем и форму, они не могут расширяться без ограничений и занимают форму сосуда, в котором находятся. Они также имеют поверхность, которая подвержена влиянию силы тяжести.
Еще одной важной разницей между газообразным и жидким состояниями является плотность. Газы обычно имеют низкую плотность, так как их молекулы находятся на большом удалении друг от друга
Жидкости же имеют гораздо большую плотность по сравнению с газами, так как их молекулы находятся гораздо ближе друг к другу.
Свойства также различаются в терминах сжимаемости газов и жидкостей. Газы легко сжимаются, так как между их молекулами имеется большое пространство. Жидкости же практически несжимаемы, так как их молекулы находятся очень близко друг к другу.
Важным отличием между газами и жидкостями является также температура перехода из одного состояния в другое. Газы преобразуются в жидкости при понижении температуры до их точки кипения, а жидкости могут превращаться в газы при повышении температуры до их точки кипения.
Газообразное и жидкое состояния вещества играют важную роль в нашей повседневной жизни и в различных процессах, таких как кипячение, испарение, конденсация и диффузия. Понимание их основных отличий и свойств помогает нам лучше понять и объяснить множество явлений и процессов в природе и научных дисциплинах.
Свойства давления:
Основными свойствами давления являются:
1. Интенсивность: Давление определяется количеством частиц вещества и их средней скоростью. Чем больше частиц и чем быстрее они движутся, тем выше давление.
2. Распределенность: Давление распределяется равномерно во всех направлениях. Это означает, что везде, где есть вещество, будет действовать давление.
3. Зависимость от высоты: Давление в жидкостях и газах зависит от их высоты или глубины. Чем выше находится вещество, тем ниже давление.
4. Закон Паскаля: Давление, создаваемое на одной части сосуда, распространяется равномерно на все его части. Этот закон объясняет передачу давления в жидкостях и газах.
5. Меры давления: Давление измеряется в паскалях (Па) или атмосферах (атм). Паскаль — это единица измерения международной системы единиц (СИ), а атмосфера — это единица измерения вне системы СИ.
Таким образом, свойства давления в жидкостях и газах имеют важное значение для понимания и изучения различных физических процессов и явлений в природе и технике
Comparison Table
| Feature | Vapor | Gas |
|---|---|---|
| Definition | Gaseous phase of a substance in equilibrium with its | Gaseous phase of a substance not necessarily in |
| liquid or solid state | equilibrium with its liquid or solid state | |
| Temperature Dependence | Typically exists below the critical temperature | Exists above the critical temperature and below |
| of its substance | the critical pressure | |
| Density | Higher density than gas at the same pressure | Lower density than vapor at the same pressure |
| Shape | No definite shape (conforms to container) | No definite shape (conforms to container) |
| Intermolecular Forces | Stronger intermolecular forces compared to gas | Weaker intermolecular forces compared to vapor |
| Examples | Water vapor, mercury vapor | Oxygen, nitrogen, carbon dioxide |
Изменение в состоянии материи
Вещество меняет свое состояние от одной формы к другой, когда нагревается или охлаждается, что подпадает под физическое изменение. Итак, ниже приведены некоторые процессы, посредством которых состояние вещества может быть изменено:
- Плавление : процесс превращения твердого вещества в жидкость.
- Замораживание : процесс, который помогает в превращении жидкости в твердое вещество.
- Испарение : процесс, используемый для превращения жидкости в газ.
- Конденсация : процесс, при котором газ превращается в жидкость.
- Сублимация . Когда твердое вещество превращается в газ, оно называется сублимацией.
- Описание : процесс, посредством которого газ превращается в твердое вещество.
Переходы состояний
Вещества могут находиться в разных состояниях: твердом, жидком и газообразном. Переходы между этими состояниями происходят при изменении температуры и давления.
При повышении температуры твердое вещество может перейти в жидкое состояние, а затем в газообразное. Эти переходы называются плавление и испарение соответственно. При понижении температуры газообразное вещество может конденсироваться, сначала преобразуясь в жидкость, а затем в твердое состояние. Эти переходы называются конденсация и затвердевание.
Помимо изменения температуры, переходы между состояниями также могут происходить при изменении давления. Например, при повышении давления газ может стать жидким без изменения температуры. Это явление называется сжижением. При дальнейшем повышении давления жидкость может затвердеть.
Таблица ниже показывает различные переходы состояний веществ:
| Переход | Пример |
|---|---|
| Плавление | Лед превращается в воду при повышении температуры |
| Испарение | Вода превращается в пар при повышении температуры |
| Конденсация | Пар превращается в воду при понижении температуры |
| Затвердевание | Вода превращается в лед при понижении температуры |
| Сжижение | Газ превращается в жидкость при повышении давления |
| Затвердение | Жидкость превращается в твердое вещество при повышении давления |
Молекулярная структура газов
Газы представляют собой агрегатное состояние вещества, которое характеризуется высокой подвижностью и низкой плотностью. Основным отличием газов от жидкостей и твердых тел является то, что молекулы газов находятся в постоянном движении и не имеют определенной формы и объема.
Молекулярная структура газов основана на взаимодействии между отдельными молекулами. В большинстве газов молекулы находятся на расстоянии друг от друга и взаимодействуют слабыми силами притяжения, такими как ван-дер-ваальсовы силы. Однако, некоторые газы, такие как водород или азот, могут образовывать связи между молекулами.
Молекулярная структура газов может быть описана с помощью различных моделей. Наиболее распространенной моделью является идеальный газ, в котором молекулы считаются точками без размеров и взаимодействуют идеально, то есть не влияют друг на друга. Это позволяет использовать простые математические законы, такие как уравнение состояния идеального газа.
Однако, большинство реальных газов не соответствуют полностью модели идеального газа. Молекулы реальных газов имеют конечные размеры и взаимодействуют друг с другом, что приводит к отклонениям от идеального поведения. Эти отклонения могут быть описаны с помощью моделей, таких как модель Ван-дер-Ваальса или модель Джоуля-Томсона.
В целом, молекулярная структура газов является сложной и многоаспектной. Понимание этой структуры позволяет лучше объяснить и предсказать поведение газов в различных условиях, что имеет практическое значение для таких областей, как химия, физика и инженерия.
Определение
В большинстве своем газы – ковалентные соединения (исключение составляет группа благородных газов) либо простые вещества. Сжимаемость и способность к расширению – характерные свойства газов.
Газам присущи слабые связи между теми частицами, что составляют их. Частицы газа обладают большой подвижностью, свободным хаотическим движением, происходящем в промежутках между их столкновениями, при которых они резко меняют характер движения.
По мере увеличения температуры газа давление также увеличивается. Молекулы газа движутся с более высокими скоростями и чаще попадают в стенки контейнера, тем самым увеличивая давление.
Связь между давлением газа и объемом является обратной зависимостью.
По мере увеличения объема газа давление уменьшается. Существует больше возможностей для движения молекул газа, поэтому они менее часто ударяют по стенкам контейнера, что означает более низкое давление.
Материя — это вещество, занимающее пространство. Вся материя — твердая, жидкая или газовая, и они называются состояниями материи.
Везде, где человек смотрит, есть примеры твердых тел: столы, стулья, окна, скалы, ткани и многое другое.
Примеры жидкостей: вода, молоко, сок, шоколадный сироп, сода и другие. Примеры газов сложнее увидеть, потому что они невидимы: кислород в воздухе, газ пропана, используемый для гриля, гелий внутри баллона и многое другое.
Жидкость – агрегатное состояние веществ. Ее основное свойство – способность к неограниченному изменению формы, которая трансформируется из-за воздействия механических касательных движений, даже если сила их ничтожна.
При этом жидкость практически сохраняет изначальный объем. Ковалентные (вода), а так же ионные соединения (азотная кислота) и металлы (ртуть) могут находиться в жидком состоянии.
«Донецкий техникум промышленной автоматики»
Все, что угодно, можно назвать твердым, жидким или газообразным. Помимо того, что они выглядят, существует множество различий между твердыми веществами, жидкостями и газами.
Эти различия называются характеристиками.
Характеристики каждого состояния материи различны. Эти характеристики определяют, является ли вещество твердым, жидким или газообразным.
Он может быть твердым или мягким, гладким или грубым.
Твердое тело может быть большим, как Статуя Свободы, или маленьким, как мрамор. Он может быть очень крошечным, как хлебная крошка, или такой большой, как гора, и все между ними.
Если достаточно мало, твердые тела могут удерживаться в руке человека, и их трудно сжимать или толкать или изменять форму.
Влияние давления и температуры
Давление и температура играют важную роль в определении свойств жидкостей и газов. Они оказывают влияние на движение молекул, свободное пространство, энергию и другие характеристики вещества.
Давление – это сила, действующая на единицу площади поверхности. В жидкостях и газах давление порождается столкновениями молекул с поверхностью сосуда или другими молекулами. Увеличение давления приводит к увеличению количества столкновений и, следовательно, к увеличению движения молекул.
В жидкостях молекулы движутся быстро, но они находятся достаточно близко друг к другу, чтобы взаимодействовать. Поэтому жидкости практически не сжимаемы, и их объем не изменяется при увеличении давления. В то же время, плотность жидкостей может изменяться при изменении температуры.
В газах молекулы движутся еще быстрее, и они находятся на достаточно большом расстоянии друг от друга, чтобы взаимодействовать. Газы характеризуются низкой плотностью и большой подвижностью молекул. Под действием давления газы могут сжиматься и изменять свой объем.
Температура – это мера средней кинетической энергии молекул вещества. При повышении температуры молекулы получают больше энергии и начинают двигаться быстрее, что приводит к увеличению давления.
Температура также оказывает влияние на вязкость вещества. Вязкость – это сопротивление, которое оказывает вещество движению других объектов через него. При повышении температуры вязкость жидкостей снижается, а вязкость газов увеличивается.
Итак, как можно видеть, давление и температура играют важную роль в определении свойств жидкостей и газов. Они влияют на движение, свободное пространство, энергию, давление, массу, вязкость и плотность вещества.
What is Vapor?
Vapor is formed when a substance undergoes vaporization, a process where it transitions from its liquid or solid state to the gas phase. This transformation occurs when sufficient energy is added to overcome the intermolecular forces holding the substance in its condensed state.
Characteristics of Vapor:
- State of Matter: Vapor exists in the gaseous state, sharing characteristics with gases. However, it differs in that it originates from substances with higher molecular weights that are liquids or solids under standard conditions.
- Composition: The composition of vapor mirrors that of the substance from which it originates. For example, water vapor consists of water molecules, while vapor from volatile liquids contains molecules of the substance in the gas phase.
- Temperature Dependence: The formation and behavior of vapor are heavily influenced by temperature. Higher temperatures increase the kinetic energy of molecules, facilitating vaporization and leading to increased vapor pressure.
- Pressure and Volume Relationship: Similar to gases, vapor obeys the ideal gas law, demonstrating a proportional relationship between pressure and volume when temperature and the amount of substance remain constant.
Significance of Vapor:
- Industrial Applications: Vapor plays a crucial role in various industrial processes, including distillation, evaporation, and vapor deposition. These processes are vital in sectors such as chemical engineering, pharmaceuticals, and semiconductor manufacturing.
- Climate and Weather: Water vapor is a key component of Earth’s atmosphere and significantly influences weather patterns and climate. Understanding vapor’s behavior helps meteorologists predict weather phenomena such as precipitation, fog, and cloud formation.
- Technological Advancements: Advances in vapor-related technologies have led to innovations in fields like energy production, where vapor turbines are used in power plants, and environmental science, with developments in vapor compression for refrigeration and air conditioning.
Перспективы использования газа в будущем
Газ является одним из наиболее важных энергетических и топливных ресурсов нашей планеты. Использование газа имеет большое значение в различных сферах человеческой деятельности и играет важную роль в промышленности, транспорте, быту и генерации электроэнергии.
В будущем, использование газа ожидается значительно расшириться, особенно с учетом постепенного отказа от ископаемых топлив и перехода к более экологически чистым источникам энергии. Газ может стать основным источником энергии благодаря своей доступности, сравнительно низкой стоимости и широкому спектру применения.
Среди перспектив использования газа в будущем можно выделить:
- Энергетика. Газ будет играть важную роль в обеспечении энергетической безопасности многих стран. Он может быть использован для производства электроэнергии в газовых турбинах, паровых и газовых котлах.
- Мобильность. Газ может быть использован в качестве топлива для автомобилей, а также в грузовом транспорте, железнодорожном транспорте и судоходстве. Его использование позволит снизить выбросы вредных веществ и улучшить экологическую обстановку.
- Промышленность. Газ может быть использован в процессах производства металлургической, химической, нефтехимической и других отраслей промышленности.
Однако, важно учесть также негативные аспекты использования газа, такие как выбросы парниковых газов при его сжигании и возможность аварий на газопроводах. Поэтому важно вести дальнейшие исследования и развивать технологии, которые позволят использовать газ с максимальной эффективностью и минимальными негативными воздействиями на окружающую среду и человеческое здоровье
Преимущества использования газа
Преимущества
Пояснение
Экологическая чистота
Газ сжигается с меньшими выбросами вредных веществ, чем ископаемые топлива, такие как уголь или нефть.
Доступность
Газовые месторождения находятся на территории многих стран, что обеспечивает их энергетическую независимость.
Экономическая эффективность
Газ имеет относительно низкую стоимость и может быть использован для различных целей, что делает его экономически выгодным ресурсом.