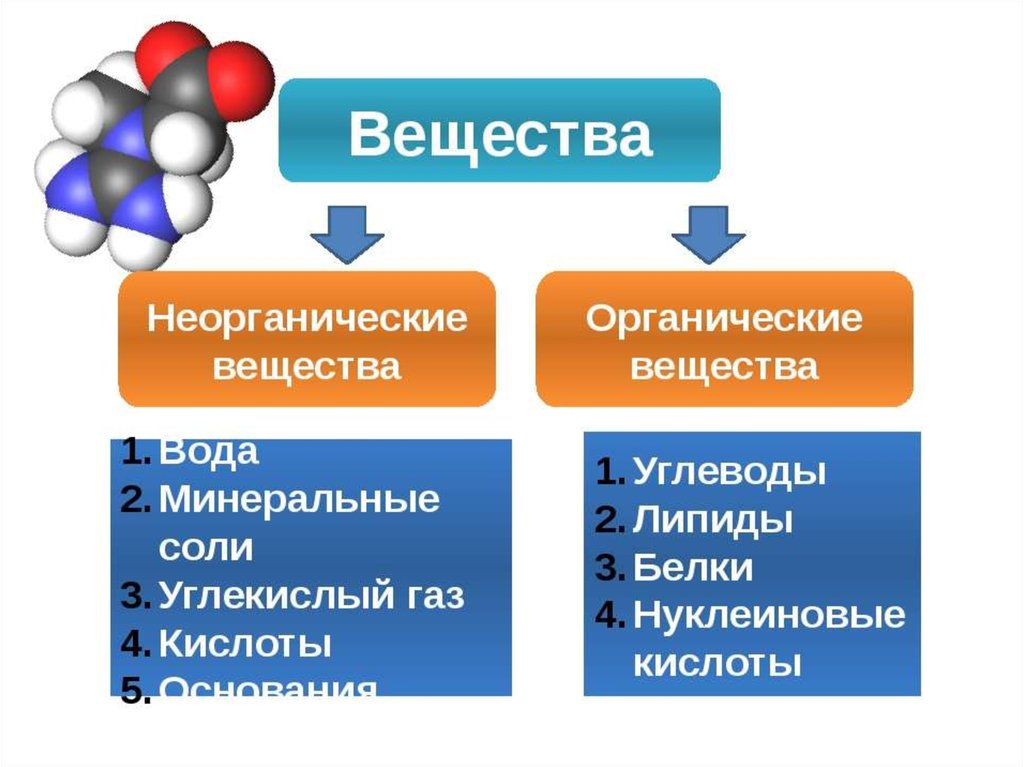
Неорганические вещества
Неорганические вещества могут быть найдены в природе, созданы и использованы человеком как строительные материалы, катализаторы, добавки в пищу и многое другое.
Неорганические вещества имеют разнообразные свойства, такие как проводимость тепла и электричества, прочность, растворимость в воде и других растворителях, а также способность образовывать кристаллическую структуру.
Многие неорганические вещества имеют важное практическое применение. Например, металлы широко используются в производстве различных изделий и машин
Соли, такие как хлорид натрия и сернистый кислород, используются в медицине и пищевой промышленности. Керамика и стекло, также являющиеся неорганическими веществами, применяются в строительстве и производстве посуды.
Важно отметить, что неорганические вещества могут взаимодействовать с органическими веществами, что ведет к образованию различных химических соединений
Определение и свойства
Органические вещества обладают следующими характеристиками:
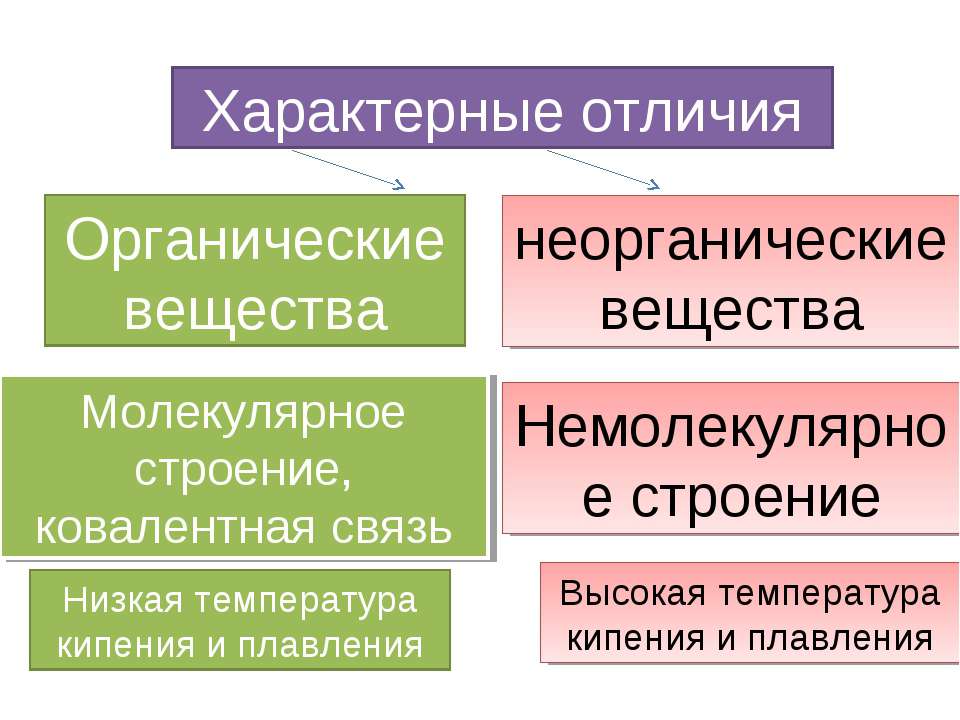
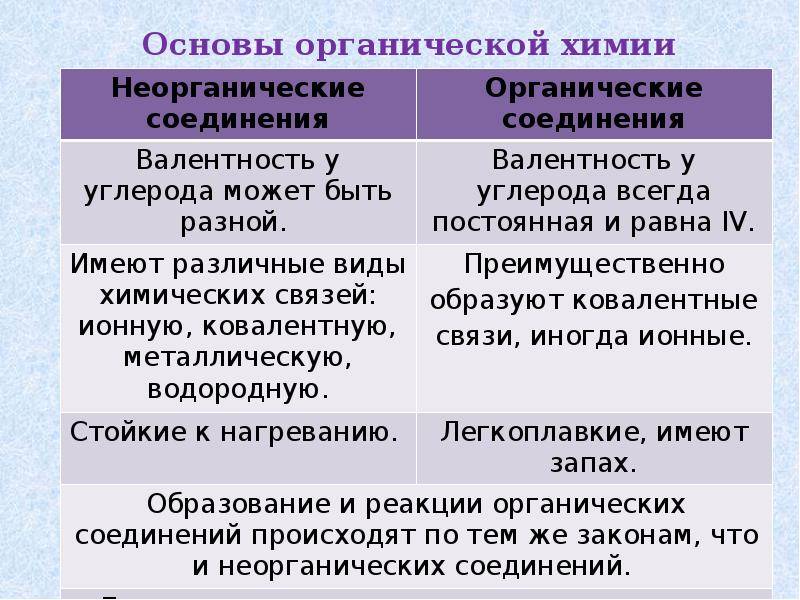
- Образуют ковалентные связи. Органические соединения содержат один или несколько углеродных атомов, которые связаны с другими атомами посредством ковалентных связей.
- Обладают высокой температурой кипения и плавления. Большинство органических веществ обладают более низкими температурами кипения и плавления, чем неорганические вещества.
- Могут быть сжигаемыми. Органические вещества могут сгореть при наличии кислорода, и в результате возникают два продукта — углекислый газ и вода.
- Могут образовывать растворы. Органические вещества могут растворяться в различных растворителях, таких как вода, спирт и другие органические соединения.
- Обладают способностью образовывать многочисленные соединения. Органические вещества могут образовывать огромное разнообразие соединений, благодаря наличию углерода и его способности образовывать ковалентные связи.
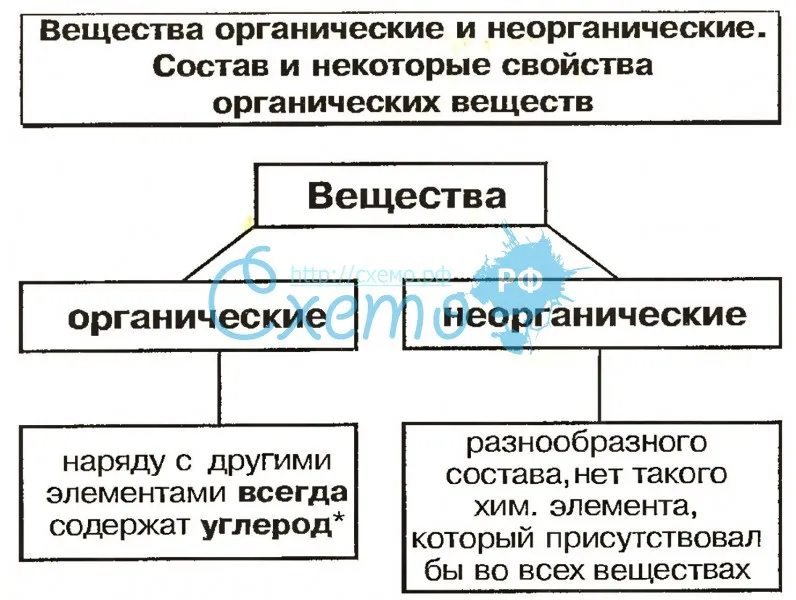
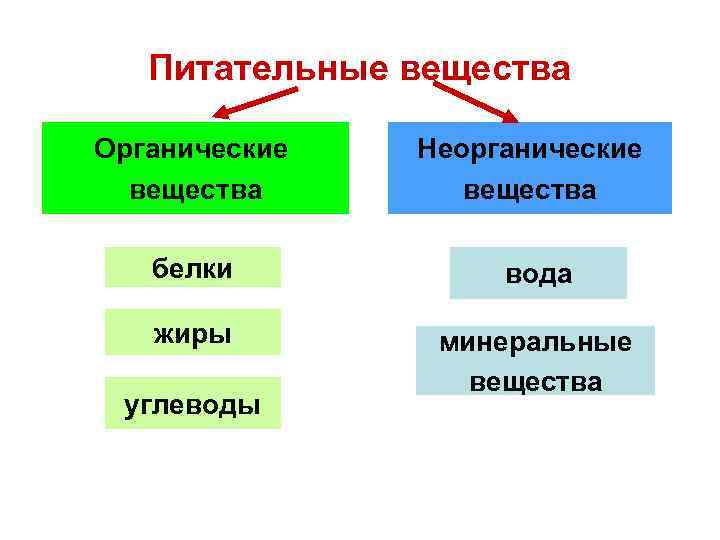
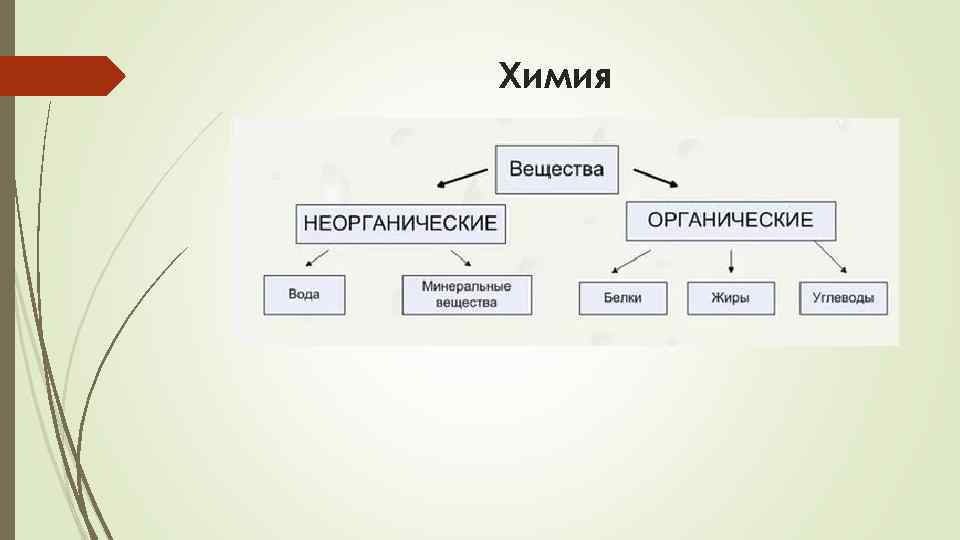
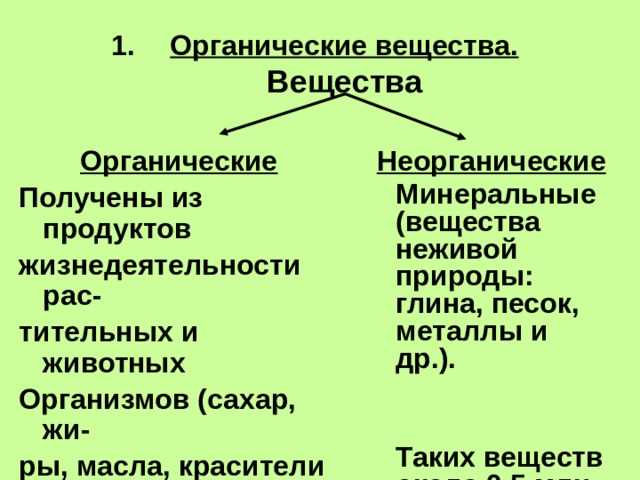
Неорганические вещества, в отличие от органических, не содержат углерода в их структуре. Они могут быть как живыми, так и неживыми веществами. Примеры неорганических веществ включают минералы, металлы, соли, воду и газы, такие как кислород и азот.
Неорганические вещества также имеют свои характеристики:
- Могут образовывать ионные связи. Соединения, состоящие из неорганических веществ, обычно образуются путем обмена электронами и формирования ионных связей.
- Могут обладать высокой температурой кипения и плавления. Некоторые неорганические вещества обладают очень высокой температурой кипения и плавления, например, металлы.
- Могут образовывать растворы. Некоторые неорганические вещества могут растворяться в воде или других растворителях, образуя ионы в растворе.
- Могут обладать электропроводностью. Некоторые неорганические вещества, такие как соли или кислоты, могут проводить электрический ток в растворе или в твердом состоянии.
Примеры неорганических веществ
Неорганические вещества включают в себя различные классы неорганических соединений, включая минералы, соли, кислоты и основания. Вот некоторые примеры неорганических веществ:
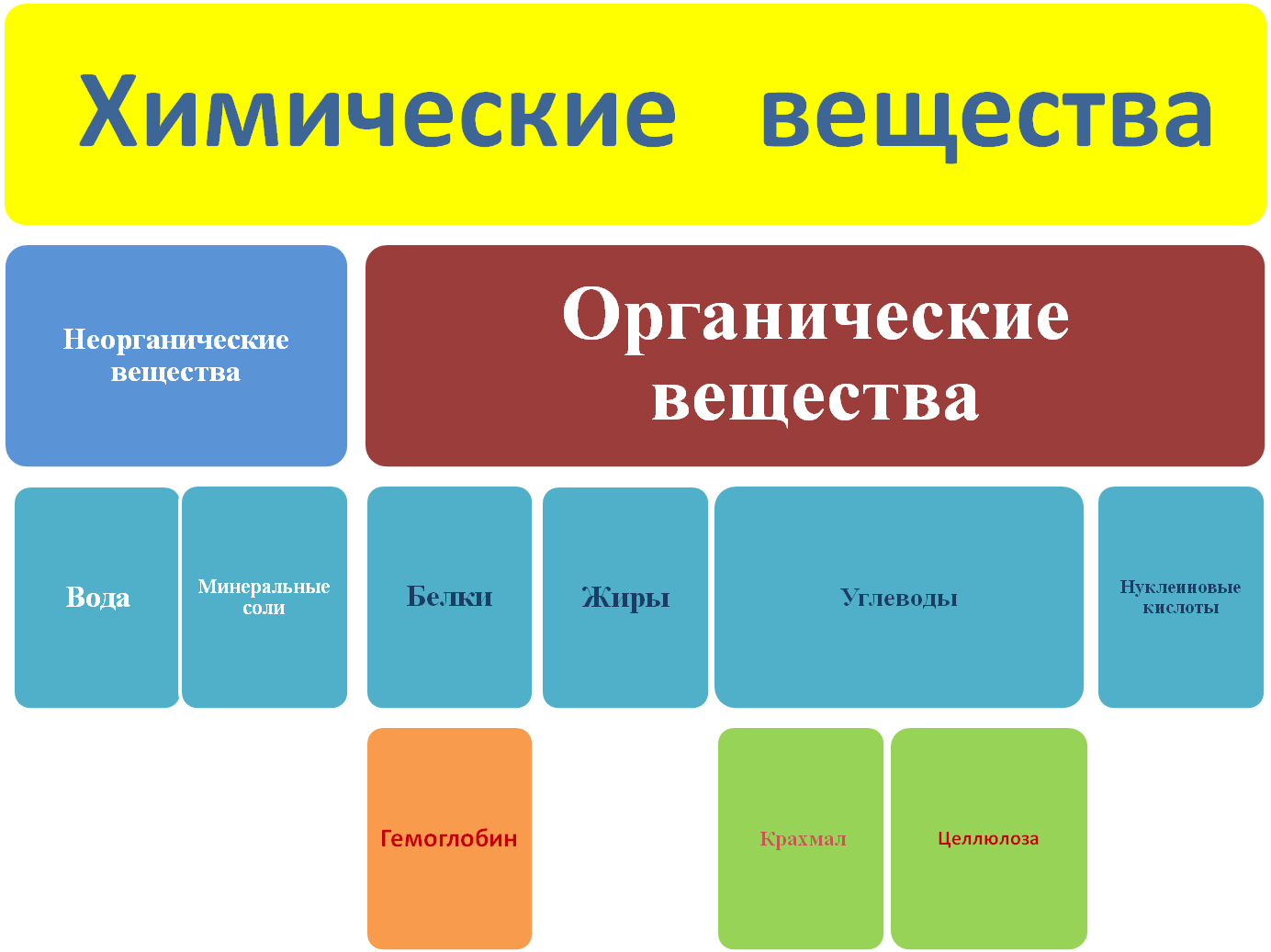
1. Вода (H2O) — одно из ключевых неорганических соединений, состоящее из атомов водорода и кислорода.
2. Соль (NaCl) — неорганическое соединение, получаемое из хлористого натрия и хлорида натрия. Является одним из самых распространенных неорганических веществ.
3. Карбонат кальция (CaCO3) — основной компонент мрамора и известняка. Используется в строительстве и производстве цемента.
4. Кислота серной (H2SO4) — является одним из наиболее распространенных неорганических кислот, используется в промышленности для производства удобрений, красителей и других химических соединений.
5. Оксиды (например, оксид железа, Fe2O3) — простые неорганические соединения, состоящие из атомов кислорода и других элементов.
Это лишь некоторые примеры неорганических веществ. Неорганическая химия изучает различные свойства и реакции этих веществ, а их применение широко распространено в различных отраслях науки, медицины и промышленности.
Органические вещества
Органические вещества широко распространены и встречаются в живых организмах, включая растения, животных и микроорганизмы. Они составляют основу жизни, так как участвуют во многих биохимических процессах, например, в образовании ДНК, белков, углеводов и липидов.
Органические вещества также встречаются в неживой природе, например, в нефти, угле и газе. Они используются для производства множества продуктов, включая пластик, лекарства, красители, пищевые добавки и многое другое. Благодаря своей разнообразной структуре и свойствам органические вещества играют важную роль в нашей повседневной жизни.
Определение и свойства
Органические вещества обладают рядом характеристических свойств:
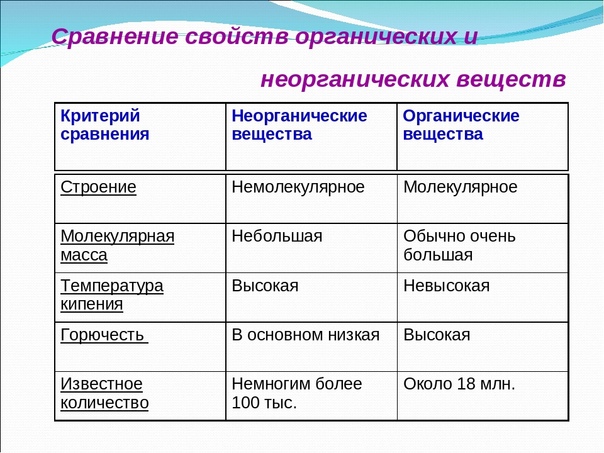
- Низкая температура кипения и плавления. Органические вещества обычно имеют более низкую температуру кипения и плавления по сравнению с неорганическими соединениями. Это связано с более слабыми силами притяжения между их молекулами.
- Растворимость в органических растворителях. Большинство органических веществ хорошо растворяются в органических растворителях, таких как спирты, эфиры и углеводороды. Это связано с схожностью их молекул и способностью образовывать водородные связи и дипольные взаимодействия.
- Возможность образования связей с другими элементами и соединениями. Углерод, как основной компонент органических веществ, способен образовывать множество различных связей с другими элементами, что делает молекулы органических соединений очень разнообразными.
- Существование в различных изомерных формах. Многие органические вещества могут существовать в виде изомеров — молекул с одинаковым химическим составом, но отличающихся трехмерной структурой и свойствами. Это связано с способностью углерода образовывать цепочки и кольца с различным расположением атомов.
Неорганические вещества — это химические соединения, не содержащие углерод. В их состав могут входить такие элементы, как металлы, газы, кислоты и основания.
Неорганические вещества обладают свойствами, которые отличают их от органических:
- Высокая температура кипения и плавления. Неорганические соединения обычно обладают более высокой температурой кипения и плавления по сравнению с органическими веществами. Это связано с более сильными силами притяжения между их частицами.
- Часто нерастворимы в органических растворителях. Большинство неорганических веществ плохо растворяются в органических растворителях, но могут быть хорошо растворены в воде или других неорганических растворителях.
- Возможность образования ионов. Многие неорганические вещества могут ионизироваться в растворе, образуя положительные и отрицательные ионы.
- Минимальное количество изомеров. В отличие от органических веществ, неорганические соединения редко образуют изомеры, так как их структура обычно простая и неспособствует образованию различных трехмерных форм.
Примеры органических веществ
- Углеводы: глюкоза, фруктоза, сахароза, целлюлоза.
- Липиды: жиры, масла, холестерин.
- Белки: гемоглобин, коллаген, антитела.
- Нуклеиновые кислоты: ДНК, РНК.
- Аминокислоты: глицин, лейцин, аргинин.
- Витамины: витамин С, витамин Е, витамин А.
- Органические кислоты: уксусная кислота, яблочная кислота, лимонная кислота.
Это лишь некоторые примеры органических веществ, которые присутствуют в нашей жизни. Они широко используются в пищевой промышленности, фармацевтике, косметике и многих других отраслях.
Свойства и реакционная способность
Органические вещества обладают рядом особенных свойств и реакционной способностью, что делает их уникальными по сравнению с неорганическими соединениями.
В основе реакционной способности органических веществ лежит присутствие связей C-C и C-H в их молекулах. Эти связи являются очень прочными и препятствуют непосредственной реакции с другими веществами. Органические соединения могут быть стабильными и устойчивыми к воздействию окружающей среды, но они также могут проявлять высокую реакционную способность и быть активными в условиях, позволяющих разрушить связи C-C и C-H.
Органические вещества могут проявлять различные виды реакций, такие как замещение, дополнение, деформация, расщепление и присоединение. Они могут образовывать новые соединения при взаимодействии с кислотами, основаниями, окислителями, восстановителями и другими веществами
Важно отметить, что реакционная способность органических веществ зависит от их структуры, функциональных групп и условий, в которых происходит реакция
Свойства органических веществ также могут быть связаны с их плотностью, температурой плавления и кипения, электропроводностью и оптическими свойствами. Например, некоторые органические вещества могут быть жидкими, твердыми или газообразными при комнатной температуре, в зависимости от их молекулярной структуры и сил взаимодействия между молекулами.
- Плотность: некоторые органические вещества имеют низкую плотность, что делает их легкими и подходящими для использования в легких конструкциях.
- Температура плавления и кипения: органические вещества обычно имеют низкую температуру плавления и кипения по сравнению с неорганическими соединениями. Это связано с более слабыми межмолекулярными взаимодействиями в органических соединениях.
- Электропроводность: большинство органических веществ являются слабыми проводниками электричества из-за отсутствия ионных связей и наличия ковалентных связей с неделями связных электронами.
- Оптические свойства: некоторые органические вещества обладают оптической активностью и могут взаимодействовать с поляризованным светом.
В целом, свойства и реакционная способность органических веществ делают их незаменимыми для жизни на Земле. Они могут быть использованы в различных областях, таких как медицина, пищевая промышленность, энергетика, сельское хозяйство и многих других.
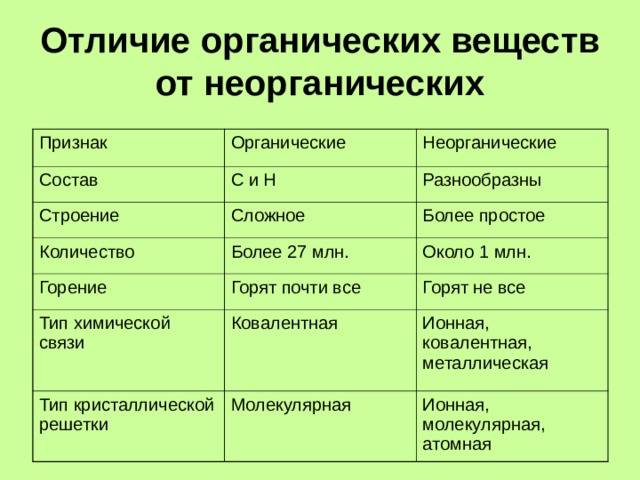
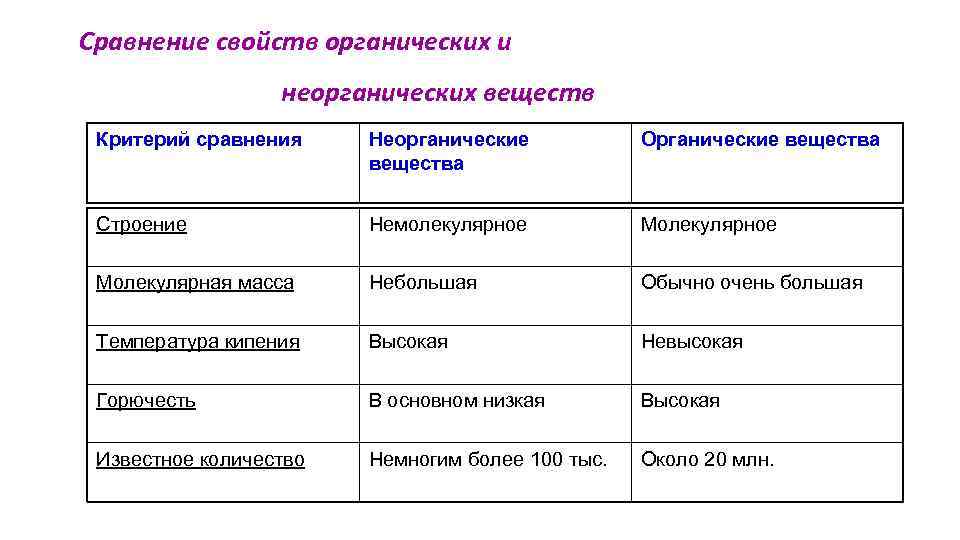
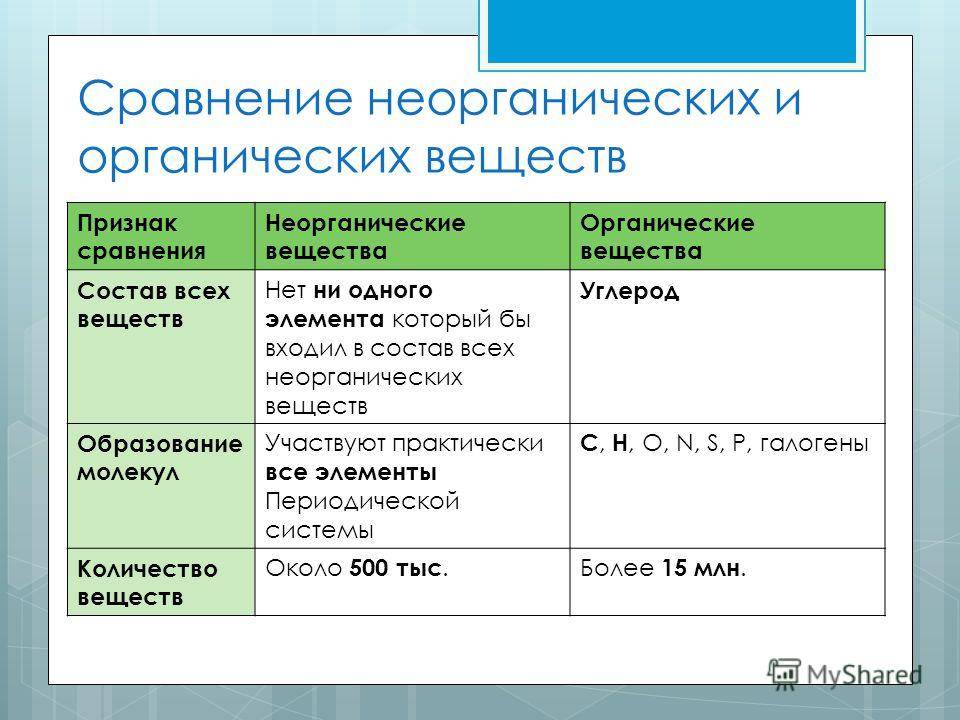
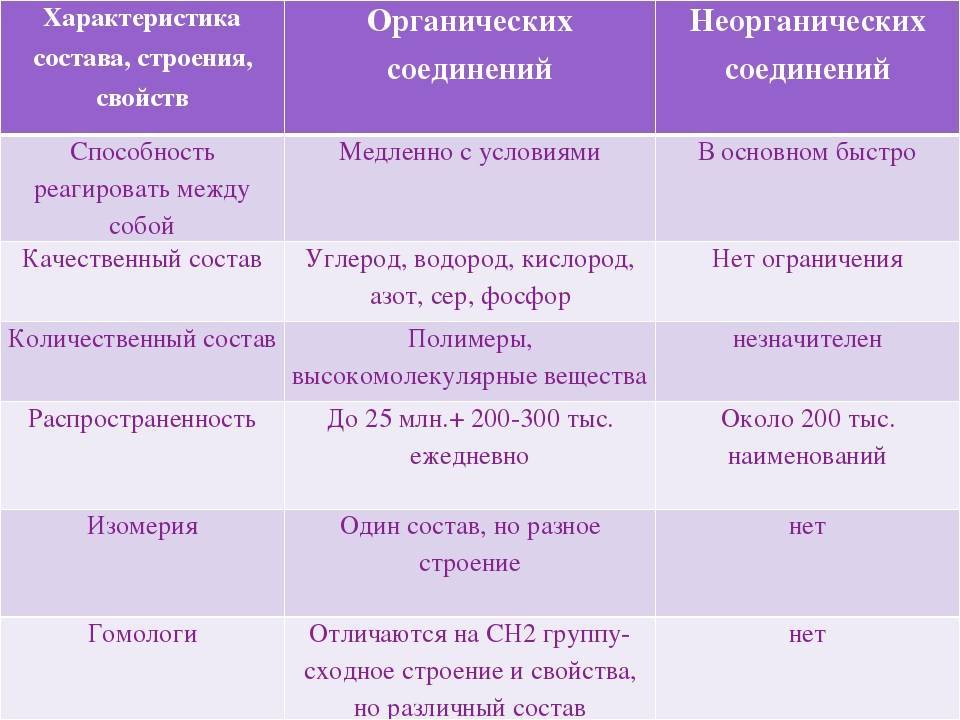
Различия между органическими и неорганическими соединениями
Органическое вещество и неорганическое вещество имеют большое сходство, но они также имеют отличительные элементы, которые позволяют их различать. Ниже приведены некоторые из основных отличий.
1. Элементы, которые обычно настраивают каждый тип соединения
Одним из различий между органическими и неорганическими соединениями, более заметными и в то же время более простыми для понимания, является тип элементов, которые являются их частью.
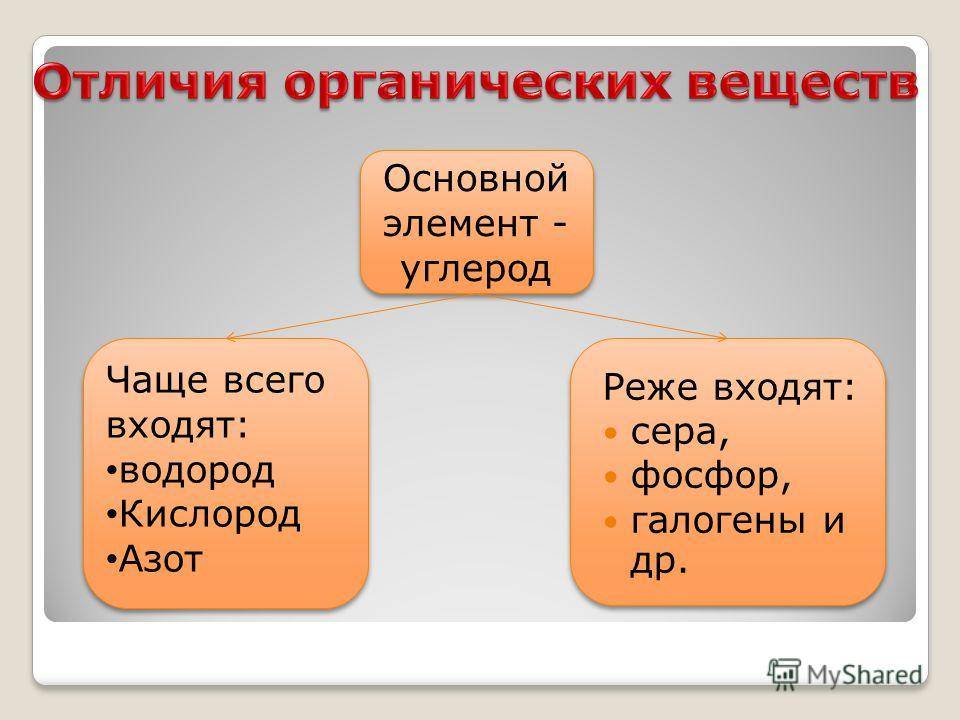
В случае органических соединений они основаны главным образом на углероде и его сочетании с другими элементами. Они обычно образуются из углерода и водорода, кислорода, азота, серы и / или фосфора.
С другой стороны, неорганические соединения могут быть образованы любым элементом периодической таблицы, хотя они не будут основаны на углероде (хотя в некоторых случаях они могут содержать углерод, например, окись углерода).
2. Тип главной ссылки
Как правило, считается, что все или почти все органические соединения образуются путем объединения атомов через ковалентные связи. В неорганических соединениях, однако, преобладают ионные или металлические связи, хотя могут также появляться другие типы связей.
3. Стабильность
Другое различие между органическими и неорганическими соединениями обнаруживается в стабильности соединений. Хотя неорганические соединения имеют тенденцию быть стабильными и не претерпевать серьезных модификаций, если в игру не вступают более или менее мощные химические реакции, органические соединения легко дестабилизируются и разлагаются.
4. Сложность
Хотя неорганические соединения могут образовывать сложные структуры, они обычно имеют тенденцию поддерживать простую организацию. Однако органические соединения имеют тенденцию образовывать длинные цепи различной сложности.
5. Теплостойкость
Другое различие между органическими и неорганическими соединениями заключается в количестве тепла, необходимого для изменения, такого как плавление. Температура на органические соединения легко воздействует, поэтому для их плавления требуются относительно низкие температуры. Однако неорганические соединения, как правило, требуют очень высокого уровня нагрева, чтобы войти в процесс плавления (например, вода не кипит до ста градусов Цельсия).
6. Растворимость
Растворение органического соединения обычно очень сложно, если не доступен конкретный растворитель (такой как спирт) из-за его ковалентных связей. Однако большинство неорганических соединений, поскольку в них преобладают связи ионного типа, легко растворимы.
7. Электропроводность
Как правило, органические соединения, как правило, не являются электропроводящими и изолирующими, в то время как неорганические компоненты (особенно металлы) делают это с большой легкостью.
8. Изомер
Изомерия относится к способности соединений появляться с различными химическими структурами, несмотря на то, что они имеют одинаковый состав (например, другой порядок в цепи, которая образует соединение, приведет к соединениям с различными характеристиками). Хотя это может происходить как в органических, так и в неорганических соединениях, оно гораздо более распространено в первом из-за его тенденции создавать цепочки связанных атомов.
9. Скорость реакции
Химические реакции в неорганических соединениях имеют тенденцию быть быстрыми и не требуют вмешательства других элементов, кроме реагентов. Напротив, химические реакции неорганических соединений имеют переменную скорость и могут требовать присутствия внешних элементов для инициирования или продолжения реакции, например, в форме энергии.
Достоинства и недостатки органических удобрений
Главным достоинством органических подкормок является их низкая цена. Вы самостоятельно можете сделать компост, который не только насытит почву полезными элементами, но и улучшит структуру почвы. Казалось бы, органические удобрения состоят из одних плюсов, но у них есть несколько недостатков, которые нужно учесть при использовании:
- во время приготовления и распространения по грунту органика издает неприятный и резкий запах;
- если внести слишком много подкормки, растения насытятся нитратами;
- при неправильной подготовке подкормки можно заразить грунт нематодой, гельминтами или грибками;
- приготовление и распределение по участку органических удобрений требует затраты времени и сил.
Для этого достаточно в специальной яме смешивать очистки, опилки, выдернутую сорную траву и другие отходы. Через три года удобрение можно будет вносить в грунт.
Различия между органическими и неорганическими соединениями
Органическое вещество и неорганическое вещество имеют большое сходство, но они также имеют отличительные элементы, которые позволяют их различать. Ниже приведены некоторые из основных отличий.
1. Элементы, которые обычно настраивают каждый тип соединения
Одним из различий между органическими и неорганическими соединениями, более заметными и в то же время более простыми для понимания, является тип элементов, которые являются их частью.
В случае органических соединений они основаны главным образом на углероде и его сочетании с другими элементами. Они обычно образуются из углерода и водорода, кислорода, азота, серы и / или фосфора.
С другой стороны, неорганические соединения могут быть образованы любым элементом периодической таблицы, хотя они не будут основаны на углероде (хотя в некоторых случаях они могут содержать углерод, например, окись углерода).
2. Тип главной ссылки
Как правило, считается, что все или почти все органические соединения образуются путем объединения атомов через ковалентные связи. В неорганических соединениях, однако, преобладают ионные или металлические связи, хотя могут также появляться другие типы связей.
3. Стабильность
Другое различие между органическими и неорганическими соединениями обнаруживается в стабильности соединений. Хотя неорганические соединения имеют тенденцию быть стабильными и не претерпевать серьезных модификаций, если в игру не вступают более или менее мощные химические реакции, органические соединения легко дестабилизируются и разлагаются.
4. Сложность
Хотя неорганические соединения могут образовывать сложные структуры, они обычно имеют тенденцию поддерживать простую организацию. Однако органические соединения имеют тенденцию образовывать длинные цепи различной сложности.
5. Теплостойкость
Другое различие между органическими и неорганическими соединениями заключается в количестве тепла, необходимого для изменения, такого как плавление. Температура на органические соединения легко воздействует, поэтому для их плавления требуются относительно низкие температуры. Однако неорганические соединения, как правило, требуют очень высокого уровня нагрева, чтобы войти в процесс плавления (например, вода не кипит до ста градусов Цельсия).
6. Растворимость
Растворение органического соединения обычно очень сложно, если не доступен конкретный растворитель (такой как спирт) из-за его ковалентных связей. Однако большинство неорганических соединений, поскольку в них преобладают связи ионного типа, легко растворимы.
7. Электропроводность
Как правило, органические соединения, как правило, не являются электропроводящими и изолирующими, в то время как неорганические компоненты (особенно металлы) делают это с большой легкостью.
8. Изомер
Изомерия относится к способности соединений появляться с различными химическими структурами, несмотря на то, что они имеют одинаковый состав (например, другой порядок в цепи, которая образует соединение, приведет к соединениям с различными характеристиками). Хотя это может происходить как в органических, так и в неорганических соединениях, оно гораздо более распространено в первом из-за его тенденции создавать цепочки связанных атомов.
9. Скорость реакции
Химические реакции в неорганических соединениях имеют тенденцию быть быстрыми и не требуют вмешательства других элементов, кроме реагентов. Напротив, химические реакции неорганических соединений имеют переменную скорость и могут требовать присутствия внешних элементов для инициирования или продолжения реакции, например, в форме энергии.
Замещенные углеводороды
- Галогенопроизводные углеводородов можно рассматривать как продукты замещения в углеводородах одного или нескольких атомов водорода атомами галогенов. В соответствии с этим могут существовать предельные и непредельные моно-, ли-, три- (в общем случае поли-) галогенопроизводные.Общая формула галогенопроизводных предельных углеводородов R—Г.К кислородсодержащим органическим веществам относят спирты, фенолы, альдегиды, кетоны, карбоновые кислоты, простые и сложные эфиры.
- Спирты — производные углеводородов, в которых один или несколько атомов водорода замещены на гидроксильные группы.Спирты называют одноатомными, если они имеют одну гидроксильную группу, и предельными, если они — производные алканов.Общая формула предельных одноатомных спиртов: R—ОН.
- Фенолы — производные ароматических углеводородов (ряда бензола), в котором один или несколько атомов водорода в бензольном кольце замещены на гидроксильные группы.
- Альдегиды и кетоны — производные углеводородов, содержащие карбонильную группу атомов (карбонил).В молекулах альдегидов одна связь карбонила идет на соединение с атомом водорода, другая — с углеводородным радикалом.В случае кетонов карбонильная группа связана с двумя (в общем случае разными) радикалами.
- Простые эфиры представляют собой органические вещества, содержащие два углеводородных радикала, соединенные атомом кислорода: R=О—R или R—О—R2.Радикалы могут быть одинаковыми или разными. Состав простых эфиров выражается формулой СnН2n+2O.
- Сложные эфиры — соединения, образованные замещением атома водорода карбоксильной группы в карбоновых кислотах на углеводородный радикал.
- Нитросоединения — производные углеводородов, в которых один или несколько атомов водорода замещены на нитрогруппу —NO2.
- Амины — соединения, которые рассматривают как производные аммиака, в котором атомы водорода замещены на углеводородные радикалы.В зависимости от природы радикала амины могут быть алифатическими. В зависимости от числа замещенных на радикалы атомов водорода различают первичные амины, вторичные, третичные. В частном случае у вторичных, а также третичных аминов радикалы могут быть и одинаковыми. Первичные амины можно также рассматривать как производные углеводородов (алканов), в которых один атом водорода замещен на аминогруппу. Аминокислоты содержат две функциональные группы, соединенные с углеводородным радикалом, — аминогруппу —NH2 и карбоксил -СOОН.
Применение неорганических веществ
Неорганические вещества широко используются в различных отраслях промышленности и научных исследованиях. Они обладают рядом особенностей, которые делают их незаменимыми в определенных областях.
1. Строительство и строительные материалы:
- Цемент и бетон: неорганические вещества, такие как глинозем, гипс, кальций и алюминий, используются в производстве цемента и бетона, которые являются основными строительными материалами. Они обладают высокой прочностью, долговечностью и замечательными свойствами защиты от огня.
- Керамика: неорганические материалы, такие как кремний, кальций и алюминий, используются для производства различных изделий из керамики, таких как кирпичи, плитки и посуда. Керамические материалы обладают отличной устойчивостью к высоким температурам, коррозии и механическим воздействиям.
- Стекло: неорганические вещества, такие как кварц и глинозем, являются основными компонентами стекла. Стекло применяется во многих областях: от производства окон и зеркал до изготовления лабораторной посуды и оптических линз. Оно обладает прозрачностью, жесткостью и высокой химической стабильностью.
2. Электроника и полупроводники:
- Силиций: неорганическое вещество, известное своими полупроводниковыми свойствами. Оно является основным материалом для изготовления полупроводниковых чипов, которые используются в электронных устройствах и компьютерах.
- Металлы: неорганические металлы, такие как алюминий, железо и медь, используются в производстве электронных компонентов, проводов и контактов. Они обладают высокой электропроводностью и прочностью, что делает их идеальными для использования в электронных устройствах.
3. Химическая промышленность:
- Катализаторы: многие неорганические вещества, такие как платина, никель и рутений, используются в химической промышленности в качестве катализаторов для ускорения химических реакций.
- Неорганические кислоты и щелочи: различные неорганические кислоты, такие как серная, азотная и хлороводородная, а также неорганические щелочи, такие как гидроксид натрия и гидроксид калия, являются важными реагентами для производства различных химических соединений.
И это только некоторые из многочисленных примеров применения неорганических веществ. Благодаря своим уникальным свойствам и разнообразию химических соединений, неорганические вещества остаются неотъемлемой частью современной промышленности и научных исследований.
Заключение
В заключение следует отметить, что классификация соединений на органические и неорганические зависит от различных факторов. В то время как органические вещества в основном состоят из соединений на основе углерода и изучаются в органической химии, неорганические соединения могут содержать углерод, но сохраняют свою неорганическую природу. Такие примеры, как угольная кислота, соли, получаемые из кислот, цианистый водород и цианиды, демонстрируют существование углеродсодержащих неорганических соединений. Понимая эти различия, мы получаем более глубокое представление об огромном мире химических соединений и их разнообразных характеристиках.
В: В чем разница между органическими и неорганическими веществами? О: Органические вещества – это соединения, которые содержат атомы углерода и изучаются в области органической химии. Неорганические вещества, с другой стороны, могут содержать или не содержать углерод, но не классифицируются как органические соединения. Они изучаются в области неорганической химии.
В: Сколько существует известных органических и неорганических соединений? О: Органические соединения более многочисленны, и в настоящее время известно около 40 миллионов органических соединений. В отличие от них, неорганических соединений известно около 700 000.
В: Могут ли неорганические соединения содержать углерод? О: Да, есть исключения, когда неорганические соединения содержат углерод. В качестве примера можно привести угарный газ (CO), двуокись углерода (CO2), угольную кислоту (H2CO3) и некоторые цианиды. Несмотря на содержание углерода, эти соединения все равно считаются неорганическими.
В: Каково значение органической химии? О: Органическая химия имеет решающее значение для понимания и изучения свойств, реакций и применения углеродсодержащих соединений. Она имеет огромное значение в различных областях, таких как фармацевтика, материаловедение, биохимия и экология, что ведет к прогрессу в медицине, технологиях и устойчивых решениях.
В: Каковы некоторые области применения неорганической химии? О: Неорганическая химия находит применение в таких областях, как материаловедение, экология, катализ, хранение энергии и координационная химия. Она вносит вклад в разработку новых материалов, создание катализаторов, понимание экологических процессов и развитие энергетических технологий.
В: Существуют ли какие-либо пересекающиеся области между органической и неорганической химией? О: Да, области органической и неорганической химии могут пересекаться, особенно при изучении металлоорганических соединений. Эти соединения содержат как органические, так и неорганические компоненты и являются предметом междисциплинарных исследований.
Помните, что данный FAQ предназначен для предоставления общей информации, а для более подробных или специфических вопросов рекомендуется обратиться к соответствующей научной литературе или экспертам в данной области.
Что почитать
1. “Органическая химия” Н.Д. Зелинского и А.Е. Фаворского – Этот классический учебник представляет собой полное введение в органическую химию и охватывает различные аспекты органических соединений, их свойства, реакции и применение.
2. “Введение в неорганическую химию” (Введение в неорганическую химию) В.А. Кузнецова – Эта книга предлагает обзор фундаментальных принципов неорганической химии, включая изучение неорганических соединений, их свойств и их применения в различных областях.
3. “Химия: Органическая и неорганическая” (Химия: органическая и неорганическая) А.В. Артемьева и Е.В. Буниной – Учебник представляет собой комплексный подход к органической и неорганической химии, охватывающий основные понятия, реакции и применение органических и неорганических соединений.
4. “Органическая химия: Сборник задач” (Органическая химия: сборник задач) С.А. Чуканова и С.Е. Алексаняна – Эта книга посвящена решению задач по органической химии и содержит сборник упражнений и примеров для углубления понимания предмета и повышения уровня знаний.