Применение кипения и испарения
Кипение и испарение являются физическими процессами, которые применяются в различных областях нашей жизни. Вот некоторые примеры их применения:
Кипение в быту:
Кипение используется в быту для приготовления пищи, например, при варке воды для чая или приготовлении супов и соусов. Кипячение достигается путем нагревания воды до определенной температуры, при которой происходит переход жидкости в парообразное состояние.
Кипение в промышленности:
В промышленности кипение используется для процессов дистилляции, выпаривания растворов, выпаривания соли и многих других производственных процессов
Эти процессы позволяют получать различные продукты и материалы, удалять загрязнения и концентрировать растворы.
Испарение в природе:
Испарение является важной частью водного круговорота на Земле. Солнечная энергия нагревает океаны, реки, озера и почву, вызывая испарение воды
Испарение также происходит с растений через процесс транспирации. Это позволяет воде переходить из жидкой формы в парообразную, подниматься в атмосферу и затем выпадать в форме осадков, образуя дождь, снег или град.
Испарение в технологии:
Испарение используется в различных технологических процессах, таких как сушка материалов, холодильная техника, охлаждение электрических компонентов и другие. В этих процессах испарение помогает удалять избыточную влагу, снижать температуру и охлаждать поверхности, что является важным для эффективной работы различных систем.
Кипение и испарение играют важную роль в нашей повседневной жизни и в процессах производства. Они позволяют нам приготовить пищу, получить различные продукты и материалы, поддерживать баланс водного круговорота на Земле и обеспечивать работу различных технологических систем.
Что такое кипение?
Кипение происходит при определенной температуре, называемой точкой кипения. Точка кипения зависит от давления, поэтому при увеличении давления точка кипения также повышается. Обратно, при снижении давления точка кипения уменьшается.
Когда жидкость начинает кипеть, ее молекулы приобретают достаточную энергию, чтобы преодолеть силы притяжения друг к другу и перейти в газообразное состояние. При кипении происходит интенсивное образование пузырьков пара, которые возникают на разных глубинах жидкости и перемещаются к поверхности.
Кипение является важным процессом для различных приложений. Например, в процессе приготовления пищи мы используем кипение для варки воды или приготовления различных жидких продуктов. Кипение также широко используется в промышленности, научных исследованиях и многих других областях.
Определение и процесс кипения
Отличие между кипением и испарением заключается в процессе превращения жидкости в пар. В случае испарения, это происходит с поверхности жидкости при любой температуре, но при кипении процесс происходит внутри жидкости и требует достижения определенной температуры, которая зависит от внешних условий, включая давление.
Когда жидкость нагревается, ее частицы приобретают большую кинетическую энергию. При достижении точки кипения энергия частиц становится достаточно высокой, чтобы преодолеть межмолекулярные силы и выйти из жидкостной фазы в виде пара.
Во время кипения происходит интенсивное образование пара, образуется огромное количество пузырьков. Когда пузырьки достигают поверхности жидкости, они лопаются и пар выходит в окружающую среду.
Температура, при которой происходит кипение, зависит от давления. Например, вода кипит при 100°C при нормальном атмосферном давлении, но при сниженном давлении (на высоте) точка кипения воды уменьшается.
Итак, кипение — это процесс фазового перехода жидкости в пар при достижении определенной температуры и зависит от давления.
Температура и давление при кипении
Температура, при которой происходит кипение, зависит от давления. Обычно называется стандартная температура кипения, и для воды она равна 100 °C при атмосферном давлении. Однако, под действием высокого давления, температура кипения может быть значительно выше.
Отличие между кипением и испарением в том, что при кипении происходит фазовый переход на всей поверхности жидкости, в то время как при испарении молекулы жидкости переходят в газовую фазу только с поверхности жидкости.
Давление также влияет на скорость испарения и кипения. При повышенном давлении более высокая температура требуется для кипения, так как давление поддерживает жидкость в жидком состоянии и препятствует фазовому переходу.
Таким образом, температура и давление играют важную роль в процессах кипения и испарения, и их взаимодействие определяет условия, при которых происходят эти фазовые переходы.
Примеры практического применения кипения
Одним из примеров практического применения кипения является использование этого процесса в котлах для отопления и горячего водоснабжения. При нагревании воды в котле происходит ее кипение. Пар, образующийся в результате кипения, распространяется по системе трубопроводов, обеспечивая тепло в помещениях и горячую воду в кранах.
Еще одним примером применения кипения является работа паровых турбин. При нагреве водяного пара в специальных паровых котлах происходит его кипение. Образованный пар используется для привода турбины, которая в свою очередь приводит в движение генератор электричества.
Кипение также широко используется в пищевой промышленности при приготовлении пищевых продуктов. Например, при кипячении воды для приготовления макарон или картофеля. Также, при приготовлении пищевого жира происходит его расплавление и последующее кипение.
В области медицины кипение может использоваться для стерилизации медицинского оборудования. Высокая температура пара, образующегося при кипении, помогает уничтожить бактерии и микроорганизмы, делая инструменты безопасными для использования.
Таким образом, кипение находит широкое применение в различных сферах жизни, обеспечивая нам тепло, электричество, приготовленную пищу и безопасность.
Кипячение против испарения
В разница между кипячением и испарением в том, что кипение относится к любой жидкости, которая превращается в газ после непрерывного нагрева. Испарение относится к естественному процессу, при котором жидкость превращается в газ из-за высокой температуры или давления. При кипячении образуются пузыри, но при испарении пузыри не образуются.
В большинстве случаев кипение – это не естественный процесс, в отличие от процесса испарения. Испарение является естественным, обычно относящимся к круговороту воды.
Испарение может происходить в любой момент, независимо от повышения температуры. Поставьте на столешницу стакан с водой на достаточно долгое время и наблюдайте, как уровень воды понижается без какого-либо вмешательства человека.
Таблица сравнения кипения и испарения
Параметры сравнения | Кипячение | Испарение |
| Имея в виду | Кипение – это быстрое и быстрое испарение жидкости, когда она нагревается до точки кипения. | Испарение – это процесс преобразования вещества из жидкой или твердой формы в газообразную. |
| Источник энергии | Для закипания вещества требуется энергия от внешнего источника. | Но испарение может происходить при использовании внутреннего источника. |
| Температура | Для кипячения требуется определенная температура для нагрева вещества, будь то твердое или жидкое. | Испарение не требует определенной температуры и может происходить в любой момент. |
| Время и период | Кипение происходит очень быстро и является быстрым процессом. | Испарение – довольно медленный процесс. |
| Образование пузырей | При кипячении вещества происходит образование пузырей. | При испарении пузырьков не образуется. |
§ 9-1. Кипение жидкости
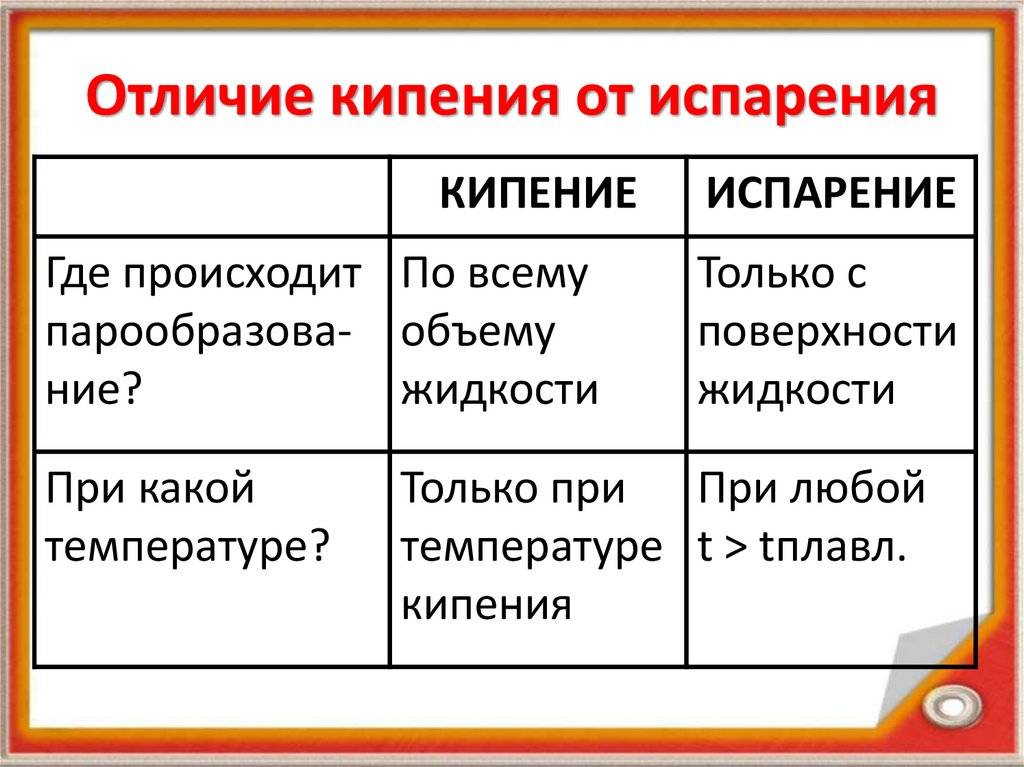
В 8-м классе вы узнали, что у жидкости может быть много значений температуры кипения. Дело в том, что в жидкости всегда имеется растворённый в ней газ, с которым тесно связано кипение (рис. 60.1). Если нагревать на плите сосуд с водой, то у его стенок воздух начнёт выделяться в виде пузырьков. В эти пузырьки испаряется вода, поэтому в них в воздухе находится насыщенный водяной пар. С ростом температуры давление насыщенного пара увеличивается гораздо быстрее, чем давление остального газа. Поэтому можно считать, что давление внутри пузырьков в нагретой жидкости практически равно давлению насыщенного пара. На пузырьки, кроме силы тяжести их содержимого, действуют силы гидростатического давления воды и атмосферного давления воздуха. Однако если сосуд не слишком глубокий, то гидростатическое давление значительно меньше атмосферного и им можно пренебречь.
 Рис. 60.1
Рис. 60.1  Рис. 60.2
Рис. 60.2
С ростом температуры объём пузырьков быстро увеличивается, что влечёт за собой увеличение выталкивающей силы. Когда сила Архимеда, действующая на пузырёк, становится больше силы тяжести его содержимого, он начинает всплывать (рис. 60.2). Достигнув поверхности жидкости, пузырьки лопаются, поскольку давление насыщенного пара, которым они заполнены, немного превышает внешнее давление. Пар выходит наружу — жидкость кипит. Таким образом, жидкость начинает кипеть при такой температуре, при которой давление насыщенного пара равно (точнее, чуть больше) внешнему давлению.
Если понижать давление над поверхностью жидкости, она будет кипеть при более низкой температуре. Так, например, при температуре 20 °C давление насыщенного водяного пара 2,338 кПа. Если, используя насос, понизить давление над поверхностью жидкости до этого значения, то вода закипит при комнатной температуре.
Понижение температуры кипения жидкости при уменьшении внешнего давления используют при работе холодильника. При нормальном атмосферном давлении жидкий фреон кипит при температуре около 30 °С. Уменьшая давление, температуру кипения фреона можно сделать ниже 0 °С. При работе компрессора в испарителе холодильника создаётся пониженное давление, и фреон начинает превращаться в пар, отнимая часть внутренней энергии от стенок камеры.
При увеличении внешнего давления температура кипения жидкости возрастает. Так, например, в кастрюлях-скороварках создаётся давление около 200 кПа, а температура кипения воды при этом достигает 120 °С. В таких условиях продолжительность приготовления пищи существенно сокращается.
Если же воду поместить в герметически закрытый сосуд, во всех частях которого температура одинакова, то она не закипит при нагревании до температуры кипения, равной при нормальном атмосферном давлении 100 °С. Действительно, в этом случае над водой находится её насыщенный пар, давление которого равно давлению внутри пузырьков. А, как отмечалось ранее, кипение жидкости начинается тогда, когда давление насыщенного пара внутри пузырьков хотя бы немного превышает внешнее давление.
Отметим, что жидкость не будет кипеть, если каким-либо образом удалить из неё и со стенок равномерно прогретого сосуда воздух. Например, воду, подготовленную таким образом, можно нагреть выше 100 °С, однако она не закипит. Такую жидкость, температура которой выше температуры её кипения в обычных условиях, называют перегретой.
Перегретую жидкость используют в пузырьковых камерах для визуализации треков заряженных частиц, движущихся со скоростями, близкими к скорости света.
С перегретой жидкостью необходимо обращаться очень осторожно. Любое возмущение (резкое перемещение сосуда, появление источника газа или какого-либо предмета в жидкости) может привести к её немедленному взрывообразному вскипанию

1. Чем отличается кипение от испарения?
2. При каком условии происходит кипение жидкости?
3. Почему температура кипящей при определённом внешнем давлении жидкости остаётся постоянной?
4. Может ли вода кипеть при температуре ниже 100 °С? выше 100 °С?
Роль явления
Испарение и кипение — очень распространённые физические явления, без которых стала бы невозможной нормальная жизнь на земле. Люди ежедневно сталкиваются с ним в быту, а также используют в промышленности, технике, энергетике и других сферах жизнедеятельности. Кроме того, фазовый переход жидкости и газа играет важную роль в существовании живых организмов и экосистеме планеты в целом.
В организме человека, животных и растений
Испарение играет важную роль в процессе саморегуляции температуры тела человека и большинства млекопитающих. Поскольку чрезмерное тепло для них вредно или даже смертельно (при 42,2 °C в крови происходит свёртывание белка, что приводит к быстрой смерти), в процессе эволюции организм разработал систему самоохлаждения — потоотделение. Она задействуется при пребывании в жарких или душных помещениях, тяжёлом физическом труде, болезнях.
Через поры на коже выделяется жидкость, которая затем быстро испаряется. Это позволяет быстро избавиться от лишней энергии и охладить тело, нормализовав температуру. Некоторые животные инстинктивно пытаются усилить этот процесс — например, собаки в жаркую погоду открывают рот и высовывают язык.
Представители флоры обладают похожим защитным механизмом. Чтобы не перегреться на солнце, они запускают процесс испарения ранее поглощённой воды, тем самым охлаждаясь. Поэтому в летнюю пору садоводы усиленно поливают культурные растения, предотвращая их засыхание или выгорание в самые жаркие дни.
В природе и окружающей среде
Роль испарения и конденсации (превращение газа обратно в жидкость) в природе трудно переоценить. Они лежат в основе естественного круговорота воды, который обеспечивает экосистему необходимыми питательными веществами, спасает водоёмы от пересыхания, а животных и растений — от вымирания. Только благодаря этому явлению жизнь на земле может существовать в нынешнем виде.

Испарение большого количества воды с поверхности морей, океанов, рек и озёр приводит к появлению дождевых туч, которые разносят влагу по всему миру и питают окружающую среду. Это же явление препятствует затоплению и заболачиванию участков (особенно зимой, когда тают снега и льды), возвращая лишнюю воду обратно в мировой океан.
Благодаря испарению возможно такое явление, как запахи. Животные используют его во множестве сфер своей жизни — от охоты и поиска пищи до размножения и общения. Оно также помогает представителям фауны распознавать опасность в виде хищников или огня и дыма, обнаруживать токсичные вещества в атмосфере.
В быту и промышленности
Испарение широко применяется в бытовой жизни людей, а также в создании сложных механизмов и промышленных машин. Некоторые примеры использования этого процесса:

- создание охладителей для двигателей, ядерных реакторов, спускаемых аппаратов в космической технике;
- сушка различных вещей — от одежды до производственного сырья;
- запчасти бытовых и промышленных холодильников;
- кондиционирование и очищение воздуха;
- энергетическая промышленность;
- очистка различных веществ на молекулярном уровне;
- охлаждение воды;
- дегидрация продуктов для увеличения срока хранения, создание диетической еды путём вывода лишних веществ;
- готовка на пару в кулинарии;
- стимуляция процессов при химических опытах;
- декор и дизайн одежды — например, сублимационная фотопечать;
- оздоровительные процедуры — бани, криотерапия, косметические техники;
- медицинские ингаляции — приготовление насыщенных полезными веществами газов основано на процессе испарения.
Промышленная техника, использующая испарение для работы, строится по одной и той же схеме. В ней максимально увеличивается площадь поверхности жидкости, чем обеспечивается наилучший теплообмен с газовой средой. Это достигается за счёт разделения воды на отдельные струи и капли, а также образования тонких плёнок вещества на внутренней поверхности и насадках. Газ в приборах разгоняется, что также улучшает эффективность охлаждения.
Общие черты кипения и испарения
- Переход вещества в газовое состояние: и в случае кипения, и в случае испарения происходит переход молекул или атомов вещества в газовое состояние.
- Переход энергии: оба процесса требуют поступления энергии. В случае испарения энергию получают от окружающей среды в форме тепла, а при кипении тепло поступает из источника нагрева.
- Скорость процесса: и кипение, и испарение происходят с различной скоростью, которая зависит от свойств вещества и условий окружающей среды.
- Зависимость от давления: как кипение, так и испарение зависят от давления. При увеличении давления кипение происходит при более высоких температурах, а испарение замедляется.
- Потеря массы вещества: как при кипении, так и при испарении происходит потеря массы вещества, так как часть молекул или атомов переходит в газовую фазу.
Оба процесса, кипение и испарение, играют важную роль в ежедневной жизни человека и во многих сферах науки и промышленности. Знание общих черт и отличий между ними помогает лучше понять их суть и использовать в нужных ситуациях.
Возникают при нагревании вещества
Испарение — это процесс, при котором молекулы жидкости вылетают из ее поверхности и образуют пар. Испарение происходит при любой температуре, но с увеличением температуры скорость испарения увеличивается. Испарение может происходить как на открытой поверхности жидкости, так и внутри ее объема.
Кипение — это процесс, при котором вся жидкость превращается в пар при определенной температуре, которая называется температурой кипения. При кипении молекулы жидкости превращаются в пары внутри жидкости и выделяются в виде пузырьков. Кипение происходит только при достижении определенной температуры и создании определенного давления.
Таким образом, кипение и испарение — это два связанных процесса, которые возникают при нагревании вещества. Испарение происходит при любой температуре, но зависит от увеличения температуры, а кипение происходит только при достижении определенной температуры и давления.
Сопровождаются переходом вещества в газообразное состояние
Испарение происходит при любой температуре и на поверхности вещества. В этом процессе частицы жидкости приобретают достаточную энергию, чтобы преодолеть силы притяжения и переходить в газообразное состояние. Испарение происходит не только при нагревании, но и при охлаждении, при снижении давления и при увеличении поверхности жидкости.
Кипение, в отличие от испарения, происходит только при определенной температуре, называемой температурой кипения. Когда температура жидкости достигает этой точки, всюду в объеме жидкости начинают образовываться пузырьки газа. При этом кипение сопровождается выделением большого количества теплоты, что проявляется в виде плавления льда или нагревания окружающей среды.
Таким образом, оба этих процесса, испарение и кипение, связаны с переходом вещества в газообразное состояние, но имеют различия в температуре, при которой происходят, и условиях, в которых происходят.
Осуществляются за счет преодоления сил притяжения между молекулами
Молекулы вещества всегда взаимодействуют друг с другом силами притяжения. В жидкости эти силы притяжения достаточно сильны, чтобы удерживать молекулы близко друг к другу и поддерживать жидкостную структуру. В то же время, в жидкости всегда присутствуют молекулы с достаточной энергией для преодоления этих сил и перехода в газообразное состояние.
В результате, при повышении температуры, энергия молекул увеличивается, и они начинают двигаться более интенсивно. При достижении определенной энергии, некоторые молекулы смогут преодолеть силы притяжения и перейти в газообразное состояние. Этот процесс называется испарением.
Кипение, с другой стороны, это процесс, при котором вся жидкость превращается в газообразное состояние. Он происходит при определенной температуре, называемой точкой кипения, когда энергия молекул достигает практически общего уровня, что позволяет молекулам одной за другой преодолеть силы притяжения и перейти в газообразное состояние.
Важно отметить, что испарение и кипение являются эндотермическими процессами, требующими поступления энергии от внешних источников, таких как теплота. После испарения и кипения, молекулы газа могут рассеяться и переместиться свободно в пространстве
Таким образом, хотя кипение и испарение представляют собой два различных процесса, они объединяются общим механизмом — преодолением сил притяжения между молекулами вещества. Этот механизм позволяет молекулам переходить из жидкого состояния в газообразное, осуществляясь при повышении температуры и преодолении сил притяжения.
Испарение и кипение: ключевые отличия
Испарение — это процесс превращения жидкости в газ без нагревания. Он осуществляется путем перехода молекул жидкости с поверхности воздушного пространства. При испарении отдельные молекулы приобретают достаточную энергию для преодоления сил притяжения и переходят в газообразное состояние. Ключевой характеристикой испарения является скорость, которая зависит от различных факторов, таких как температура, площадь поверхности, давление и наличие ветра.
Кипение — это процесс превращения жидкости в газ, который происходит при достижении определенной температуры, называемой температурой кипения. В отличие от испарения, при кипении все слои жидкости переходят в газообразное состояние одновременно. Когда жидкость нагревается, молекулы получают дополнительную энергию, позволяющую преодолеть силы притяжения. При достижении температуры кипения, пар начинает образовываться не только на поверхности, но и внутри жидкости
Важно отметить, что температура кипения зависит от давления. При повышении давления, температура кипения увеличивается, а при понижении — уменьшается
Испарение и кипение имеют свои сферы применения. Испарение является процессом охлаждения, который позволяет охладить жидкость за счет потери тепла, например, при испарении пота с поверхности тела человека. Кипение, с другой стороны, часто используется для приготовления пищи, стерилизации инструментов и процессов, связанных с перегонкой веществ.
Таким образом, хотя испарение и кипение являются процессами фазового перехода от жидкости к газу, у них есть значительные отличия. Испарение — это процесс, который происходит без нагревания и зависит от скорости и других факторов. Кипение, в свою очередь, происходит при достижении определенной температуры и зависит от давления. Понимание этих различий поможет лучше использовать эти процессы в различных ситуациях.
Свойства испарения
Экспериментально установлены следующие cвойства испарения:
- При одинаковых условиях различные вещества испаряются с различной скоростью (скорость испарения определяется числом молекул, переходящих в пар с поверхности вещества за 1 с).
- Скорость испарения тем больше:
- чем больше площадь свободной поверхности жидкости;
- чем меньше плотность паров над поверхностью жидкости. Скорость увеличивается при движении окружающего воздуха (ветер);
- чем больше температура жидкости.
- При испарении температура тела понижается.
Механизм испарения можно объяснить с точки зрения MKT: молекулы, находящиеся на поверхности, удерживаются силами притяжения со стороны других молекул вещества. Молекула может вылететь за пределы жидкости лишь тогда, когда ее кинетическая энергия превышает значение той работы, которую необходимо совершить, чтобы преодолеть силы молекулярного притяжения (работа выхода). Поэтому покинуть вещество могут только быстрые молекулы. В результате средняя кинетическая энергия оставшихся молекул уменьшается, а температура жидкости понижается. Для того, чтобы поддерживать температуры испаряющейся жидкости неизменной, к ней необходимо подводить некоторое количество теплоты.
Молекулы пара хаотически движутся. Поэтому некоторые из них могут снова возвратиться в жидкость. Процесс перехода вещества из газообразного состояния в жидкое называется конденсацией.
Число возвратившихся в жидкость за определенный промежуток времени молекул тем больше, чем больше концентрация молекул пара, а следовательно, чем больше давление пара над жидкостью. Конденсация пара сопровождается нагреванием жидкости. При конденсации выделяется такое же количество теплоты, которое было затрачено при испарении.
Кипение жидкостей
Кипение — это парообразование, происходящее одновременно и с поверхности, и по всему объему жидкости. Оно состоит в том, что всплывают и лопаются многочисленные пузырьки, вызывая характерное бурление.
Как показывает опыт, кипение жидкости при заданном внешнем давлении начинается при вполне определенной и не изменяющейся в процессе кипения температуре и может происходить только при подводе энергии извне в результате теплообмена (рис. 3):
\(~Q = L \cdot m,\)
где L — удельная теплота парообразования при температуре кипения.

Рис. 3
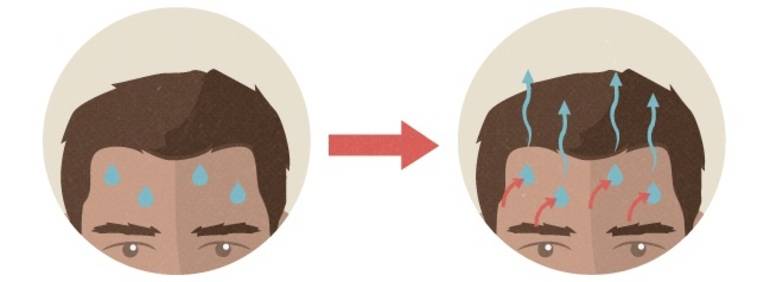
Механизм кипения: в жидкости всегда имеется растворенный газ, степень растворения которого понижается с ростом температуры. Кроме того, на стенках сосуда имеется адсорбированный газ. При нагревании жидкости снизу (рис. 4) газ начинает выделяться в виде пузырьков у стенок сосуда. В эти пузырьки происходит испарение жидкости. Поэтому в них, кроме воздуха, находится насыщенный пар, давление которого с ростом температуры быстро увеличивается, и пузырьки растут в объеме, а следовательно, увеличиваются действующие на них силы Архимеда. Когда выталкивающая сила станет больше силы тяжести пузырька, он начинает всплывать. Но пока жидкость не будет равномерно прогрета, по мере всплытия объем пузырька уменьшается (давление насыщенного пара уменьшается с понижением температуры) и, не достигнув свободной поверхности, пузырьки исчезают (захлопываются) (рис. 4, а), вот почему мы слышим характерный шум перед закипанием. Когда температура жидкости выравняется, объем пузырька при подъеме будет возрастать, так как давление насыщенного пара не изменяется, а внешнее давление на пузырек, представляющее собой сумму гидростатического давления жидкости, находящейся над пузырьком, и атмосферного, уменьшается. Пузырек достигает свободной поверхности жидкости, лопается, и насыщенный пар выходит наружу (рис. 4, б) — жидкость закипает. Давление насыщенного пара при этом в пузырьках практически равно внешнему давлению.
Рис. 4
Температура, при которой давление насыщенного пара жидкости равно внешнему давлению на ее свободную поверхность, называется температурой кипения жидкости.
Так как давление насыщенного пара увеличивается с ростом температуры, а при кипении оно должно быть равно внешнему, то при увеличении внешнего давления температура кипения увеличивается.
Температура кипения зависит также от наличия примесей, обычно увеличиваясь с ростом концентрации примесей.
Если предварительно освободить жидкость от растворенного в ней газа, то ее можно перегреть, т.е. нагреть выше температуры кипения. Это неустойчивое состояние жидкости. Достаточно небольших сотрясений и жидкость закипает, а ее температура сразу понижается до температуры кипения.