Содержание
Слайд 1
Слайд 2
Цель:рассказать о структуре твёрдого тела.
Ход исследования:
1)Кристалл.
2)Монокристалл.3)Как вырастить кристалл?4)Применение кристаллов.5)Ответ на гипотезу,выводы.6)Ответ на основополагающий вопрос проекта.
Слайд 3
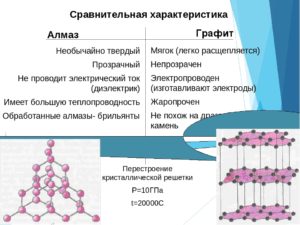
Графит – минерал из класса самородных элементов , относительно мягкий(1-2 по шкале Мооса).Чистый графит состоит из углерода(С).Горит при высоких температурах. Графит слоистый , легко расслаивается . Проводит ток. Используется в производстве грифелей для карандашей и электродов.
Алмаз – один из твердейших минералов(10 по шкале Мооса),но в то же время хрупкий. Полностью состоит из углерода .Не проводит электричество .Горит при высоких температурах. Алмазы после огранки используются как украшения , искусственные алмазы используются как абразив и применяются для изготовления свёрл ,лезвий.
Слайд 4
Почему , несмотря на то, что графит и алмаз состоят из одного и того же вещества, имеют разные свойства?
Слайд 5
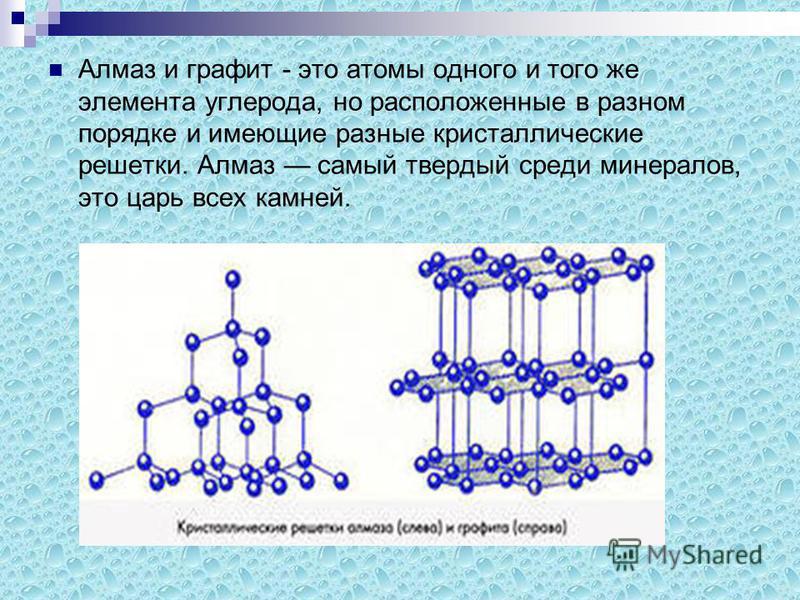
Так как графит и алмаз не отличаются по составу , значит они отличаются по внутренней структуре. А так как графит и алмаз – твёрдые тела , значит они различаются в порядке расположения молекул.
Слайд 6
Рассмотрим графит:графит –твёрдое вещество, значит атомы в нём упорядочены, как и в алмазе. Надломим кусок графита и рассмотрим место надлома в лупу или микроскоп. Можно увидеть мелкие частицы. Это кристаллы, из которых состоят многие твёрдые вещества, такие как лёд, железо и другие твёрдые тела. Графит-это поликристалл, тоесть кристалл, который состоит из множества других кристаллов(в отношении графита- из миллионов других кристаллов)
Слайд 7
Кристаллы — это твёрдые вещества, имеющие естественную внешнюю форму правильных симметричных многогранников, основанную на их внутренней структуре, то есть на одном из нескольких определённых регулярных расположений составляющих вещество частиц(атомов, молекул)
Слайд 8
Если рассмотреть алмаз, то его поверхность, будет гладкой, разве что с небольшими шероховатостями. Алмаз-это монокристалл- однородный отдельный кристалл. Монокристаллы обычно называют просто кристаллам. В природе можно встретить друзы- особый вид поликристаллов, которые образуются в природных условиях.
Слайд 9
Если рассмотреть графит и алмаз в электронном микроскопе, то можно увидеть, что и молекулярная структура этих тел отличается. Основой молекулярной структуры у графита является шестиугольник, образованный молекулами углерода. Эти шестиугольники собираются в пласты, которые легко отделяются друг от друга. В алмазе молекула гораздо сложнее, и она соединена с большим количеством атомов, что гарантирует большую прочность.
Слайд 10
Твёрдые тела отличаются друг от друга: веществом из которого сделано вещество, молекулярной структурой и типом кристаллизации.
Слайд 11
Драгоценные кристаллы, такие как алмазы, сапфиры, рубины, изумруды обрабатываются и используются как украшения. Так же кристаллы иногда используются в производстве лазеров, например в первом лазере использовался кристалл рубина.
Слайд 12
Кристаллы можно выращивать, даже у себя дома. Для этого нужна вода, вещество для кристалла и ёмкость
Лучше брать воду дистиллированную, а в роли вещества брать соли, такие как пищевую(NaCl) или медный купорос(медный купорос опасен при неосторожном обращении, но кристаллы из него получаются большие)
1)Налить в воду ёмкость, добавлять в воду соль и растворять её до того момента, пока на дне не появится осадок.2)Разогреть раствор до 90 градусов(не доводить до кипения)и продолжать добавлять в раствор соль, пока не появится осадок.3)Пропустить раствор через марлю получившийся раствор в другую ёмкость.4)Опустить в раствор затравку(это небольшой кристалл соли)Затравку можно сделать, опустив на дно ёмкости несколько кристалликов соли, и через день на дне ёмкости образуются кристаллы, которые можно использовать как затравку.5)Через несколько дней затравка будет увеличиваться в размерах. Каждую неделю следует делать новый раствор и опускать туда кристалл
Через месяц кристалл(например, медного купороса)сильно увеличится в размерах. Трогать руками не следует, так как жир на руках может остаться на кристалле, мешая росту. Готовый кристалл нужно покрыть лаком, иначе он со временем начнёт выветриваться.
Слайд 13
Слайд 14
Слайд 15
Слайд 16
Слайд 17
Слайд 18
Посмотреть все слайды
Как и где находят углеродные минералы
Сходство элементарного химического состава не обуславливает схожие свойства веществ. Различия объясняются сложностями происхождения двух разных углеродных пород. Алмазы образуются под действием сильного давления после сверхбыстрого охлаждения. А если атмосферное давление занижено, то при довольно высокой температуре образуется графит.
Подтверждением того, что алмаз и графит образовались не одинаково, служит их нахождение в природе. Около 80% всех бриллиантов добывают в кимберлитовых трубках – глубоких воронках, образованных магмой, вышедшей после взрыва и выхода наружу подземного газа.
Графитовых же месторождений много в осадочных породах и пластах, образованных магмой.
Применение алмаза и графита
Оба минерала широко используются в промышленности.
Алмазы применяют:
- в электротехнике;
- приборостроении;
- радиоэлектронике;
- на буровых установках
- в ювелирном деле.
Графит используется при:
- производстве тиглей и иного огнеупорного оборудования;
- изготовлении смазочных материалов;
- изготовлении карандашей;
- производстве оборудования для электроугольной промышленности.
Несмотря на разнообразие применения как графита, так и алмаза в различных отраслях промышленности, можно смело говорить о большей пользе графита. Алмаз по причине идеальности своей кристаллической решетки инертен. Его можно использовать только как алмаз. Большая часть добываемых в природе алмазов уходит на нужды ювелирной промышленности, поскольку минерал является одним из самых дорогих драгоценных камней, становясь бриллиантом, он стимулирует оборот денег, и это его основное свойство в экономике.
Графит, изъятый из природы, становится не самодостаточной ценностью, а великим тружеником производства. Благодаря своим свойствам он используется и в своем истинном, природном виде, то есть как графит, и в качестве средства, на основе которого могут быть получены новые вещества, например, тот же алмаз.
Введение
Алмазная промышленность нашей страны находится в стадии развития, внедрения новых технологий обработки минералов.
Найденные месторождения алмазов вскрываются лишь процессами эрозии. Для разведчика это означает, что существует множество «слепых» месторождений, не выходящих на поверхность. Об их присутствии можно узнать по обнаруженным локальным магнитным аномалиям, верхняя кромка которых располагается на глубине в сотни, а если повезет – то в десятки метров. (А. Портнов).
Исходя из вышесказанного, я могу судить о перспективности развития алмазной промышленности. Именно поэтому я выбрала тему – «Алмаз и графит: свойства, происхождение и значение».
В своей работе я попыталась проанализировать связь между графитом и алмазом. Для этого сравнила эти вещества с нескольких точек зрения. Я рассмотрела общую характеристику данных минералов, промышленные типы их месторождений, природные и технические типы, разработку месторождений, области применения, значение данных минералов.
Несмотря на то, что графит и алмаз полярные по своим свойствам, они являются полиморфными модификациями одного и того же химического элемента — углерода. Полиморфные модификации, или полиморфы — это вещества, которые имеют одинаковый химический состав, но различную кристаллическую структуру. С началом синтеза искусственных алмазов резко возрос интерес к исследованию и поискам полиморфных модификаций углерода. В настоящее время, кроме алмаза и графита, достоверно установленными можно считать лонсдейлит и чаотит. Первый во всех случаях был найден только в тесном взаимопрорастании с алмазом и поэтому называется еще гексагональным алмазом, а второй встречается в виде пластинок, чередующихся с графитом, но расположенных перпендикулярно его плоскости.
Полиморфные модификации углерода: алмаз и графит
Единственный минералообразующий элемент алмаза и графита — это углерод. Углерод (С) — химический элемент IV группы периодической системы химических элементов Д.И.Менделеева, атомный номер – 6, относительная атомная масса — 12,011(1). Углерод устойчив в кислотах и щелочах, окисляется только дихроматом калия или натрия, хлористым железом или алюминием. Углерод имеет два стабильных изотопа С(99,89%) и С(0,11%). Данные изотопного состава углерода показывают, что он бывает разного происхождения: биогенного, небиогенного и метеоритного. Многообразие соединений углерода, объясняющееся способностью его атомов соединяться друг с другом и атомами других элементов различными способами, обусловливает особое положение углерода среди других элементов.
Элементы: Углерод – самый аллотропный элемент
Дата: 17.04.2019
Имя первооткрывателя углерода неизвестно, как и тот факт, какая из форм углерода – алмаз или графит – была открыта раньше. Известно точно, что эти формы элемента № 6 Таблицы Менделеева человек узнал в доисторические времена. Углерод обозначается символом C (лат. carboneum – рождающий уголь), расположен в 14 группе Периодической системы. Три изотопа этого элемента встречаются в природе: 12C и 13C – стабильны, 14C- радиоактивный, с периодом полураспада 5730 лет. Название «углерод» (фр. carbone) появилось в конце 18 века и фигурирует в «Элементарном учебнике химии» французского химика Антуана Лавуазье. Очень популярные среди естествоиспытателей 18 века опыты по сжиганию различных минералов, включая алмазы, показали, что при сильном нагревании сгорает без остатка лишь алмаз. Лавуазье одним из первых пришёл к выводу, что алмаз представляет собой кристаллический углерод. Второй аллотроп углерода — графит — долгое время считался видоизменённым свинцовым блеском и назывался plumbago
И только в конце 18 века французский химик Гитон де Морво путём осторожного нагревания превратил алмаз в графит, а затем в угольную кислоту.

Кристалл алмаза (6 мм) с включением граната. Якутия. Образец ИГЕМ РАН
Понятие аллотропии (от др.-греч. ἄλλος «другой» + τρόπος «поворот»), как существование двух и более простых веществ одного и того же химического элемента, различных по строению и свойствам, введено в науку шведским минералогом Якобом Берцелиусом в 1841 году. Д. И. Менделеев первым предположил, что разница в свойствах между алмазом и графитом объясняется различным строением молекул углерода.

Образец графита из Канады, 12 см. Национальный музей естественной истории, г. Вашингтон
Он писал: «Способность атомов углерода соединяться между собой и давать сложные молекулы проявляется во всех углеродистых соединениях… Ни в одном из элементов такая способность к усложнению не развита в такой мере, как в углероде». Только в начале 20 века было признано, что различия в кристаллической структуре простых веществ углерода или фосфора являются причиной аллотропии. Среди химических элементов углерод лидирует по количеству аллотропных модификаций, в настоящее время их известно более 10. Аллотропные модификации углерода по своим свойствам наиболее радикально отличаются друг от друга, от мягкого к твёрдому, непрозрачного к прозрачному, абразивного к смазочному, недорогого к дорогому. Эти аллотропы включают аморфные аллотропы – уголь, сажа, нанопена; кристаллические аллотропы — нанотрубка, алмаз, фуллерены, графит, лонсдейлит.
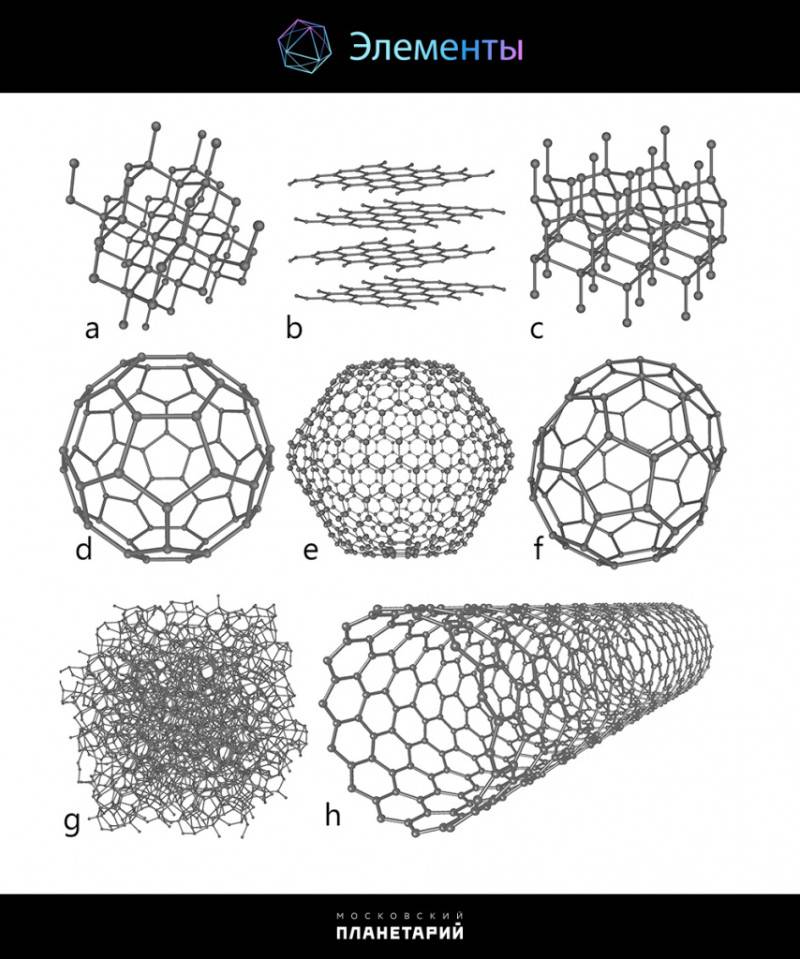
Аллотропы углерода: a – алмаз, b – графит, с – лонсдейлит, d – C60, e – C540, f – C70, g – аморфный углерод, h – углеродная нанотрубка.
Самый известный аллотроп углерода, алмаз, редкий, но довольно распространённый минерал, так как промышленные месторождения алмазов открыты на всех континентах, кроме Антарктиды. Российская компания «АЛРОСА» в 2017 году являлась лидером по объему добытых алмазов, с показателем в 39,6 млн каратов, и занимала второе место в стоимостном выражении, продав алмазов на $4,2 млрд. Анализ мощностей действующих месторождений позволяет предположить, что в долгосрочной перспективе на мировом рынке будет наблюдаться превышение спроса над предложением.
Применение
Применение как алмаза, так и графита намного шире, чем кажется. Для алмаза можно выделить несколько сфер использования.
В ювелирной промышленности алмазы используют только в огранке, как известно, они носят название бриллиантов. Всего 20 % всех добытых камней пригодны для украшений, а минералов высокого качества и куда меньше.
Бриллианты — самые дорогие в мире камни. По стоимости только некоторые экземпляры рубинов могут сравниться с ними. На стоимость минералов влияют огранка, цвет, оттенок и чистота. Обычно некоторые из этих характеристик невооруженным глазом являются незаметными, однако выявляются при экспертизе.
Использование бриллиантов в украшениях очень распространено. Часто они выступаю как единственный камень или дополняют высококачественные сапфиры, рубины, изумруды. Наиболее частое применение камней — кольца для помолвки.
В технической сфере обычно берут второсортное сырье, с дефектами или с различными оттенками. Технические алмазы разделяются на несколько подкатегорий.
- алмазы определенной формы, которая годится для изготовления подшипников, наконечников сверл и так далее;
- необработанные камни;
- камушки с дефектами, применяемые только для изготовления алмазной крошки и порошка.
Последние применяются либо в очень маленьких деталях, либо в качестве напыления для изготовления режущего и шлифовального инструмента.
В электронике применяются иглы, которые являют собой необработанные кристаллы, имеющие от природы острую вершину, или осколки с такой же вершиной. Буровые установки в промышленности также содержат алмазы. Прослойки из этого минерала используются в микросхемах, счетчиках и так далее, происходит это благодаря высокому коэффициенту теплопроводности и сопротивлению.
Около 60 % всех технических алмазов используется в инструментах. Остальные 40 % в равных количествах:
- при бурении скважин;
- переработке;
- в мелких деталях ювелирных изделий;
- в шлифовальных кругах.
В чистом виде графит не используется. Его, как правило, обрабатывают. Графит высочайшего качества применяется в виде стержня для карандаша. Наиболее широкое применение графит находит в литье. Здесь он применяется для обеспечения гладкой поверхности стали. Для этого он используется в необработанном виде.
В электроугольной промышленности используют не только природного происхождения минерал, но и созданный. Последний имеет высокую однородность по качеству и чистоте. Высокая проводимость тока делает его также широко используемым для изготовления электродов в приборах. Кроме того, он применяется в качестве щеток для двигателя. В металлургии графит используют как смазочный материал.
Графитовые стержни за свою способность замедлять нейтроны раньше широко использовались при создании атомных реакторов. В частности, именно боровые стержни с графитовыми наконечниками выступали в качестве стержней управления-защиты на Чернобыльской АЭС. Одна из проблем, которая после привела к аварии, была в том, что для гашения цепной реакции нужно было нейтроны поглощать, за что отвечал бор, а не замедлять. Поэтому в момент, когда стержни опустили в активную зону реактора, его энергия возросла скачком, что привело к перегреву. Но это была всего лишь одна из множества причин.
Таким образом, алмаз и графит — два разных минерала с одинаковым элементом в основе. Их структуры делают свойства разными, что и представляет интерес. Каждый из них по-своему красив и имеет очень широкое применение как в очень сложных конструкциях, так и в предметах повседневности.
Физические и химические особенности
Алмаз — прозрачный минерал, форма — кристаллическая. Встречаются алмазы, окрашенные в красный, голубой и черный цвета. Ограненный алмаз становится бриллиантом, стоимость его повышается, но на свойствах вещества это не отражается.
 Связь «искусственный алмаз — графит»
Связь «искусственный алмаз — графит»
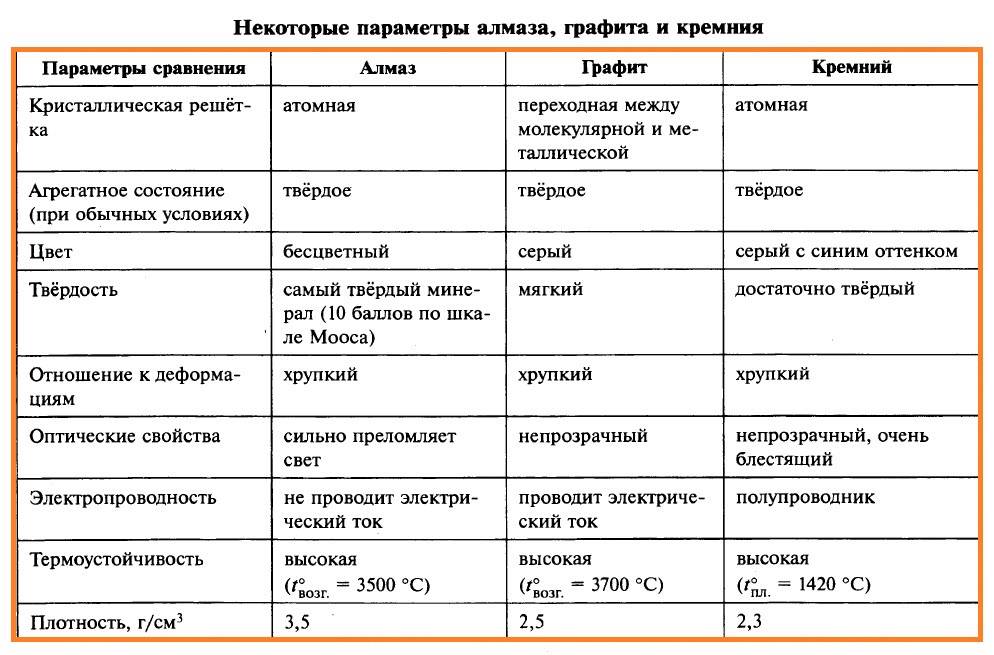
Минерал является аллотропной модификацией углерода. По шкале твердости Мооса он занимает 10 позицию и потому считается самым твердым из всех минералов. В этом отличие между алмазом и графитом, несмотря на то что они могут являться производными друг друга.
Алмаз лучше других минералов отражает и преломляет свет. Плотность минерала равняется 3,4-3,5 г/см3. Способность проводить тепло колеблется на уровне 2300 Вт. Коэффициент трения по металлу равняется 0,1, что объясняется наличием у алмаза пленки из адсорбированного газа. Температура плавления алмаза — 4000 градусов Цельсия, при этом он должен подвергаться давлению в 11 ГПа.
Процесс горения минерала начинается при достижении температуры воздуха в 800-1000 градусов. При участии в реакции горения чистого кислорода, алмаз воспламеняется подобно пропану. В процессе горения возникает голубое пламя.
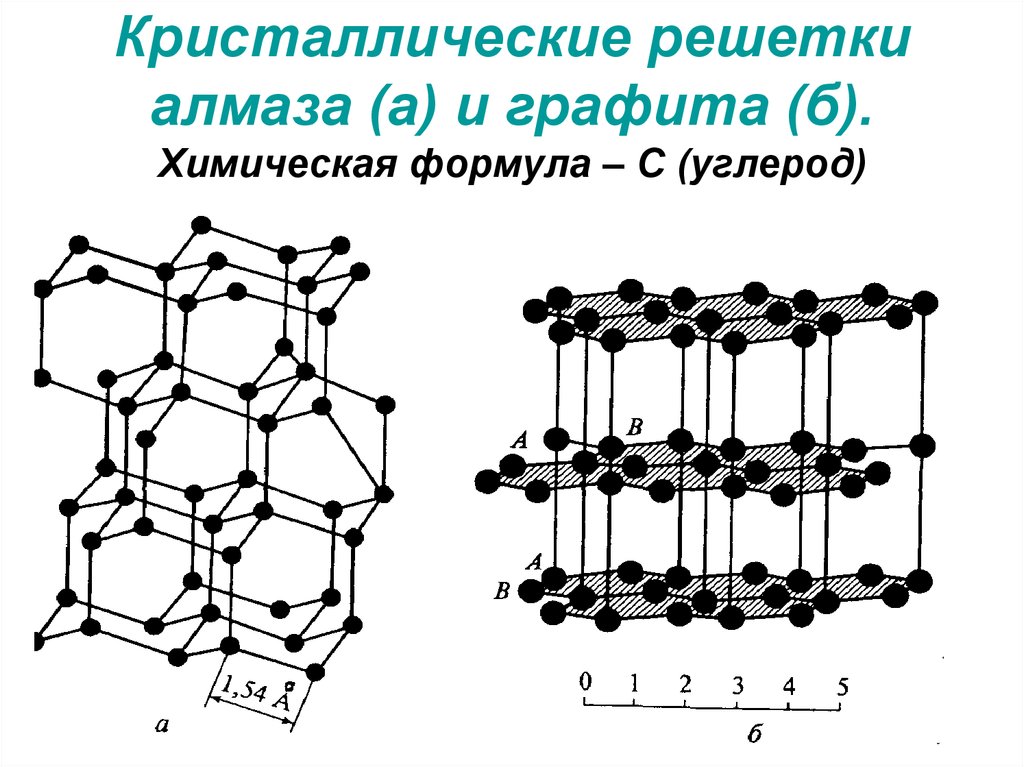
Атомы и молекулы кристаллической решетки алмаза соединены между собой прочными объемными связями, образуя правильный тетраэдр. Каждый атом в таком тетраэдре находится в окружении других атомов, образующих верхушку тетраэдров, расположенных рядом. Таким образом, каждый из тетраэдров является частью всех тетраэдров, что обуславливает твердость и неразрушимость алмаза. Алмаз и графит имеют разное строение решетки.
В отличие от алмаза графит не является кристаллом. Минерал представляет собой набор пластинок черного с серым отливом цвета. Облик минерала напоминает сталь. Графитизация графита происходит в металлических сплавах, содержащих нестойкие карбиды углерода. При контакте с графитом ощущается наличие жира, но сам он мягкий, легко крошится, оставляя черные пятна.
Минерал является проводником тепла и электричества. Являясь полиморфной модификацией углерода, он во многом схож по своему химическому составу с алмазом. Отличительная особенность — строение молекулярной решетки. Решетка графита плоская. Все атомы графита располагаются в одной плоскости, представленной рядом шестиугольников, имеющих слабые связи между собой. Такое строение решетки делает минерал мягким и слоистым, что позволяет применять его в различных областях деятельности.
Кроме того, такое строение решетки делает возможным процесс превращения графита в алмаз. Естественно, что для такого превращения требуются условия, такие, как температура и давление воздуха. Процесс может быть обратным: переход алмаза в графит происходит в ходе термального воздействия и давления.
Свойства алмаза и графита

Коротко об аллотропном углероде и карбине. В периодической таблице Менделеева этот тип неметалла расположен под номером 6. Валентное состояние углерода коренным образом влияет на свойства вещества, в котором он присутствует.
Несмотря на то, что алмаз от графита отличается по всем характеристикам, оба минерала построены из свободного углерода.
Химические свойства
Структура кристалла алмаза пространственная. Алмаз и графит – это прочно связанные между собой тетраэдры, внутри которых атомы с ковалентной связью удалены друг от друга на равные расстояния. Доля углерода приближается к 99,8%. Незначительные примеси влияют на «чистоту» и оттенок самородка. Известно о химической стойкости к воздействию кислот и щелочей.
Важно помнить о том, что при высокой температуре сжигания от 800 до 1000 градусов на воздухе молекулы алмаза превращаются в кучку графита. Сущность кристаллической решетки графита состоит из слоев
Отдельные слои выглядят как связанные между собой шестиугольники, похожие на пчелиные соты. Расположение слоев относительно друг друга не структурированное и может различаться в самородках. Атомы связаны прочно только в пределах одного пласта. Соседние слои жестких связей между атомами не имеют. Содержат различные включения. Графит не растворяется в кислотах. При высокой температуре сгорает до аморфного газа, взаимодействуя с кислородом. Щелочные металлы и соли могут образовывать с ним «соединения включения»
Сущность кристаллической решетки графита состоит из слоев. Отдельные слои выглядят как связанные между собой шестиугольники, похожие на пчелиные соты. Расположение слоев относительно друг друга не структурированное и может различаться в самородках. Атомы связаны прочно только в пределах одного пласта. Соседние слои жестких связей между атомами не имеют. Содержат различные включения. Графит не растворяется в кислотах. При высокой температуре сгорает до аморфного газа, взаимодействуя с кислородом. Щелочные металлы и соли могут образовывать с ним «соединения включения».
Физические свойства

Различие в строении алмаза и графита обуславливает и разные физические свойства:
- Твердость. Алмаз – это самый твердый и плотный из созданных природой минералов. Он обладает минимальным коэффициентом сжатия. Графит имеет мягкую структуру, на ощупь жирный. Несмотря на разное значение плотности, оба они хрупкие и рассыпаются при падении или ударе.
- Прозрачность. Непрозрачный, серый или темно-серый графит поглощает свет. При трении отслаивается и оставляет темные следы на поверхности. Металлические включения дают самородку блеск. Строение кристаллов в алмазе дает прозрачность. Природные самоцветы не всегда абсолютно прозрачные и бесцветные. Некоторые имеют цветной оттенок. Мутные кристаллы ценятся ниже.
- Теплопроводность. Алмаз обладает самым высоким показателем, в сравнении с другими твердыми телами. Отличный полупроводник, способный работать при высоких температурах. У графита этот показатель теплопроводности крайне низкий.
- Электропроводность. Если замерять этот параметр вдоль слоев графита, результат окажется довольно высоким, приближенным к металлу. Поперек плоскостей он в сотни раз меньше, а самый высокий – у рекристаллизованного графита. Алмаз не проводит электричество, он – диэлектрик.
Отличие графита от алмаза, особенности строения и процесс перехода одного минерала в другой
Алмаз и графит – аллотропные по отношению друг к другу минералы, то есть имеют различные свойства, но являются разными формами углерода. Их основное отличие заключается лишь в химическом строении кристаллической решетки.
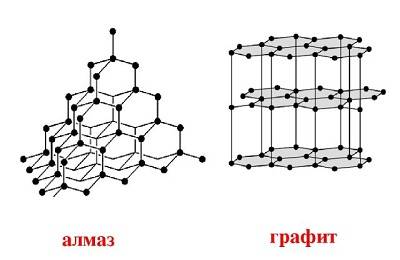 Кристаллическая решетка алмаза имеет вид тэтраэдра, в котором каждый атом окружен еще 4 атомами и является вершиной соседнего тэтраэдра, образуя бесконечное множество атомов, имеющих прочные ковалентные связи.
Кристаллическая решетка алмаза имеет вид тэтраэдра, в котором каждый атом окружен еще 4 атомами и является вершиной соседнего тэтраэдра, образуя бесконечное множество атомов, имеющих прочные ковалентные связи.
Графит на атомном уровне состоит из пластов шестиугольников с вершинами-атомами. Атомы хорошо связаны между собой только на уровне пластов, но пласты между собой сильной связи не имеют, что делает графит мягким и нестойким к разрушению. Именно эта особенность и позволяет получить из графита алмаз.
Физические и химические свойства алмаза и графита хорошо видны из таблицы.
| Характеристика | ||
|---|---|---|
| Строение атомной решетки | Кубическая форма | Гексагональная |
| Светопроводимость | Хорошо проводит свет | Не пропускает свет |
| Электропроводимость | Не обладает | Имеет хорошую электропроводимость |
| Связи атомов | Пространственные | Плоскостные |
| Структура | Твердость и хрупкость | Слоистость |
| Максимальная температура, при которой минерал остается неизменным | 720 по Цельсию | 3700 по Цельсию |
| Цвет | Белый, голубой, черный, желтый, бесцветный | Черный, серый, стальной |
| Плотность | 3560 кг/м.куб. | 2230 кг/м.куб. |
| Использование | Ювелирное дело, промышленность | Литейное производство, электроугольная промышленность. |
| Твердость по шкале Мооса | 10 | 1 |
Химическая формула алмаза и графита одна и та же – углерод (С), но процесс создания в природе разный.
Алмаз возникает при очень высоких давлениях и мгновенном охлаждении, а графит, наоборот, при низком давлении и высокой температуре.
Выделяют следующие методы получения алмазов:

Процесс алмаза в графит аналогичен. Разница лишь в показателях давления и температуры.
Месторождение минералов
Алмазы пролегают на глубинах более 100 км при температуре 1300 ̊С. От взрывной волны вступает в действие кимберлитовая магма, образуя так называемые кимберлитовые трубки, которые и являются коренными месторождениями алмазов.
 Кимберлитовая трубка названа в честь африканской провинции Кимберли, где она и была впервые открыта. Породы с алмазными залежами называют кимберлитами.
Кимберлитовая трубка названа в честь африканской провинции Кимберли, где она и была впервые открыта. Породы с алмазными залежами называют кимберлитами.
Самые известные ныне месторождения находятся в Индии, Южной Африке и в России.
На коренных месторождениях, состоящих из кимберлитовых и лампроитовых трубок, добывают до 80% всех алмазов.
Найти алмазы в добытой породе помогают рентгеновские лучи. Большинство найденных камней используется в промышленности, так как не обладают достаточными характеристиками для ювелирной области. Промышленные камни разделяют на 3 вида:
- борт – мелкие камни, имеющие зернистую структуру;
- баллас – камни круглой или грушевидной формы;
- карбонадо – камень черного цвета, получивший свое название из-за сходства с углем.
 Любопытно, что наиболее крупные и выдающиеся по характеристикам алмазы получают свое уникальное название. Самые известные из них – «Шах», «Звезда Минаса», «Кохинур», «Звезда Юга», «Президент Варгас», «Минас-Жерайс», «Английский алмаз Дрездена» и др.
Любопытно, что наиболее крупные и выдающиеся по характеристикам алмазы получают свое уникальное название. Самые известные из них – «Шах», «Звезда Минаса», «Кохинур», «Звезда Юга», «Президент Варгас», «Минас-Жерайс», «Английский алмаз Дрездена» и др.
Графит образуется в результате видоизменения осадочных пород. Мексиканские, ногинские и мадагаскарские графитовые месторождения богаты рудой с графитом низкого качества. Менее распространенные – ботогольский и цейлонский тип, отличаются рудой, богатой высоким содержанием графита. Крупнейшие известные месторождения находятся на Украине и в Краснодарском крае.
Физические и химические свойства
Алмаз не обладает электропроводностью, но тепло проводит. Хорошо преломляет и отражает свет. Прозрачен, имеет блеск. Плавится при 3700-4000 градусов. Лавуазье впервые сжег диамант в 18 веке.
Позже ученые выяснили, что в соединении с кислородом алмаз горит при 721-800 градусах, испаряясь углекислым газом. Без воздуха может перейти в графит при нагреве до 2001-3000 градусов. Химические свойства говорят об устойчивости к воздействию кислот.
Графит электро-и-теплопроводный, нерастворим кислотами и водой, теплостойкий. Температура плавления 2500 – 3000 градусов. Не горит до 250-300 градусов, но при сжигании с температурой выше 300 и до 1000 превращается в углекислый газ.
Области применения
Алмаз является самым твердым из всех минералов. Он режет стекло, дерево, металл, предметы, изготовленные из веществ, уступающих алмазу по твердости. Подобная способность расширяет области применения алмазов, ранее ограничивающиеся исключительно ювелирным делом.
Графит – мягкий минерал, но именно это делает его незаменимым в промышленности, архитектуре и даже искусстве.
Алмаз
Вплоть до середины прошлого столетия алмазы использовались исключительно в качестве украшения. Камни подвергались обработке, использовались в качестве замены деньгам. Необходимо отметить, что первые попытки придать алмазу форму не имели успеха. Твердость минерала не позволяла использовать для его обработки предметы, изготовленные из металла, камня, дерева. В процессе исследований удалось выяснить, что огранку алмаза нужно проводить таким же прочным веществом, то есть самим алмазом. Такого рода открытие навело на мысль о возможности применения алмазов в других областях.
На сегодняшний день алмазам находят применение в:
Строительстве. Создание алмазных буров упростило работу с конструкциями из бетона и стали
Алмазы являются важной деталью сверл, инструментов для резки и демонтажа. Использование минералов исключает появление трещин, что особо важно при прокладке тоннелей, подведении труб, строительстве зданий
Алмазные сверла и пилы режут бетон, сталь, гранит, мрамор, перемалывает щебень. В этой области алмаз и графит не сравнимы, но опять же взаимосвязаны.
Приборостроении. Многие приборы содержат в себе частичку алмазной пыли либо цельные алмазы.
Машиностроительных областях. При обтачивании металлических инструментов чаще всего используются алмазы.
Космической области. Создание точных телескопов невозможно без использования алмазных деталей.
Хирургии. Основным инструментом хирурга является скальпель, толщина и острота которого во многом определяет успех операции. Алмазные скальпели как нельзя лучше справляются с этой задачей. Особого внимания заслуживают разрабатываемые лазеры на кристаллах, проводящим веществом которых выступает алмаз.
Телекоммуникациях и электронике. Чтобы сигналы разных частот могли проходить по одному кабелю, также используются алмазы. Применение их в этой области связано со способностью выдерживать большие температуры и скачки напряжения.
Науке. Минерал нейтрализует воздействие агрессивной среды, потому его используют как защитный элемент. Алмаз является составной частью опытов, проводимых в таких областях, как квантовая физика, оптика, создание лазеров.
Добыче полезных ископаемых. Приборы, основной деталью которых является алмаз, используются при бурении шахт, добыче нефти, угля и газа.
В промышленных целях используют алмазы, выращенные исключительно синтетическим образом. Настоящие камни используются крайне редко, несмотря на то, что графит и алмаз встречаются в природе.
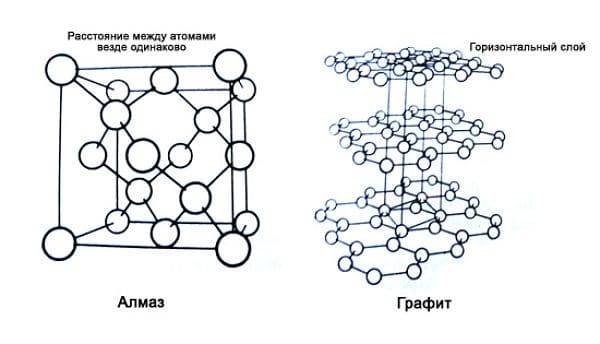
Структура алмаза и графита
И алмаз, и графит – это разные формы одного и того же элемента – углерода. У мягкого, крошащегося графита и у самого твердого кристалла в мире одна и та же формула – С. Как такое возможно?
Сфера применения
Алмаз и графит используют гораздо шире, чем может показаться на первый взгляд. Алмазы нашли свое применение в следующих сферах:

В процентном соотношении использования алмазов выглядит так:
- Инструменты, машинные детали – 60%.
- Обрамление шлифовочных кругов -10%.
- Переработка проволоки-10%.
- Бурение скважин – 10%.
- Ювелирные изделия, мелкие детали – 10%.
 Что касается графита, то в чистом виде он практически не используется, а подвергаются предварительной обработке, хотя в разных сферах используется графит разного качества. Для канцелярских карандашей используют графит высочайшего качества. Наиболее широкое применение нашло в литейном производстве, обеспечивая гладкую поверхность различных форм стали. Здесь используется практически необработанный графит.
Что касается графита, то в чистом виде он практически не используется, а подвергаются предварительной обработке, хотя в разных сферах используется графит разного качества. Для канцелярских карандашей используют графит высочайшего качества. Наиболее широкое применение нашло в литейном производстве, обеспечивая гладкую поверхность различных форм стали. Здесь используется практически необработанный графит.
Электроугольная промышленность наряду с природным использует искусственно созданный графит, также получивший широкое применение благодаря особой чистоте и постоянству состава. Электропроводимость сделала графит материалом для электродов электрических приборов. В металлургии используется как смазочный материал.
Алмаз же, призванный радовать своей красотой, неоценим для экономики, принося огромные доходы от применения в ювелирной промышленности.
Всем известны такие вещества, как графит и алмаз. Графит встречается повсюду. Например, из него делают стержни для простых карандашей. Графит – это вещество вполне доступное и дешевое. Но такое вещество, как алмаз, крайне отличается от графита. Алмаз – это самый дорогой камень, очень редкий и прозрачный, в отличие от графита. В это трудно поверить, но химическая формула графита совпадает с формулой алмаза. В данной статье мы разберем, как такое возможно.
Получение алмаза из графита
Долгое время получить алмаз было технологически сложно, но к сегодняшнему дню эта не такая и трудная задача. Основной проблемой является повторение процессов в лаборатории в короткий промежуток времени, которые в природе проходят за миллионы лет. Ученые доказали, что условиями перехода алмаза из графита являлась высокая температура и давление.
Впервые такие условия были получены с помощью взрыва. Взрыв является химическим процессом, который представляет собой горение при высокой температуре и скорости. После этого собрали остатки графита, и оказалось, что внутри его образовались маленькие алмазы. То есть превращение произошло только фрагментарно. Причиной этого является разброс параметров внутри самого взрыва. Там, где условия были достаточными для такого превращения, оно и произошло.
Натуральный необработанный алмаз
Такие параметры сделали взрывы малоперспективными для получения алмаза. Однако опыты не прекратились, на протяжении длительного времени ученые продолжали проводить их, чтобы каким-то образом получить этот минерал. Более-менее стабильный результат получился, когда графит попытались нагреть импульсно до температуры в две тысячи градусов. В этом случае удалось получить алмазы приличных размеров.
Однако такие опыты дали еще один неожиданный результат. После превращения графита в алмаз происходил обратный переход алмаза в графит при уменьшении давления, то есть происходила графитизация. Таким образом, получение стабильного результата только с помощью одного давления достичь не удавалось. Тогда вместе с увеличением давления начали нагревать графит. Спустя некоторое время, удалось вычислить диапазон давлений и температур, при которых кристаллы алмаза можно было бы получать. Однако эти методы все еще не позволяли получить минерал ювелирного качества.
Для того чтобы получить камни, пригодные для создания украшений, начали выращивать алмазы с помощью применения затравки. В качестве ее использовали готовый кристалл алмаза, который нагревали до температуры 1500 градусов, что стимулировало сначала быстрый, а потом медленный рост. Однако применение метода в промышленных масштабах было нерентабельным. Потом начали в качестве подкормки использовать метан, который при таких условия распадался на углерод и водород. Как раз этот углерод и выступал, если можно так сказать, кормом алмаза, позволяющим ему расти намного быстрее.
Таким образом, сегодня этот метод используется для создания искусственных алмазов. И хотя он и является рентабельным, стоимость таких целых искусственных минералов остается высокой, что делает их не сильно популярными по сравнению с заменителями бриллиантов.