Краткое содержание статьи:

- Введение
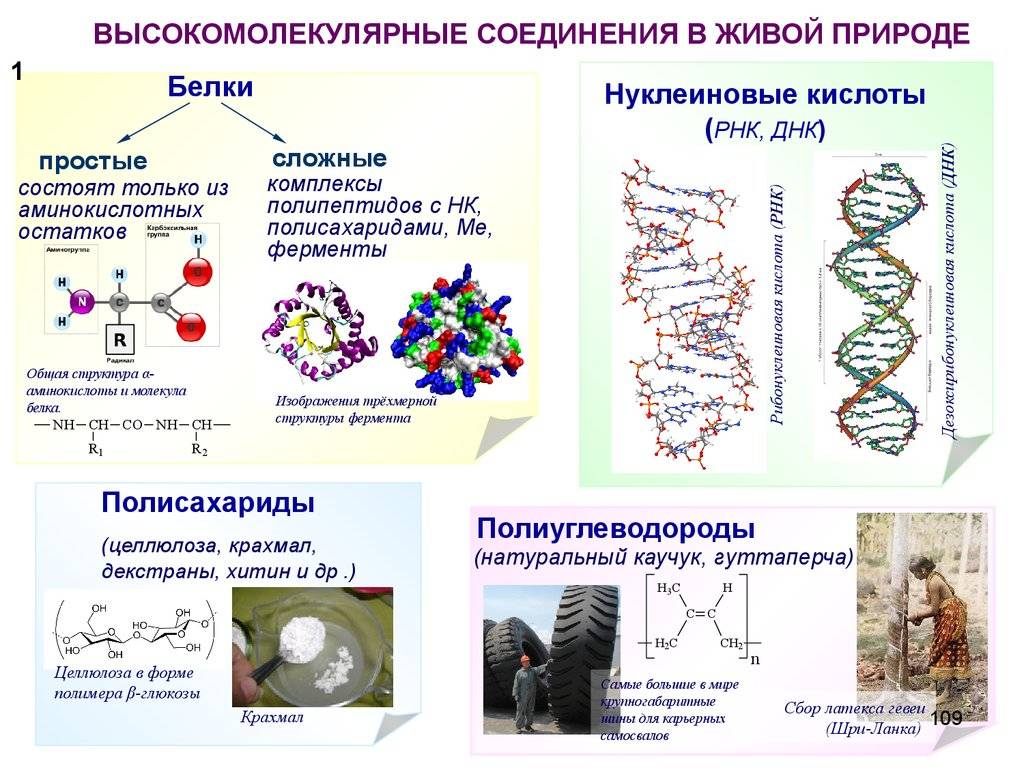
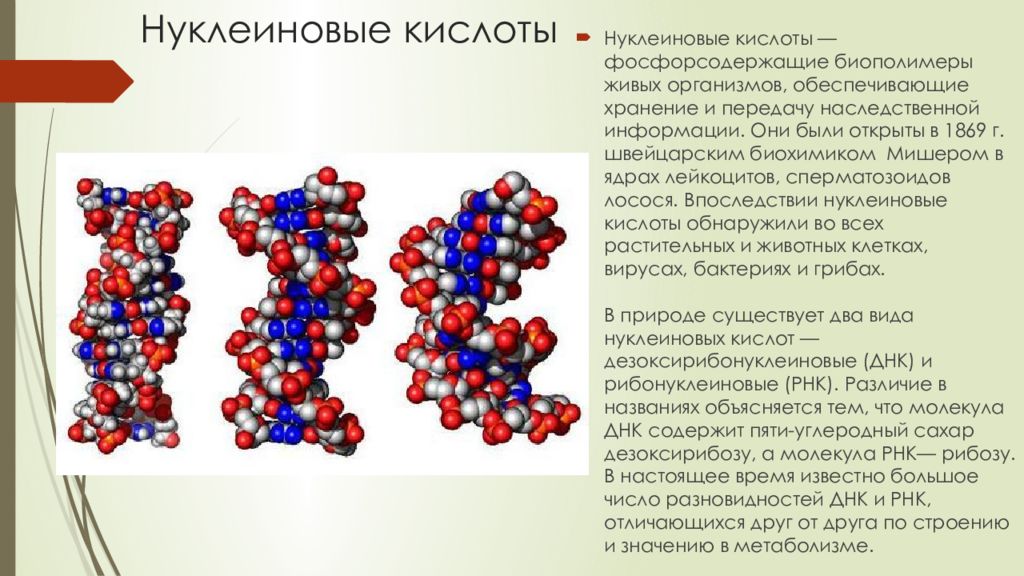
- Определение белков и нуклеиновых кислот
- Значение белков и нуклеиновых кислот в живых организмах
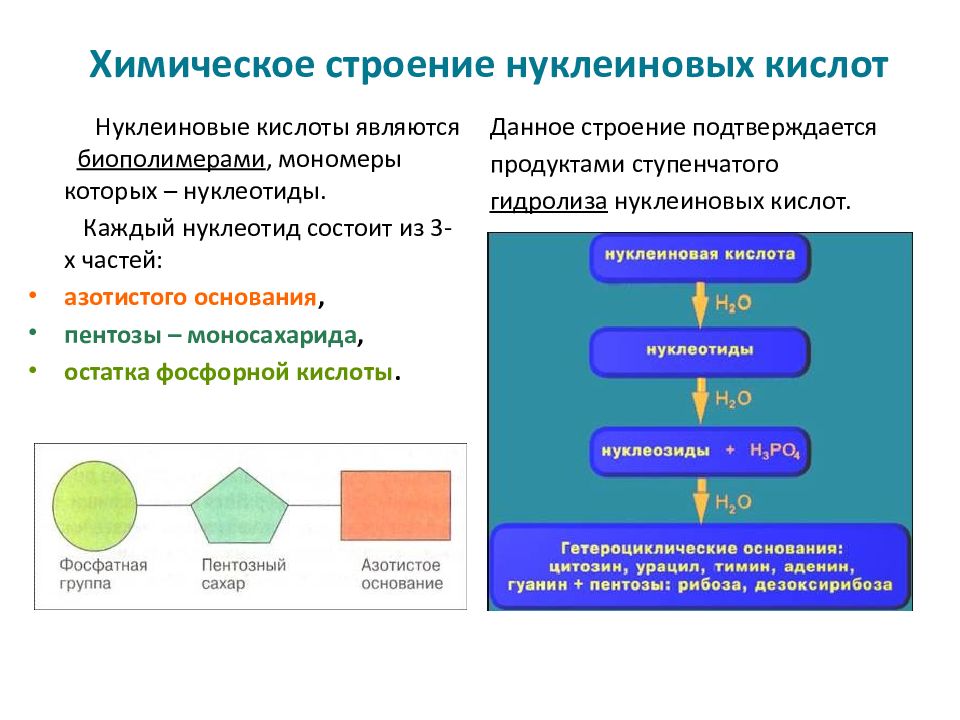
- Строение белков и нуклеиновых кислот
- Первичная, вторичная, третичная и четвертичная структуры белков
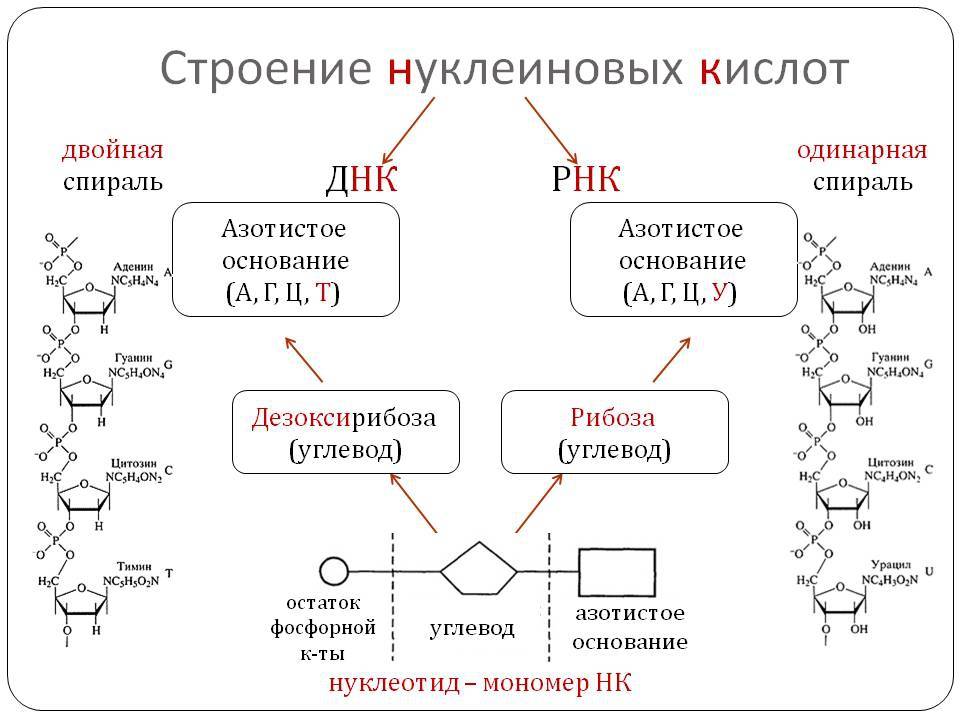
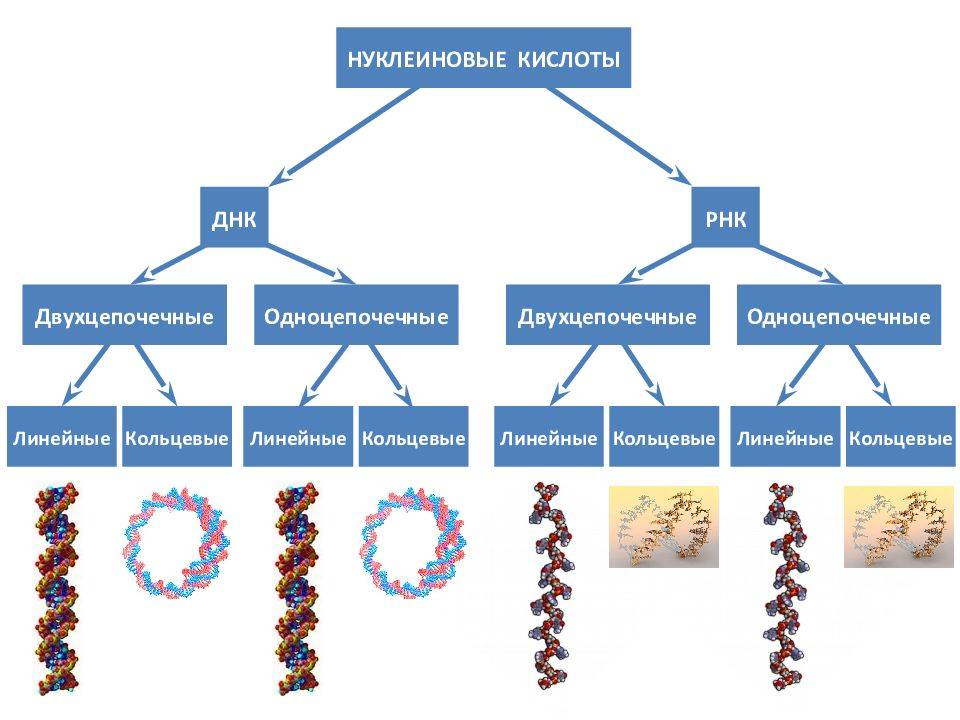
- Двойная спиральная структура нуклеиновых кислот
- Функции белков
- Ферменты и их роль в биохимических реакциях
- Транспортные белки и их участие в клеточной коммуникации
- Структурные белки и их вклад в клеточную поддержку
- Функции нуклеиновых кислот
- ДНК и ее роль в хранении генетической информации
- РНК и ее роль в синтезе белка
- Сходства и различия между белками и нуклеиновыми кислотами
- Обе являются макромолекулами, но имеют разные структуры и функции
- Белки – это полимеры аминокислот, а нуклеиновые кислоты – полимеры нуклеотидов
- Взаимодействие между белками и нуклеиновыми кислотами
- ДНК-связывающие белки и их значение в регуляции генов
- РНК-белковые комплексы, участвующие в процессинге РНК
- Заболевания, связанные с белками и нуклеиновыми кислотами
- Болезни, связанные с нарушением сворачивания белков, и их влияние на здоровье человека
- Генетические нарушения, вызванные мутациями нуклеиновых кислот
- Экспериментальные методы исследования белков и нуклеиновых кислот
- Рентгеновская кристаллография и ЯМР-спектроскопия для определения структуры белков
- Полимеразная цепная реакция (ПЦР) и секвенирование ДНК для анализа нуклеиновых кислот
- Роль белков и нуклеиновых кислот в биотехнологии
- Генная инженерия и производство рекомбинантных белков
- Генная терапия и терапия на основе РНК
- Заключение
- Часто задаваемые вопросы
- Чем белки и нуклеиновые кислоты отличаются от углеводов и липидов?
- Могут ли белки выполнять те же функции, что и нуклеиновые кислоты?
- Все ли белки являются ферментами?
- Как мутации нуклеиновых кислот связаны с генетическими нарушениями?
- Каково значение понимания белок-белковых взаимодействий при открытии лекарств?
Определение белков
Определение белков может проводиться различными методами. Один из наиболее распространенных методов — определение содержания белка через измерение его концентрации в растворе посредством спектрофотометрии. Для этого применяются специальные биохимические анализаторы, которые позволяют измерить оптическую плотность раствора и определить содержание белка.
Также существуют методы определения белков на основе их электрических и механических свойств. Например, электрофорез — метод разделения белков по их электрическому заряду и массе. Этот метод основан на использовании электрического поля, которое позволяет разделить белки на основе их электрических свойств.
Другим распространенным методом определения белков является иммунохимический анализ. Он основан на использовании антител, специфически связывающихся с определенными белками. Этот метод позволяет определить наличие и количество определенного белка в образце.
Важно отметить, что определение белков может быть сложным процессом, требующим использования специализированного оборудования и экспертных знаний. Однако, благодаря развитию технологий, современные методы определения белков становятся все более точными и доступными
Что такое аминокислота
Аминокислота относится к простой органической молекуле, которая содержит как карбоксильные, так и аминогруппы. Как правило, двадцать различных аминокислот служат строительными блоками белков. Как карбоксильные, так и аминогруппы связаны с одним и тем же углеродом. Следовательно, каждая аминокислота отличается от другой аминокислоты типом группы R, связанной с углеродом. Химические свойства группы R определяют свойства аминокислот. Структура типичной аминокислоты показана на фигура 2.
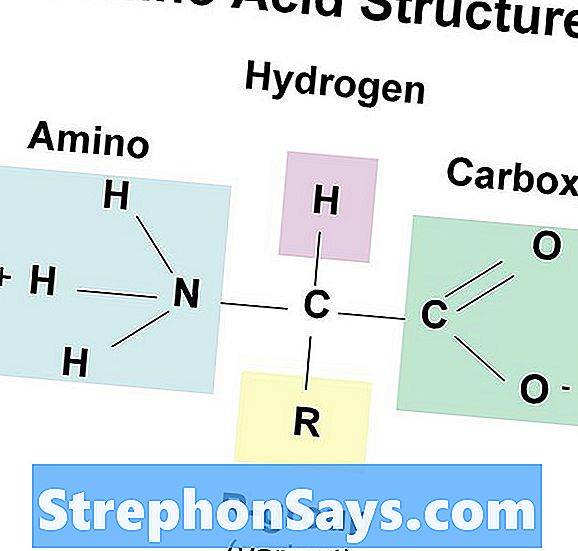
Рисунок 2: Структура аминокислоты
Двадцать аминокислот служат строительными блоками белков. Каждая аминокислота представлена кодоном в генетическом коде. Во время синтеза белка молекула мРНК включает последовательность аминокислот в функциональном белке. Двадцать аминокислот показаны в рисунок 3.
Рисунок 3: Двадцать аминокислот
У человека девять аминокислот считаются незаменимыми аминокислотами, поскольку они не могут быть синтезированы организмом. Поэтому эти аминокислоты должны быть включены в рацион. Другие аминокислоты синтезируются в организме различными биохимическими путями.
Основные особенности полисахаридов
1. Многообразие структур и функций:
Полисахариды могут иметь разнообразные структуры и функции в организме. Например, гликоген служит запасной формой глюкозы в животных, целлюлоза обеспечивает физическую поддержку у растений, хитин участвует в образовании экзоскелета у насекомых.
2. Полимерные свойства:
Полисахариды образуют длинные цепи из мономерных подединиц, соединенных гликозидными связями. Их полимерная структура обеспечивает им устойчивость и прочность.
3. Различные типы связей:
Сахарные остатки в полисахаридах могут быть связаны различными типами связей, например, гликозидными или гликозидными эфирами. Это определяет разнообразие структурных и функциональных характеристик полисахаридов.
4. Водорастворимость:
Большинство полисахаридов обладают высокой водорастворимостью, что делает их доступными для транспорта и использования в клетках организма.
5. Потребление в пище:
Некоторые полисахариды, такие как крахмал и клетчатка, являются основными источниками энергии и пищевыми волокнами для человека.
6. Биологическая активность:
Некоторые полисахариды обладают биологической активностью и могут выполнять роль лекарственных средств или биологически активных добавок, таких как пектины или гиалуронат натрия.
В целом, полисахариды важны для жизнедеятельности организма и выполняют различные функции, включая хранение энергии, структурную поддержку и защиту клеток.
Функции белков
Одной из основных функций белков является их участие в катализе химических реакций. Белки, называемые ферментами, активно участвуют во многих биохимических процессах, ускоряя химические реакции, которые происходят в организме. Ферменты играют важную роль в пищеварении, дыхании, синтезе ДНК и РНК, обмене веществ и других процессах.
Белки также имеют структурную функцию. Они образуют каркас клеток и тканей, придают им прочность и эластичность. Например, коллаген — это протеин, который обеспечивает прочность соединительной ткани, а кератин — строительный материал для волос, ногтей и кожи. Структурные белки также образуют некоторые органеллы клетки, такие как микротрубочки, микрофибриллы и микрофиламенты.
Белки играют важную роль в транспортных процессах организма. Они участвуют в передвижении различных молекул в клетках и между клетками. Например, гемоглобин — белок, который переносит кислород из легких в ткани. Транспортные белки также отвечают за перенос других важных молекул, таких как глюкоза или гормоны.
Белки играют важную роль в иммунной системе. Они помогают защищать организм от вредных веществ, микроорганизмов и других агентов. Иммунные белки, такие как антитела, борются с инфекционными агентами, помогая организму устранить инфекцию. Белки также играют важную роль в механизмах воспаления и регуляции иммунного ответа.
Одной из важных функций белков является их роль в передаче сигналов внутри и между клетками. Белки-рецепторы на клеточной мембране обнаруживают сигналы из внешней среды и передают их внутрь клетки. Это позволяет организму реагировать на изменения в окружающей среде и адаптироваться к ним.
Кроме того, белки выполняют множество других функций, таких как хранение питательных веществ, регуляция генов, защита от оксидативного стресса и регуляция клеточного цикла. Белки являются неотъемлемой частью жизни организмов и играют важную роль в поддержании их жизнедеятельности.
| Функция | Примеры белков |
|---|---|
| Катализ химических реакций | Липаза, аминотрансфераза |
| Структурная функция | Кератин, коллаген |
| Транспортные функции | Гемоглобин, липопротеины |
| Иммунные функции | Антитела, цитокины |
| Передача сигналов | Рецепторы — инсулинорецептор, рецепторы гормонов |
Важные особенности белков
1. Зависимость структуры от функциональности: Каждый белок имеет уникальную структуру, которая определяет его функциональность. Различные пептидные цепочки и аминокислотные остатки влияют на формирование третичной и кватернической структуры белка, а также на его активность и связывание с другими молекулами.
2. Разнообразие функций: Белки выполняют широкий спектр функций в организмах. Они могут служить структурными компонентами клеток, участвовать в переносе молекул и сигналов, каталитически активировать химические реакции, регулировать генную экспрессию и участвовать в иммунном ответе.
3. Способность к свертыванию: Белки обладают способностью к сворачиванию, что позволяет им принимать определенную трехмерную структуру
Это важно для их функциональности, так как правильная структура позволяет белкам взаимодействовать с другими молекулами и выполнять свою роль в организме
4. Измерение концентрации: Концентрация белков в организме может быть измерена с помощью различных методов, таких как иммуноферментный анализ или электрофорез. Это позволяет оценить здоровье организма и выявить наличие каких-либо патологических состояний.
5. Аминокислотная последовательность: Белки состоят из последовательности аминокислотных остатков, которая задает их структуру и функциональность. Различия в аминокислотной последовательности могут приводить к изменению структуры и функциональности белка, что может быть связано с наследственными заболеваниями или мутациями.
6. Взаимодействие с другими молекулами: Белки могут взаимодействовать с другими молекулами, такими как нуклеиновые кислоты, липиды и углеводы
Это важно для их функционирования, так как они могут образовывать комплексы с другими молекулами и выполнять совместные биологические процессы
Что такое аминокислота?
Аминокислота представляет собой простую молекулу, образованную C, H, O, N, а иногда также серой. Есть около 20 распространенных аминокислот. Все аминокислоты имеют –COOH, -NH2 группы и –H, связанный с углеродом. Углерод является хиральным углеродом, а альфа-аминокислоты являются наиболее важным типом в биологическом мире. Более того, мы не можем найти D-аминокислоты в белках и не участвуют в метаболизме высших организмов.
Однако некоторые аминокислоты важны в структуре и метаболизме низших форм жизни. Помимо обычных аминокислот, есть некоторые аминокислоты, не являющиеся производными белков, многие из которых являются промежуточными продуктами метаболизма или частями небелковых биомолекул (орнитин, цитруллин). Аминокислота имеет следующую общую структуру.
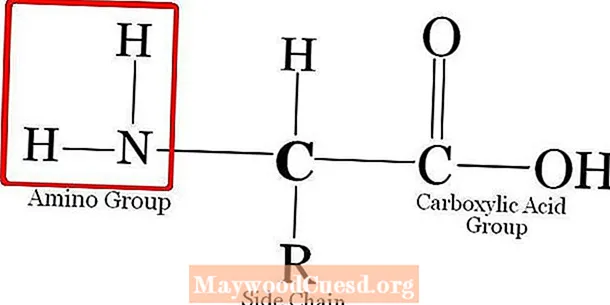
Группа R отличается от аминокислоты к аминокислоте. Аналогично, простейшая аминокислота с группой R, являющейся H, представляет собой глицин. Кроме того, в соответствии с группой R мы можем разделить аминокислоты на разные группы; такие как алифатические – ароматические, неполярные – полярные, положительно заряженные – отрицательно заряженные или полярные незаряженные и т. д. Кроме того, аминокислоты присутствуют в виде цвиттер-ионов при физиологическом pH 7,4.
Кроме того, аминокислоты являются строительными блоками белков. Когда две аминокислоты соединяются с образованием дипептида, комбинация происходит в -NH2 группа одной аминокислоты с группой –COOH другой аминокислоты. Там образуется пептидная связь, удаляющая молекулу воды. Точно так же тысячи аминокислот могут конденсироваться с образованием длинных пептидов, которые затем претерпевают различные паттерны сворачивания с образованием белков.
Описание важных молекул
Белки
Белки являются одним из основных строительных материалов организма. Они состоят из аминокислот, связанных между собой пептидными связями. Белки выполняют множество функций, таких как транспорт молекул в клетке, катализ реакций (ферменты), защита организма (антитела) и контроль генной активности (факторы транскрипции).
Структура белков может быть различной — от простых линейных цепей до сложных трехмерных структур. Эта структура определяет их функциональность. Белки могут быть растворимыми в воде (глобулярные), или нерастворимыми (волокнистые).
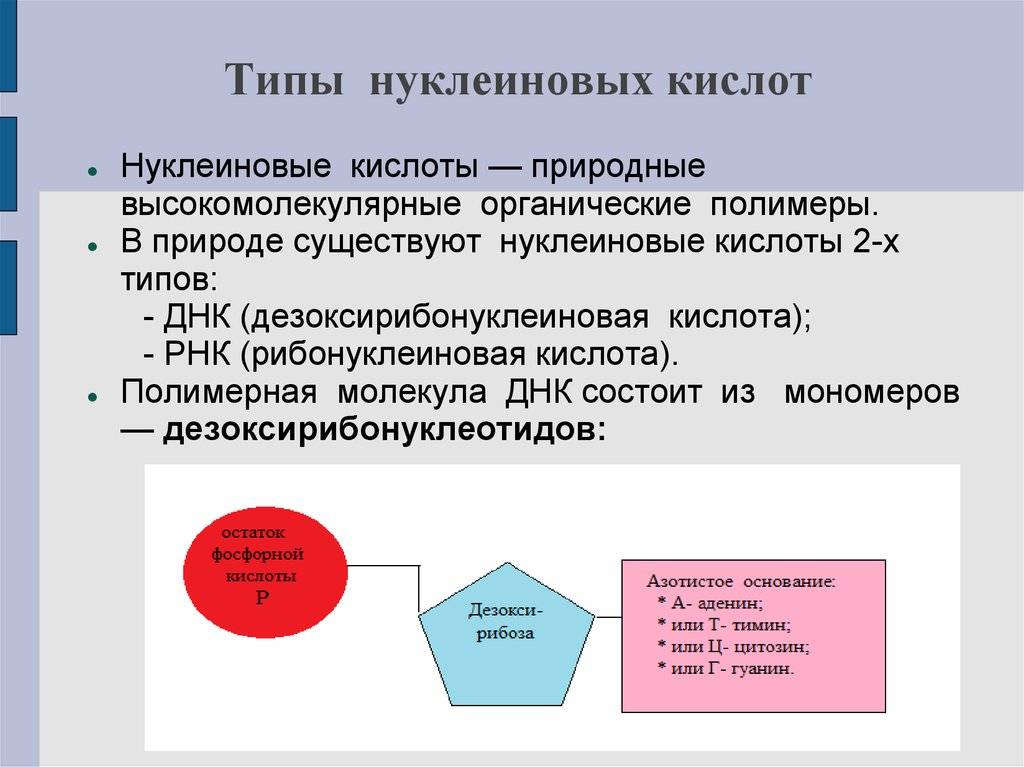
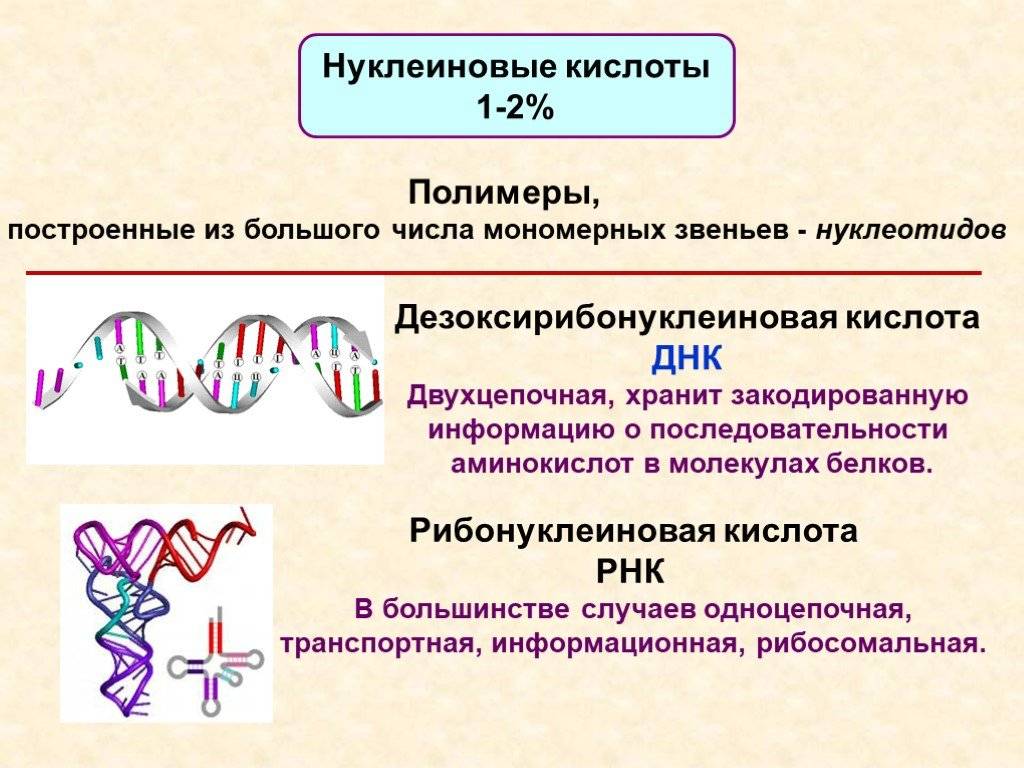
Нуклеиновые кислоты
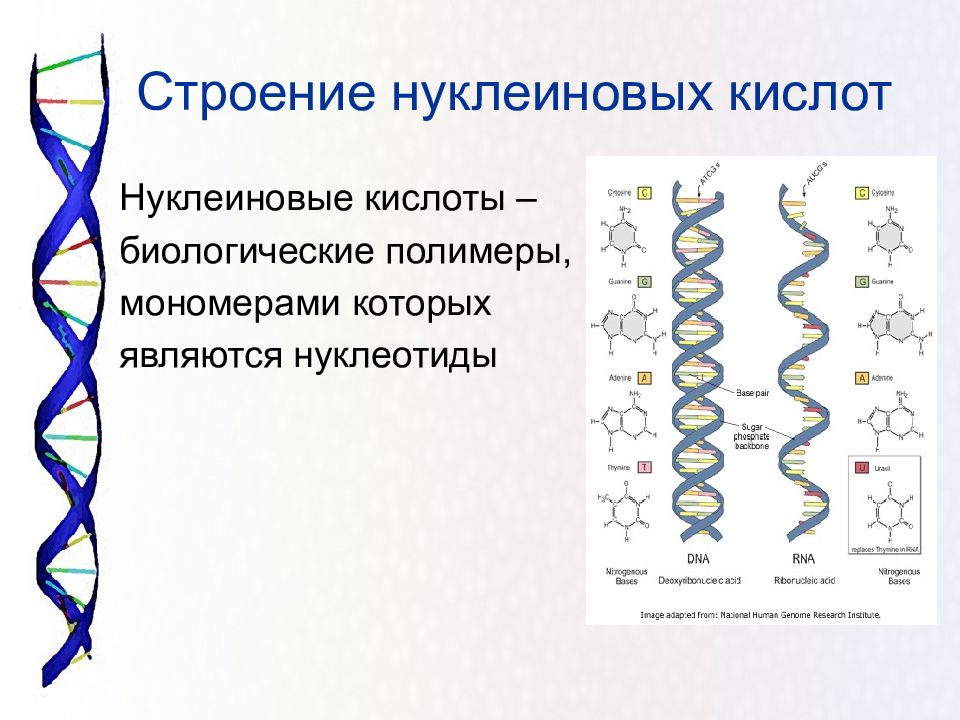
Нуклеиновые кислоты — это класс молекул, включающих ДНК (дезоксирибонуклеиновую кислоту) и РНК (рибонуклеиновую кислоту). Они являются основой генетической информации и участвуют в передаче генетической информации от родителей к потомству.
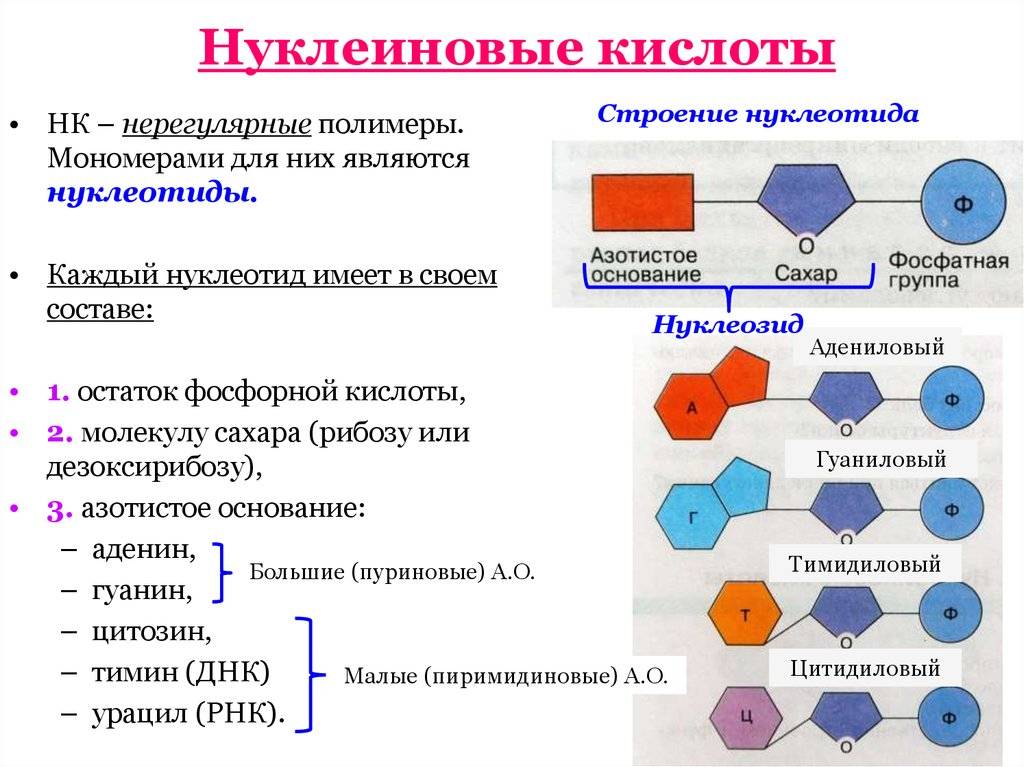
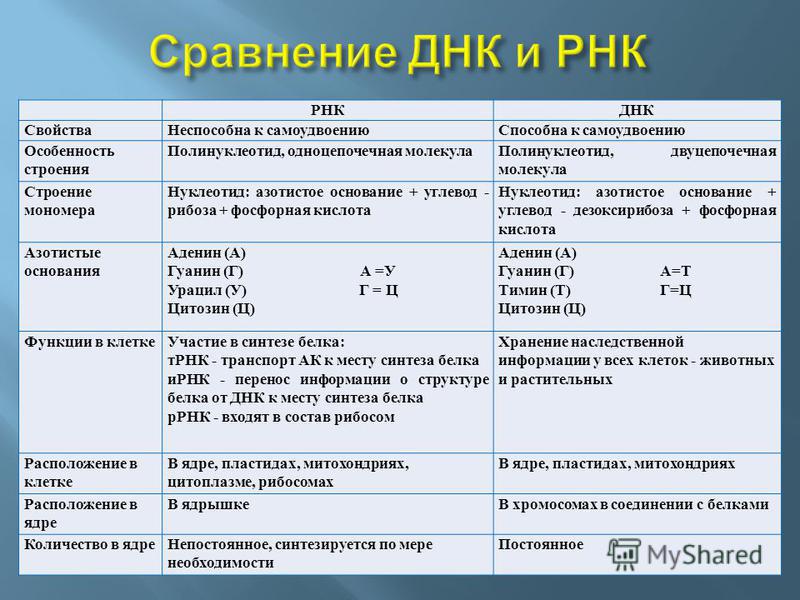
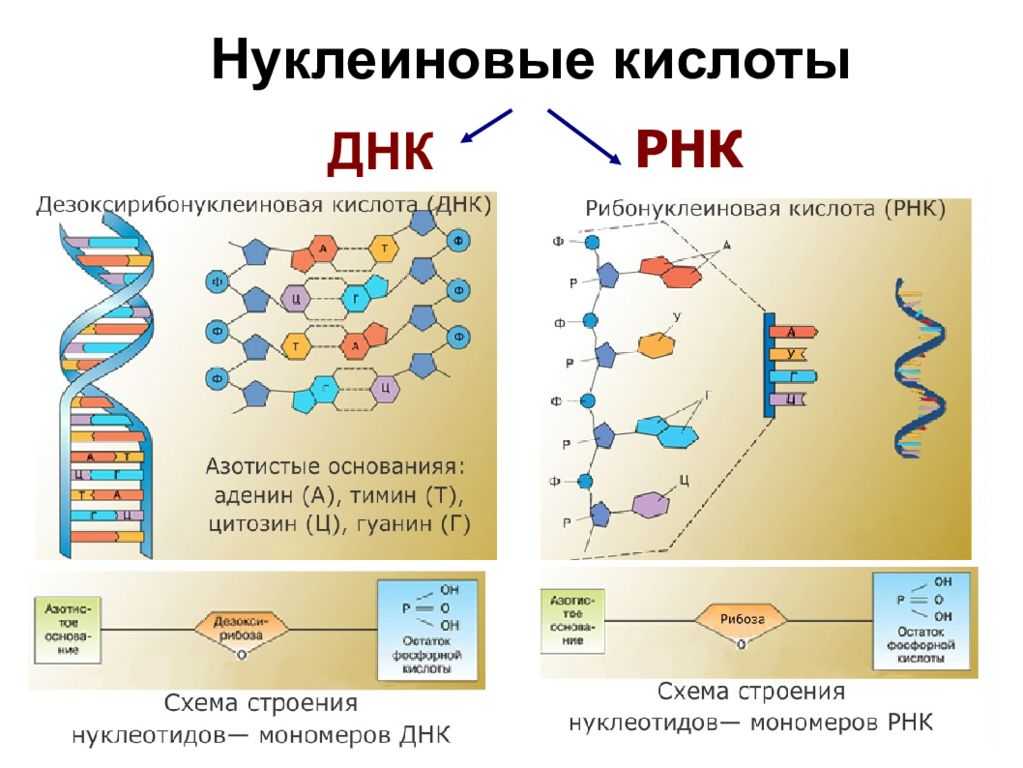
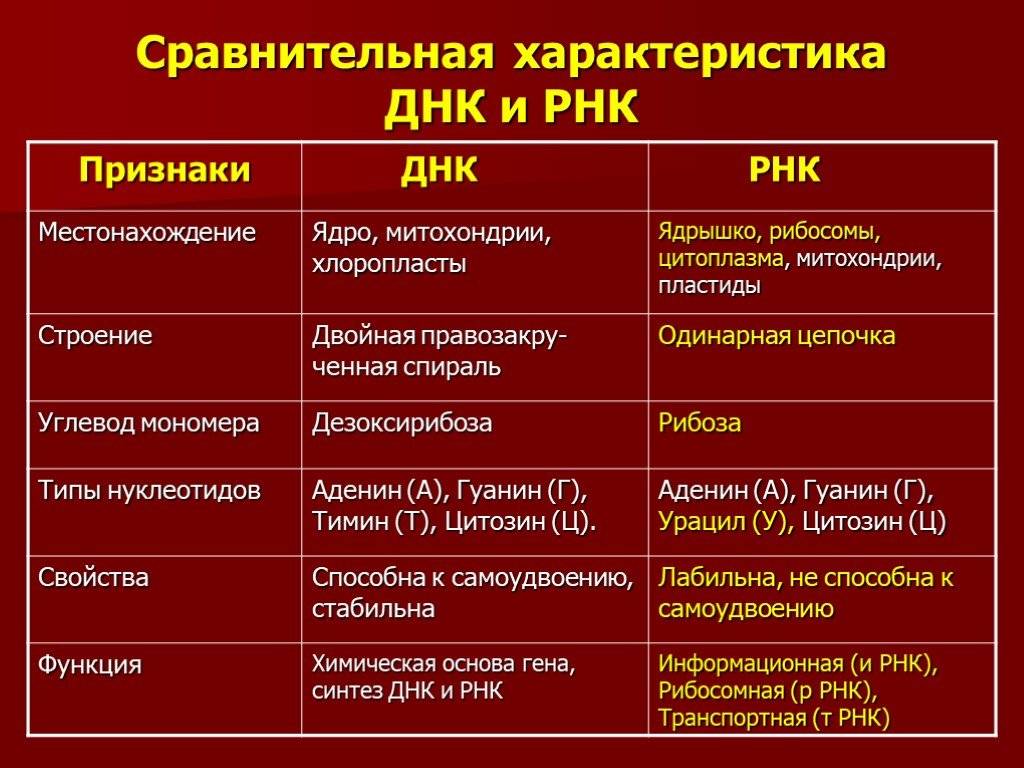
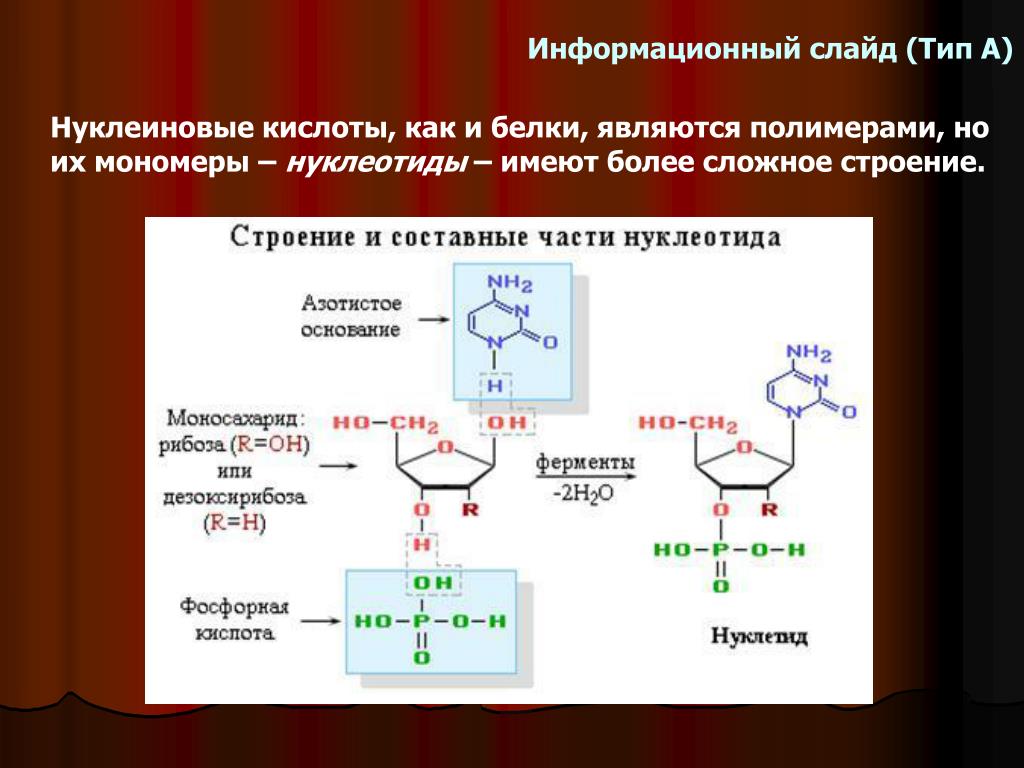
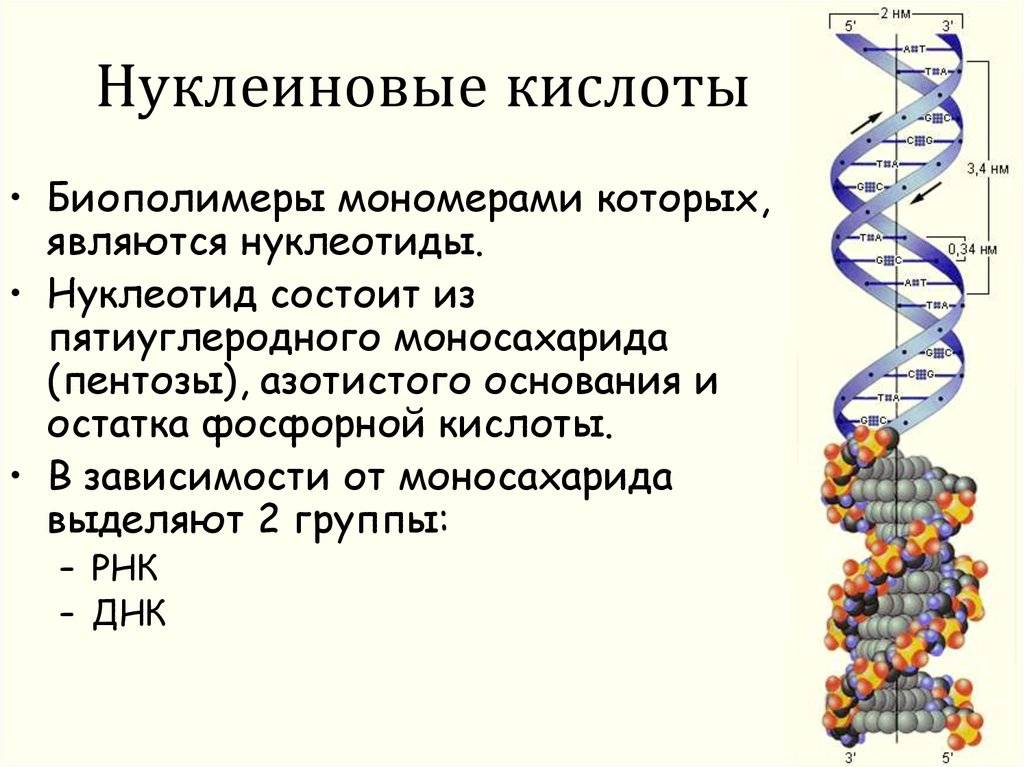
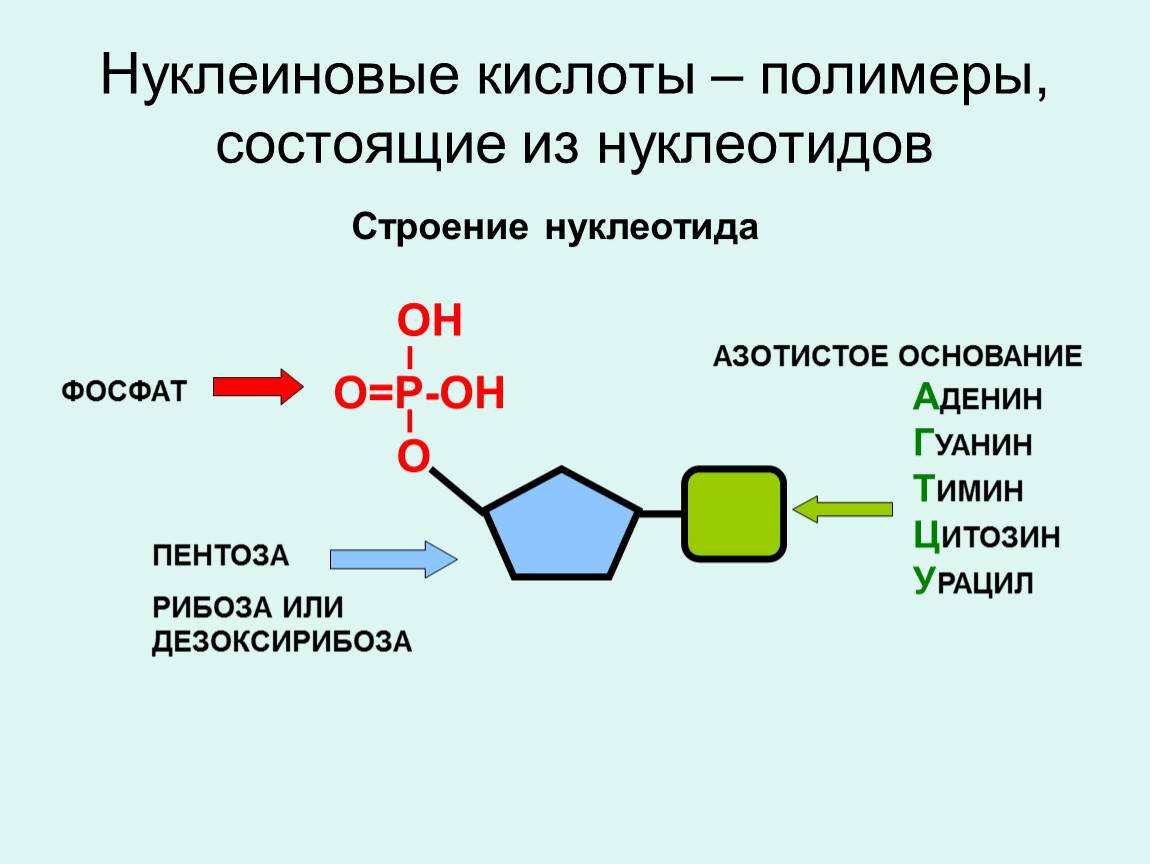
Структура нуклеиновых кислот включает нуклеотиды, состоящие из пятиугольного цикла с атомами фосфора, азотистыми основаниями и сахарами. ДНК представляет собой двухцепочечную структуру спиральной формы, в то время как РНК обычно является одноцепочечной структурой.
Нуклеиновые кислоты выполняют функции хранения, передачи и экспрессии генетической информации. Они регулируют процессы клеточного деления и транскрипции генов, и служат материалом для синтеза белков.
Отличия между белками и нуклеиновыми кислотами
| Параметр | Белки | Нуклеиновые кислоты |
|---|---|---|
| Структура | Линейные или сложные трехмерные структуры | Двухцепочечная (ДНК) или одноцепочечная (РНК) |
| Составные элементы | Аминокислоты | Нуклеотиды |
| Функции | Транспорт, катализ, защита, контроль генной активности | Хранение, передача, регуляция генетической информации |
Структура белков
Структура белков представляет собой трехмерное складывание аминокислотных остатков, из которых они состоят. Аминокислоты соединяются между собой пептидными связями, образуя пептидные цепочки. Существует 20 различных аминокислот, и их последовательность в пептидной цепи определяет конкретную структуру белка.
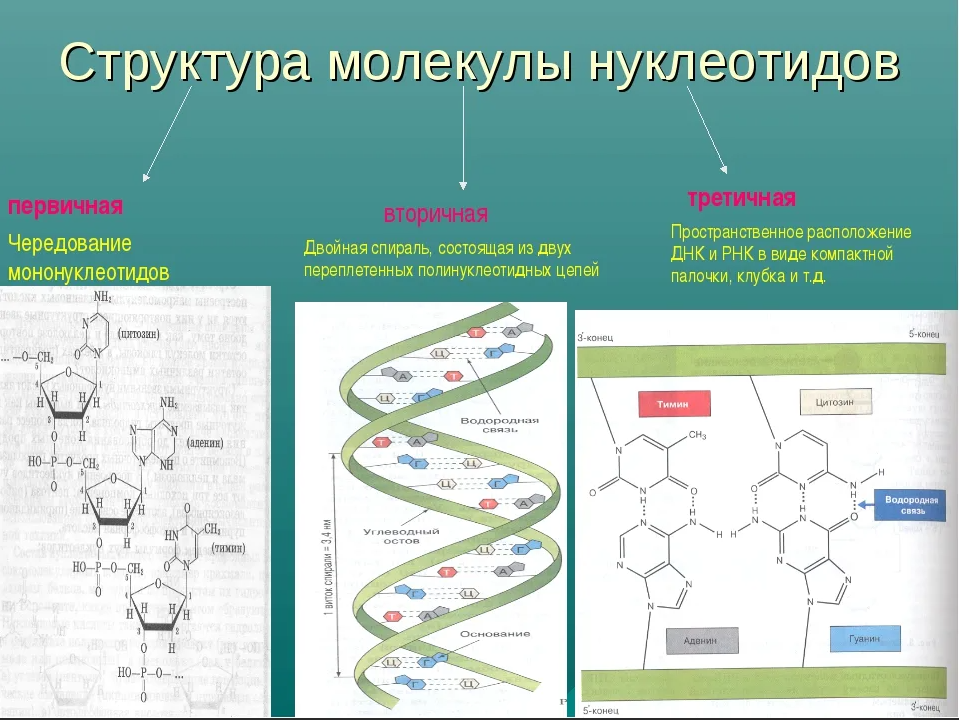
Структура белка может быть описана на трех уровнях: первичной, вторичной и третичной структуре.
Первичная структура белка представляет собой последовательность аминокислотных остатков в пептидной цепи. Она определяется генетической информацией, закодированной в ДНК. Любое изменение в последовательности аминокислот может привести к изменению функции белка.
Вторичная структура белка определяется пространственными взаимодействиями между аминокислотами. Наиболее распространенными типами вторичной структуры являются α-спираль и β-складка. Эти структурные мотивы образуются благодаря водородным связям между аминокислотными остатками.
Третичная структура белка представляет собой трехмерное складывание пептидной цепи в пространстве. Это максимально устойчивая конформация белка, которая обеспечивает его специфическую функцию. Третичная структура формируется через различные типы взаимодействий, такие как водородные связи, взаимодействия гидрофобных и гидрофильных групп, электростатические и ван-дер-ваальсовы силы.
Некоторые белки имеют еще более сложную структуру, называемую четвертичной структурой, которая образуется из соединения нескольких пептидных цепей. Такие белки могут выполнять сложные функции, связанные с взаимодействием между различными под-единицами.
Изучение структуры белков позволяет понять их функции и важность в жизнедеятельности клеток. Методы, такие как рентгеноструктурный анализ и ядерный магнитный резонанс, позволяют получать детальные трехмерные модели белков, что является важным инструментом в молекулярной биологии и медицине
Функции нуклеиновых кислот и белков
Функции нуклеиновых кислот:
Нуклеиновые кислоты, такие как ДНК (дезоксирибонуклеиновая кислота) и РНК (рибонуклеиновая кислота), отвечают за хранение, передачу и реализацию генетической информации в организмах. ДНК содержит генетическую информацию, необходимую для развития и функционирования клеток организма. РНК выполняет роль посредника между ДНК и белками и участвует в процессе синтеза белков.
Кроме того, нуклеиновые кислоты участвуют в регуляции генной активности и генной экспрессии. Они контролируют процессы транскрипции (перенос генетической информации из ДНК в РНК) и трансляции (перевод генетической информации с РНК на аминокислотную последовательность белка).
Функции белков:
Белки выполняют множество разнообразных функций в организмах. Они участвуют в катаболических и анаболических процессах, обеспечивают структурную поддержку клеток и тканей, регулируют метаболические пути и иммунные ответы, передают сигналы внутри клеток и между клетками, участвуют в транспорте различных молекул и осуществляют защиту организма от патогенов.
Белки также являются основными ферментами, катализирующими химические реакции в организме. Они обладают уникальными активными центрами, способными связывать и преобразовывать различные молекулы с высокой специфичностью.
Кроме того, белки участвуют в структуре и функционировании клеточных органелл, таких как мембраны, ядрышки, рибосомы, митохондрии и другие. Они обеспечивают поддержку структурной целостности клетки и участвуют в ее движении и формировании.
Сходства и различия:
Несмотря на то, что нуклеиновые кислоты и белки выполняют различные функции в организме, у них есть некоторые сходства. Оба типа молекул состоят из длинных полимерных цепей, состоящих из повторяющихся мономеров — нуклеотидов (в случае нуклеиновых кислот) и аминокислот (в случае белков).
Кроме того, нуклеиновые кислоты и белки имеют уникальные структуры, которые позволяют им выполнять свои функции. Вместе с тем, различия в структурах соответствуют различиям в функциях этих молекул.
| Нуклеиновые кислоты | Белки |
|---|---|
| Хранение и передача генетической информации | Регуляция генной активности и генной экспрессии |
| Участие в транскрипции и трансляции | Катализ химических реакций |
| Роль посредника между ДНК и белками | Структурная поддержка и функции клеточных органелл |
Таким образом, нуклеиновые кислоты и белки играют важные роли в организмах. Понимание их функций и взаимодействия помогает разобраться в механизмах жизненных процессов и развитии более эффективных методов лечения и диагностики различных заболеваний.
Состав и структура
Основное отличие между белками и нуклеиновыми кислотами заключается в их составе и структуре.
Белки являются полимерами аминокислот и состоят из длинных цепочек, связанных пептидными связями. Аминокислоты в белке могут быть различных типов и образуют уникальную последовательность, определяющую его функции и свойства.
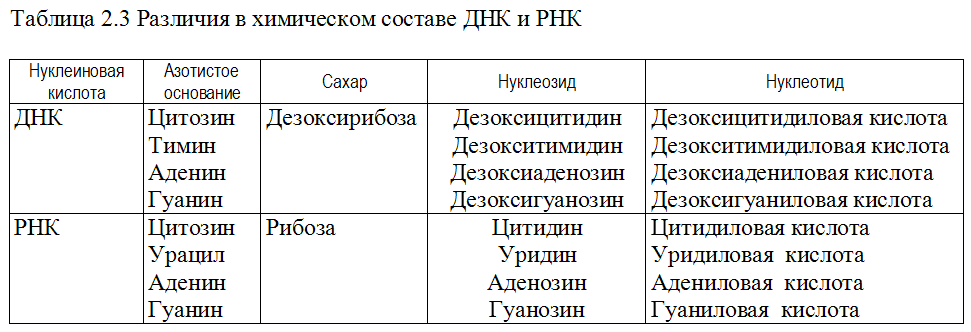
Нуклеиновые кислоты же состоят из нуклеотидов, которые в свою очередь состоят из сахара, фосфата и азотистого основания. Нуклеотиды соединяются между собой эстерными связями, образуя длинные цепочки ДНК или РНК. Основные типы азотистых оснований в ДНК — аденин (А), тимин (Т), гуанин (Г) и цитозин (С), в то время как в РНК вместо тимина присутствует урацил (У).
Силовая связь между белками и нуклеиновыми кислотами состоит в том, что белки могут связываться с ДНК или РНК, и стеероспецифичный связывание позволяет регулировать генетическую информацию, переносимую нуклеиновыми кислотами. Белки связываются с ДНК или РНК через специфическую взаимодействие между своими аминокислотными остатками и азотистыми основаниями нуклеотидов.
Структура белков
Протеин состоит из одной или нескольких полипептидных цепей, каждая из которых состоит из аминокислот. Существует 20 различных аминокислот, и их комбинация в определенной последовательности определяет структуру и функцию белка.
Структура белка может быть организована на разных уровнях: первичном, вторичном, третичном и кватернарном.
- Первичная структура — это последовательность аминокислотных остатков в полипептидной цепи. Эта последовательность кодируется генами ДНК.
- Вторичная структура — это пространственное расположение полипептидной цепи, которое образуется из-за взаимодействия между атомами аминокислотных остатков. Вторичная структура может быть альфа-спиралью, бета-складкой или случайной катуглы.
- Третичная структура — это трехмерное пространственное расположение полипептидных цепей. Оно формируется за счет взаимодействия боковых цепей аминокислот и образования различных связей, таких как гидрофобные, гидрофильные и пептидные связи.
- Кватернарная структура — это взаимное расположение и взаимодействие нескольких полипептидных цепей, образующих функциональный белковый комплекс.
Структура белка напрямую связана с его функцией. Даже небольшие изменения в структуре белка могут привести к нарушению его функции и развитию различных патологических состояний.
Изучение структуры белков имеет важное значение для понимания их функций и разработки новых лекарственных препаратов. Белки являются центральными объектами исследования в молекулярной биологии и биохимии и представляют собой удивительное сочетание сложности и эффективности