Что такое фермент
Фермент – это биологическая макромолекула, вырабатываемая живыми организмами для катализа биохимической реакции внутри клетки при температуре тела. Функция фермента незаменима для поддержания жизни. Все биохимические реакции, происходящие в живых организмах, зависят от катализаторов. До настоящего времени действие около 4000 ферментов хорошо известно. Ферменты действуют в мягких условиях, таких как температура тела и рН. Они катализируют реакции строительства и разрушения материалов внутри живых организмов. Функция ферментов очень специфична. Большинство ферментов состоят из глобулярных белков с высоким молекулярным весом. Глобулярные белки перестраиваются в мультибелковые комплексы. Некоторые ферменты требуют помощи кофакторов для их действия. Кофакторами являются неорганические ионы, такие как Mg 2+, Fe 2+, Zn 2+ и Mn 2+ или небольшие органические молекулы, называемые коферментами. Фермент может быть ингибирован или активирован путем связывания кофакторов с ферментом.

Рисунок 3: Фермент глюкозидаза
Ферменты подразделяются на шесть типов в зависимости от типа катализируемой ими реакции. Это оксидоредуктазы, трансферазы, лиазы, гидролазы, лигазы и изомеразы. Фермент гликозидаза, который превращает мальтозу в две молекулы глюкозы, показан на фиг.3 .
Отличие ферментов от других видов катализаторов
При изучении свойств ферментов было установлено, что по своему действию они являются катализаторами, в основном обеспечивающими положительный катализ. Поэтому для них характерны все особенности процесса катализа.
Наряду с этим ферменты имеют свои определенные отличия, к которым относятся «космические» скорости катализируемых ими реакций, очень сложная химическая структура, которая в ряде случаев может изменяться в ходе реакции и восстанавливаться в исходную после ее окончания, и, наконец, высокая специфичность действия.
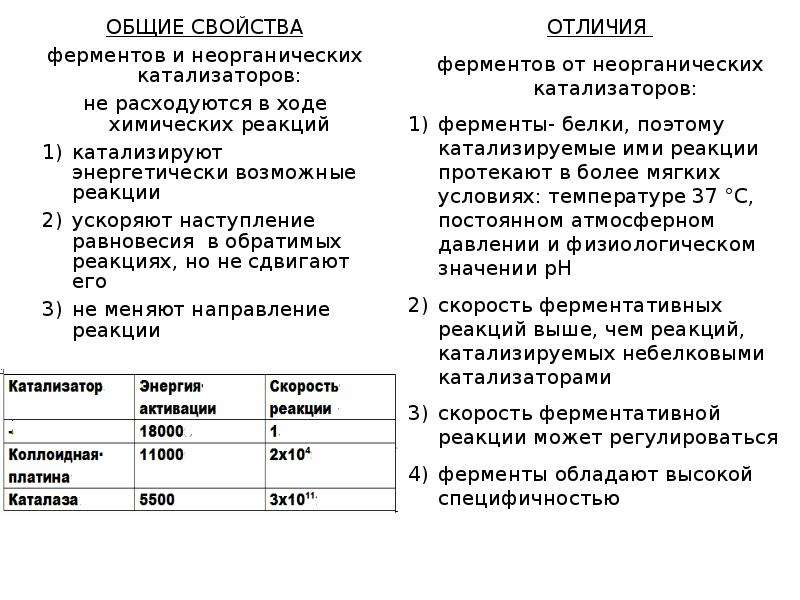
Для подтверждения высокой скорости реакций, катализируемых ферментами, снова обратимся к нашему примеру с перекисью водорода. В организме разложение Н2О2 катализируется ферментом каталазой со скоростью, в 2х1011раз превышающей скорость некатализируемой реакции и в 107 раз в случае с платиновой чернью. Энергия активации при ферментативной реакции снижается соответственно в 9 и 6 раз. Из других примеров можно указать на следующие. В желудке человека вырабатывается фермент пепсин, который расщепляет белки. Один грамм пепсина за час способен гидролизовать 50 кг яичного белка, а 1,6г амилазы, синтезируемой в поджелудочной и слюнной железах, за час может расщепить 175 кг крахмала.
Сложность структуры ферментов обусловлена тем, что все они являются белками, т. е. высокомолекулярными соединениями с большим молекулярным весом.
При изучении ферментов было установлено, что все они являются белками и поэтому обладают всеми свойствами белков. Ферменты имеют, аналогичную белкам сложную структуру, подвергается расщеплению под действием протеолитических ферментов, при растворении в воде образуются и т.д. Молекулярный вес ферментов колеблются в пределах сотен тысяч и миллионов единиц молекулярного веса.
Молекулярный вес рибонуклеазы составляет 12700, пепсина – 35500, катализы крови – 248 000, глютаматдегидрогиназы – 1000000.
По структуре все ферменты делятся на простые и сложные.
Простые ферменты ферменты-протеины – состоят только из аминокислот, а сложные ферменты – ферменты-протеиды – в своем составе имеют белковую часть апофермент, состоящую из одних аминокислот, и небелковую часть – кофермент, или простетическую группу. Небелковая часть может быть представлена минеральными веществами и витаминами.
К ферментам-протеинам относятся, например, гидролитические ферменты желудочно-кишечного тракта, которые расщепляют пищевые продукты с учетом воды, к ферментам-протеидам принадлежит большая часть окислительно-восстановительных ферментов.
Неорганические катализаторы и ферменты (биокатализаторы), не расходуясь сами, ускоряют течение химических реакций и их энергетические возможности. В присутствии любых катализаторов энергия в химической системе сохраняет постоянство. В процессе катализа направление химической реакции остается неизменным.
Краткая история катализаторов, ферментов и катализа
Реакции катализа были известны людям на протяжении многих веков, но они не могли объяснить явления, которые они видели вокруг себя, такие как брожение вина до уксуса, закваска хлеба и т. Д. Именно в 1812 году русский химик Готтлиб Сигизмунд Константин Кирххоф изучал Разложение крахмала на сахар или глюкозу в кипящей воде в присутствии нескольких капель концентрированной серной кислоты. Серная кислота осталась неизменной после эксперимента и могла быть извлечена. В 1835 году шведский химик Йенс Якоб Берцелиус предложил название « катализ» от греческого термина «ката», означающий «вниз», и «лиин», означающий «ослабить».
Как только реакции катализа были поняты, ученые обнаружили много реакций, которые изменяли скорости в присутствии катализаторов . Луи Пастер обнаружил, что есть некоторый фактор, который катализировал его эксперименты по ферментации сахара и который был активен только в живых клетках. Этот фактор позже был назван «ферментом» немецким физиологом Вильгельмом Кюне в 1878 году. Фермент происходит от греческого слова, означающего «в закваске». В 1897 году Эдуард Бюхнер назвал фермент, сбраживающий сахарозу, зимазой. Его эксперименты также доказали, что ферменты могут функционировать вне живой клетки. В конце концов были обнаружены структура и функции различных ферментов, катализирующих важные функции.
Примеры неорганических катализаторов
1. Платина (Pt): Платина широко используется в катализе в различных процессах, таких как водородация и окисление различных органических соединений. Она обладает высокой активностью и стабильностью.
2. Золото (Au): Золото также является эффективным катализатором, особенно в гетерогенных реакциях, таких как окисление алкоголей и процессы, связанные с хлорированием.
3. Рутений (Ru): Рутений проявляет высокую активность и стабильность в процессах, таких как гидрогенирование и аммоксация. Он часто используется для производства аммиака и синтеза аммиака в промышленности.
4. Медь (Cu): Медь применяется в качестве катализатора во многих процессах, включая гетерогенные процессы, такие как окисление и водородирование органических соединений. Она обладает высокой активностью и избирательностью в реакциях.
Это лишь некоторые примеры неорганических катализаторов, которые широко используются в различных областях химии и промышленности. Каждый из них обладает своими уникальными свойствами и может быть эффективным в различных реакциях.
Металлические катализаторы
Механизм действия металлических катализаторов основан на адсорбции реагирующих молекул на поверхности металла и последующем переносе электронов между адсорбированными молекулами и металлом. Это позволяет происходить активным химическим реакциям, приводящим к образованию новых соединений.
Металлические катализаторы широко применяются в индустрии для синтеза различных химических продуктов. Например, платиновые катализаторы используются в процессе производства пластмасс, а никелевые катализаторы применяются для очистки отходов от необработанного угля.
Преимущества металлических катализаторов включают высокую активность, стабильность и простоту использования. Благодаря своим уникальным свойствам, металлические катализаторы являются неотъемлемой частью многих процессов в химической промышленности.
Однако, у металлических катализаторов есть и некоторые ограничения. Некоторые металлы являются дорогими и редкими, что делает их использование в экономическом плане не всегда выгодным. При этом, одни металлы могут быть эффективными катализаторами для одних реакций, но неэффективными для других, что требует дополнительных исследований и разработок.
Тем не менее, металлические катализаторы являются одним из самых широко применяемых типов катализаторов в химической промышленности и играют важную роль в процессах превращения сырья в ценные продукты.
Катализ с помощью кислот и оснований
Кислотный катализ происходит за счет участия сильных кислот, таких как серная кислота, соляная кислота и фосфорная кислота. Кислоты действуют, отдавая протоны другим молекулам, что способствует активации реакционных молекул и образованию промежуточных комплексов. В результате этого процесса скорость реакции значительно увеличивается.
Основной катализ происходит при участии сильных оснований, таких как гидроксид натрия и гидроксид калия. Основания принимают протоны от других молекул, что также способствует активации реакционных молекул и образованию промежуточных комплексов. Таким образом, скорость реакции увеличивается.
Катализ с помощью кислот и оснований часто используется в промышленности и лабораторных условиях для эффективного проведения химических реакций. Этот вид катализа имеет широкий спектр применений и обладает высокой эффективностью
Однако, необходимо учитывать, что кислоты и основания могут быть опасными веществами, требующими особых мер предосторожности при их использовании
Сравнение ферментов и неорганических катализаторов
Ферменты и неорганические катализаторы оба играют важную роль в реакциях химических превращений
Однако, существуют отличия между ними, которые важно учитывать при выборе катализатора для конкретной реакции
Ферменты — это белковые катализаторы, которые ускоряют химические реакции в организме. Они специфичны для определенных реакций и могут быть очень эффективными в оптимальных условиях. Ферменты обладают высокой специфичностью, уникальной структурой и могут работать при мягких условиях, таких как низкая температура и нейтральный pH. Они также обеспечивают возможность регулирования реакции, что делает их особенно ценными для жизненно важных процессов.
Неорганические катализаторы, в отличие от ферментов, чаще всего не являются белками. Это могут быть металлы, оксиды, соли и другие неорганические соединения. Хотя они могут быть менее специфичными и менее эффективными, они все равно могут катализировать широкий спектр реакций. Такие катализаторы могут работать при высоких температурах и кислых или щелочных условиях. Неорганические катализаторы часто используются в промышленности благодаря своей устойчивости и дешевизне.
Важно отметить, что ферменты и неорганические катализаторы могут дополнять друг друга и использоваться совместно в реакциях. Подбирая катализатор для конкретной реакции, необходимо учитывать условия, эффективность и специфичность, чтобы обеспечить наилучший результат
В итоге, выбор между ферментами и неорганическими катализаторами определяется требованиями реакции и конечными целями, стоит учитывать их особенности и достоинства при выборе подходящего катализатора.
Функции ферментов в клетке
1. Каталитическая активность: Ферменты обеспечивают ускорение химических реакций в клетке путем уменьшения энергии активации. Они позволяют клетке эффективно синтезировать и разлагать молекулы, необходимые для обеспечения ее жизнедеятельности.
2. Регуляция метаболизма: Ферменты играют решающую роль в регуляции метаболических путей клетки. Они контролируют скорость реакций и сбалансированность обмена веществ, обеспечивая необходимую концентрацию продуктов и предотвращая накопление употребленных или токсичных метаболитов.
3. Сигнальные функции: Некоторые ферменты выполняют сигнальные функции, участвуя в передаче сигналов внутри клетки и между клетками. Они могут изменять свою активность в ответ на изменения окружающей среды или внутренние сигналы, помогая клетке адаптироваться к новым условиям и выполнять необходимые функции.
4. Участие в иммунных реакциях: Некоторые ферменты играют роль в иммунных реакциях организма, участвуя в разрушении патогенов и защите от инфекций. Они выполняют функции фагоцитоза, образуют противоинфекционные барьеры и участвуют в адаптивном иммунном ответе.
5. Роль в клеточном росте и делении: Некоторые ферменты контролируют процессы роста и деления клетки. Они регулируют деление ядра, синтез ДНК и белков, обеспечивая нормальное функционирование клетки и ее развитие.
Ферменты в клетке выполняют множество функций, влияя на практически все процессы, происходящие внутри нее. Без них клетка не смогла бы обеспечить свое существование и функционирование.
Каталитическая активность ферментов
Каталитическая активность ферментов обусловлена их специфичной структурой, которая позволяет им взаимодействовать с определенными молекулами-субстратами. Ферменты образуют комплексы с субстратами, активизируют реакции и ускоряют их процесс.
Ферменты действуют по принципу «замка и ключа» — каждый фермент имеет свою уникальную активную центральную область, которая подходит только для определенных субстратов. Это свойство обеспечивает специфичность ферментов и позволяет им точно распознавать и связываться с нужными молекулами.
Каталитическая активность ферментов проявляется в ускорении скорости химических реакций. Они позволяют снизить энергетический барьер реакции, ускоряют диссоциацию и ассоциацию молекул, участвуют в образовании переходного состояния, способствуют снижению энергии активации.
Ферменты могут быть вовлечены во многие биологические процессы, такие как обмен веществ, синтез комплексных молекул, регуляция клеточных функций. Их каталитическая активность определяет возможность жизнедеятельности организмов, обеспечивает поддержание химического равновесия в клетке и выполняет множество других важных функций.
Участие ферментов в метаболических путях
Ферменты играют ключевую роль в многих метаболических путях, которые происходят в живых организмах. Они считаются биологическими катализаторами, ускоряющими химические реакции, которые происходят в организме
Ферменты способны повышать скорость реакций на несколько миллионов раз, что несомненно жизненно важно для организма
Ферменты участвуют во многих метаболических путях, включая процессы дыхания, пищеварения и синтеза новых веществ. Одним из основных метаболических путей, в которых принимают участие ферменты, является гликолиз.
Гликолиз — это процесс расщепления глюкозы, в результате которого образуются пироуват, АТФ и НАДН. Он состоит из ряда химических реакций, каждая из которых катализируется своим ферментом. Одним из ключевых ферментов, участвующих в гликолизе, является гексокиназа, которая катализирует первую реакцию, при которой фосфорилируется глюкоза.
Участие ферментов в метаболических путях позволяет эффективно управлять процессами обмена веществ внутри организма. Это также способствует регуляции энергетического обмена и обеспечивает баланс между анаболическими и катаболическими процессами.
Что нам известно о катализе
Катализ – это процесс изменения скорости химической реакции под влиянием различных веществ – катализаторов, участвующих в этом процессе и к концу реакции остающихся химически неизмененными. Если от добавления катализатора происходит ускорение химического процесса, то такое явление называют положительным катализом, а замедление реакции – отрицательным. Чаще всего приходится встречаться с положительным катализом. В зависимости от химической природы катализаторы разделяются на неорганические и органические. К последним относятся и биологические катализаторы – ферменты.
Для понимания действия катализаторов необходимо кратко остановиться на рассмотрении сущности катализа. Скорость любой химической реакции зависит от столкновений активных молекул реагирующих веществ. Активированной называется молекула, которая имеет определенный запас потенциальной энергии. Взаимодействие двух таких молекул произойдет только в том случае, если запас энергии этих молекул будет достаточным для преодоления сил сталкивания между ними – так называемого «энергетического барьера» реакции. Если реагирующие молекулы будут обладать большей величиной энергии, чем энергетический барьер, то реакция произойдет. Если же запаса энергии реагирующих тел недостаточно для преодоления энергобарьера, то они не будут взаимодействовать. В этом случае для протекания реакции необходимо активировать молекулы, т. е. сообщить им дополнительное количество энергии, которое в сумме с имеющейся потенциальной энергией в молекулах будет достаточным для преодоления энергетического барьера. Это дополнительное энергии называется «энергией активации!». Активировать молекулы можно путем нагревания, повышения давления, облучения др.
Сущность действия катализаторов заключается в том, что во-первых, они обладают способностью активировать молекулы реагирующих веществ, и, во-вторых, взаимодействие молекул (или веществ) происходит не в один, а в несколько этапов.
Таким образом, оказывается, что катализатор не только снижает энергические затраты на течение реакций, но и значительно повышает их скорость.
К основным характеристикам катализаторов относятся следующие: а) катализаторы могут ускорять только те химические реакции, которые вообще могут идти по своим термодинамическим законам, б) катализаторы не изменяют направление хода химической реакции, а только ускоряют достижение состояния равновесия.
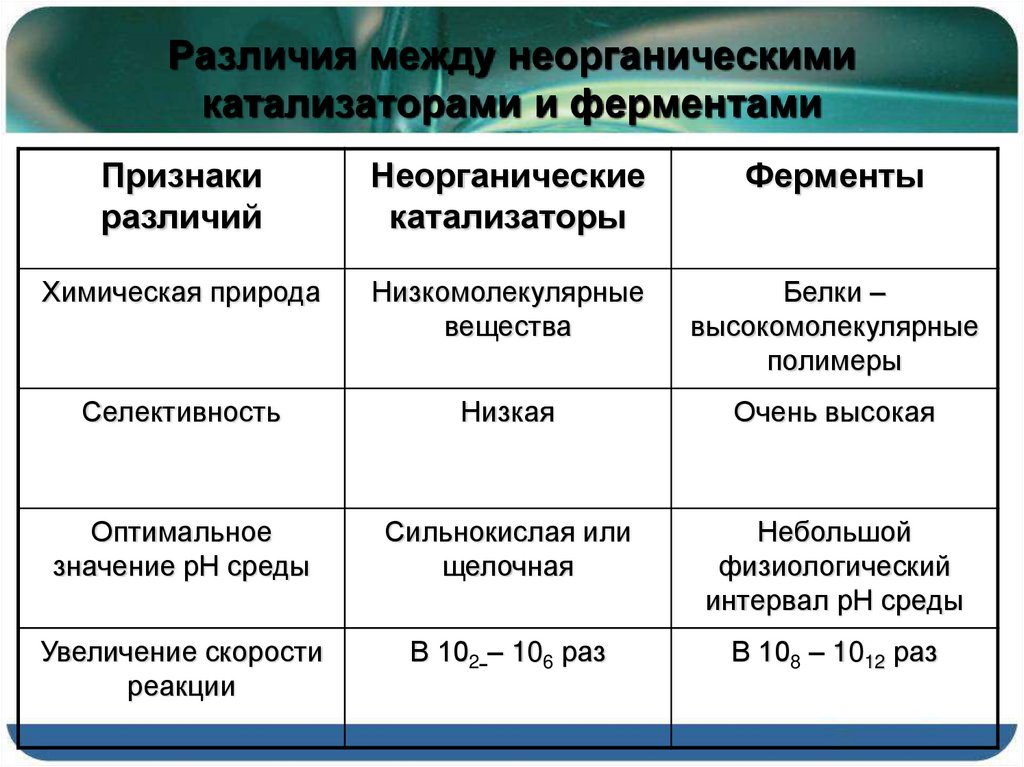
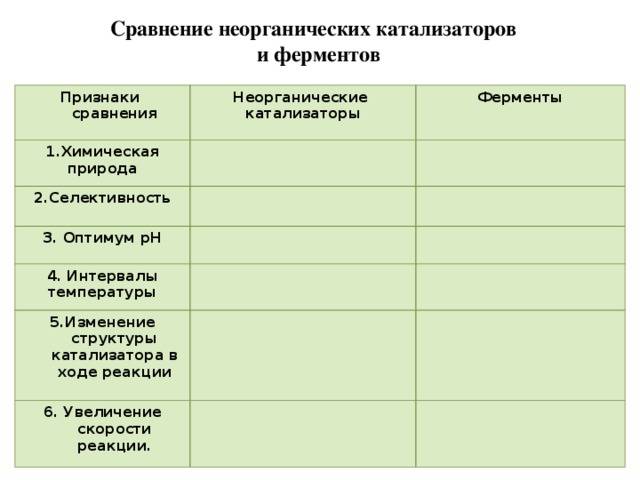
TheDifference.ru определил, что отличие ферментов и неорганических катализаторов заключается в следующем:
Ферменты – высокомолекулярные белковые тела, они довольно специфичны. Ферменты способны катализировать всего лишь один-единственный тип реакции. Они являются катализаторами биохимических реакций. Неорганические катализаторы ускоряют разные реакции.
Ферменты могут действовать в конкретном узком температурном интервале, определенном давлении и кислотности среды.
Ферментативные реакции обладают высокой скоростью.
Отличия:
1. Скорость ферментативных реакций выше, чем реакций, катализируемых неорганическими катализаторами.
2. Ферменты обладают высокой специфичностью к субстрату.
3. Ферменты по своей химической природе белки, катализаторы – неорганика.
4. Ферменты подвержены регуляции (есть активаторы и ингибиторы ферментов), неорганические катализаторы работают нерегулируемо.
5. Ферменты обладают конформационной лабильностью – способностью к небольшим изменениям своей структуры за счет разрыва и образования новых слабых связей.
6. Ферментативные реакции протекают только в физиологических условиях, т. к. работают внутри клеток, тканей и организма (это определенные значения температуры, давления и рН).
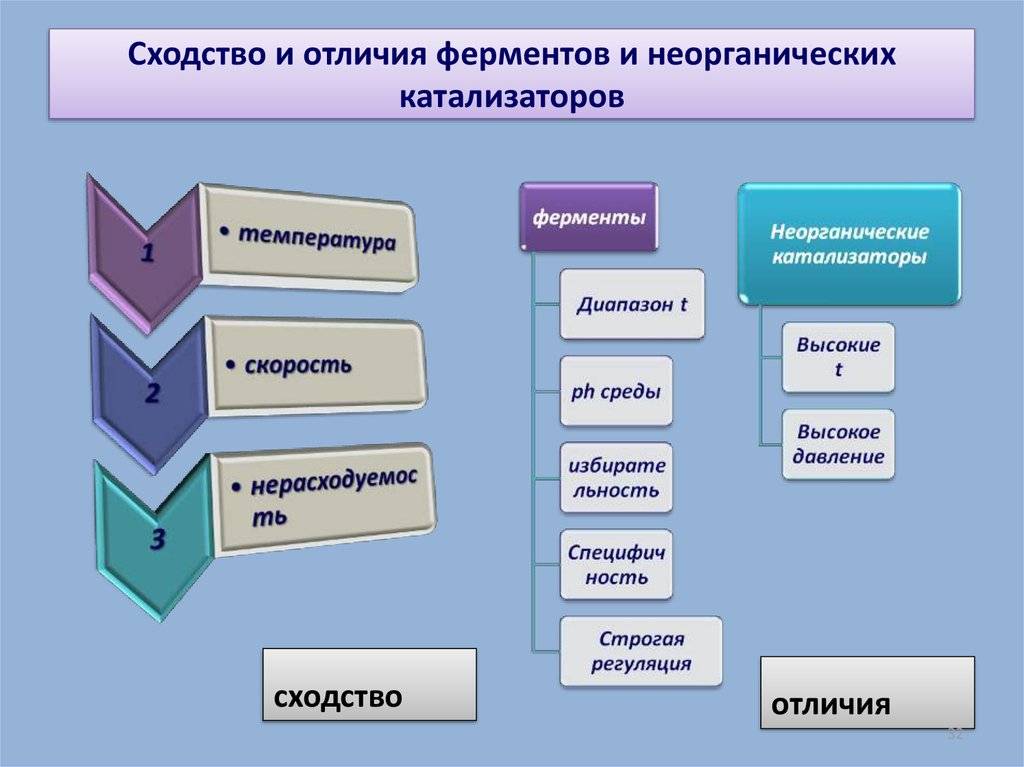
Общие свойства ферментов:
1. Не расходуются в процессе катализа ;
2. Имеют высокую активность по сравнению с катализаторами др. природы;
3. Обладают высокой специфичностью;
4. Лабильность (неустойчивость);
5. Ускоряют только те реакции, которые не противоречат законам термодинамики .
Общие свойства неорганических катализаторов:
1. Химическая природа – низкомолекулярные вещества;
2. В ходе реакции структура катализатора изменяется незначительно, или не изменяется вовсе;
3. Оптимум pH – сильнокислая или щелочная;
4. Увеличение скорости реакции намного меньше, чем при действии ферментов.
Специфичность – очень высокая избирательность ферментов по отношению к субстрату. Специфичность фермента объясняется совпадением пространственной конфигурации субстрата и субстратного центра. За специфичность фермента ответственен как активный центр фермента, так и вся его белковая молекула. Активный центр фермента определяет тип реакции, который может осуществить данный фермент. Различают три вида специфичности: абсолютную, относительную, стереохимическую.
Абсолютная специфичность. Такой специфичностью обладают ферменты, которые действуют только на один субстрат. Например, сахараза гидролизует только сахарозу , лактаза – лактозу, мальтаза – мальтозу, уреаза – мочевину, аргиназа – аргинин и т.д.
Относительная специфичность – это способность фермента действовать на группу субстратов с общим типом связи, т.е. относительная специфичность проявляется только по отношению к определенному типу связи в группе субстратов. Пример: липаза расщепляют сложноэфирную связь в жирах животного и растительного происхождения. Амилаза гидролизует α-гликозидную связь в крахмале, декстринах и гликогене. Алкогольдегидрогеназа окисляет спирты (метанол , этанол и др.).
Стереохимическая специфичность – это способность фермента действовать только на один стереоизомер. Например: 1) L, B-изомерия: L- амилаза слюны и сока поджелудочной железы расщепляет только L-глюкозидные связи в крахмале и не расщепляет D-глюкозидные связи клетчатки; 2) L и В-изомерия: В нашем организме превращения подвергаются только L-аминокислоты, т.к. эти превращения осуществляются ферментами L-оксидазами, способными реагировать только с L-формой аминокислот; 3) Цис-, транс-изомерия: Фумаратгидратаза может превращать только транс-изомер (фумаровую кислоту) в яблочную. Цис-изомер (малеиновая кислота) таким превращениям в нашем организме не подвергается.
Локализация ферментов зависит от их функций. Одни ферменты просто растворены в цитоплазме, другие связаны с определенными органоидами. Например, окислительно-восстановительные ферменты сосредоточены в митохондриях.
Эктоферменты – ферменты, локализующиеся в плазматической мембране и действующие снаружи от нее
Эндоферменты – функционируют внутри клетки. Они катализируют реакции биосинтеза и энергетического обмена.
Экзоферменты – выделяются клеткой в окружающую среду, за пределами клетки расщепляют крупные молекулы на более мелкие осколки и тем самым способствуют проникновению их в клетку. К ним относятся гидролитические ферменты, играющие исключительно важную роль в питании микроорганизмов.
Разница между катализатором и ферментом
Определение
Катализатор: Катализатор – это вещество, которое увеличивает скорость химической реакции без каких-либо постоянных химических изменений.
Фермент: Фермент – это биологическая молекула, вырабатываемая живыми организмами, которая катализирует специфическую биохимическую реакцию при температуре тела.
корреляция
Катализатор: Катализатором могут быть неорганические катализаторы или ферменты.
Фермент: Ферменты являются типом катализатора.
Тип
Катализатор: Неорганические катализаторы представляют собой минеральные ионы или небольшие молекулы.
Фермент: Ферменты – это глобулярные белки.
Разница в размерах
Катализатор:Неорганические катализаторы по размеру аналогичны молекулам субстрата.
Фермент: Ферменты значительно крупнее молекул субстрата.
Молекулярный вес
Катализатор: Неорганические катализаторы имеют низкую молекулярную массу.
Фермент: Ферменты имеют высокую молекулярную массу.
действие
Катализатор: Неорганические катализаторы действуют на физические реакции.
Фермент: Ферменты действуют на биохимические реакции.
Катализатор: Неорганические катализаторы менее эффективны.
Фермент: Ферменты очень эффективны.
специфичность
Катализатор: Неорганические катализаторы могут увеличить скорость разнообразных реакций.
Фермент: Ферменты могут только увеличить скорость конкретной реакции.
Регулятор Молекул
Катализатор: Функция неорганических катализаторов не контролируется молекулами регулятора.
Фермент: Функция ферментов может регулироваться связыванием молекул регулятора с ферментом.
температура
Катализатор: Неорганические катализаторы функционируют при высоких температурах. Они не чувствительны к небольшим изменениям температуры.
Фермент: Ферменты работают при определенной температуре. При низких температурах они неактивны, а при высоких – денатурируются.
pH
Катализатор: Неорганические катализаторы не чувствительны к небольшим изменениям рН.
Ферменты: Ферменты работают только в определенном диапазоне рН.
давление
Катализатор: Как правило, неорганические катализаторы работают при высоком давлении.
Фермент: Ферменты работают при нормальном давлении.
Белковые Яды
Катализатор: Белковые яды не влияют на неорганические катализаторы.
Ферменты: Ферменты могут быть отравлены белковыми ядами.
Коротковолновое излучение
Катализатор: Коротковолновое излучение не влияет на неорганические катализаторы.
Ферменты: Ферменты могут быть денатурированы коротковолновым излучением.
Примеры
Катализатор: Оксид ванадия (V), железо и платина являются примерами неорганических катализаторов.
Фермент: Амилаза, липаза, глюкозо-6-фосфатаза, алкогольдегидрогеназа и аминотрансфераза являются примерами ферментов.
Заключение
Катализатор и фермент – это вещества, которые увеличивают скорость химической реакции за счет снижения энергии активации. Тем не менее, они не влияют или не изменяются в результате реакции. Катализаторы могут быть неорганическими катализаторами или ферментами. Неорганические катализаторы представляют собой ионы металлов или небольшие молекулы, которые катализируют химические реакции живых организмов. Ферменты – это биологические макромолекулы, которые катализируют специфические биохимические реакции внутри живых организмов. Ферменты работают только в мягких условиях. Основное различие между катализатором и ферментом заключается в форме катализаторов, субстратов и способе их каталитических реакций.